İçindekiler
İndirgenme-Yükseltgenme Tepkimesi Nedir?
- Elektrokimya: Elektrik enerjisi ile kimyasal tepkimeler arasındaki ilişkiyi inceleyen kimya disiplinine elektrokimya denir.
- Kimya ve Elektrik = Elektrokimya
- Amacımız elektrik üretmekse bir indirgenme yükseltgenme tepkimesi gerçekleştirmeliyiz.
- İndirgenme-Yükseltgenme tepkimelerinde;
- Ya elektrik akımı oluşur
- Ya da elektrik enerjisi harcanır.
- “İndirgenme-yükseltgenme” tepkimelerinde, adından anlaşılacağı üzere, mutlaka:
- en az bir atom indirgenir (yükü azalır)
- en az bir atom da yükseltgenir (yükü artar).
- Bu tepkimelerde de bütün tepkimelerde olduğu gibi:
- Toplam kütle ve
- Toplam yük korunur.
- Bu tepkimeleri tanımak için tepkimedeki atomların yüklerini (yükseltgenme basamaklarını) hesaplamak gerekir.
- Atom yükü için şu kavramlar da kullanılabilir:
- Yükseltgenme basamağı
- Oksidasyon basamağı
- Değerlik
- Atom yükü için şu kavramlar da kullanılabilir:
Yükseltgenme basamağı (yük) hesaplama ile ilgili eksiği olan arkadaşlar, aşağıdaki bağlantıya tıklayarak, bu eksiklerini kapatabilirler:
İndirgenme (Redüksiyon) Nedir?
- İndirgenmenin diğer adı redüksiyondur.
- İndirgenme tepkimelerinde atomun:
- Yükü azalır, yani ürünlerdeki yükü daha küçüktür.
- Fe3+ + e– → Fe2+
- Elektron alır.
- Yarı çapı artar.
- Yükü azalır, yani ürünlerdeki yükü daha küçüktür.
- Sadece indirgenmenin gerçekleştiği tepkimelere indirgenme yarı tepkimesi (İYT) de denir.
İndirgenme Yarı Tepkimeleri (İYT)
- Bütün indirgenme yarı tepkimelerinde bir atom ya da molekül (kimyasal tür) elektron alır ve yükü azalır.
- Kimyasal tür kaç tane elektron aldıysa, yükü o kadar düşer.
- Alınan elektronlar tepkimenin girenler kısmındadır.
- Aşağıda bu olaya bazı örnekler verilmiştir:
- Al3+ + 3e– → Al
- Fe3+ + e– → Fe2+
- Cl2 + 2e– → 2Cl1-
- Cu2+ + 2e– → Cu
- Ag+ + e– → Ag
Yükseltgenme (Oksidasyon) Nedir?
- Yükseltgenmenin diğer adı redüksiyondur.
- Yükseltgenme tepkimelerinde atomun:
- Yükü artar, yani ürünlerdeki yükü daha büyüktür.
- Fe2+ → Fe3+ + e–
- Elektron verir.
- Yarı çapı azalır.
- Yükü artar, yani ürünlerdeki yükü daha büyüktür.
- Sadece yükseltgenmenin gerçekleştiği tepkimelere yükseltgenme yarı tepkimesi (YYT) de denir.
Yükseltgenme Yarı Tepkimeleri (YYT)
- Bütün yükseltgenme yarı tepkimelerinde bir atom ya da molekül elektron verir.
- Kimyasal tür kaç tane elektron verdiyse, yükü o kadar artar.
- Verilen elektronlar tepkimenin ürünler kısmındadır.
- Aşağıda, bu olaya bazı örnekler verilmiştir:
- Al → Al3+ + 3e–
- Fe2+ → Fe3+ + e–
- 2Cl1- → Cl2 + 2e–
- Cu → Cu2+ + 2e–
- Ag → Ag+ + e–
Yarı Tepkimeleri Denkleştirme
- Bütün tepkime denklemleri gibi, indirgenme ve yükseltgenme yarı tepkimelerine ait denklemler de denkleşmiş olmalıdır.
- Yarı tepkimeler denkleştirilirken aşağıdaki kurallara dikkat edilir:
- Yarı tepkimenin giren ve ürünlerindeki atom sayıları eşitlenir.
- Sonra atomun yükündeki artma veya azalmaya göre alınan-verilen elektron sayısı hesaplanır.
- Atomun katsayısı ile aldığı verdiği elektron çarpılır ve bulunan sayıda elektron denklemin uygun tarafına eklenir.
Örnek:
Mesela klor atomunun -1 grip nötür bir klor molekülüne dönüştüğü yarı tepkimeyi denkleştirelim:
- Tarif edilen tepkimenin denklemi şöyle olmalıdır:
- Cl1- → Cl2
- Cl1- → Cl2 tepkimesinde Cl atomu -1 den sıfıra yükseltgenmiştir.
- O zaman bu tepkime bir yükseltgenme yarı tepkimesidir.
- Tepkimeyi denkleştirmek için önce atom sayılarını eşitleriz:
- 2 tane Cl çıktıysa 2 tane girmek zorundadır:
- 2Cl1- → Cl2
- 2 tane Cl çıktıysa 2 tane girmek zorundadır:
- Sonra elektron sayısını buluruz:
- -1 den sıfıra bir basamak yükselen atom 1 elektron verir. Bu tepkimeyi 2 tane Cl atomu verdiğinden kişi başı 1 elektrondan toplam 2 elektron verilir. Denklemin son hali şöyle olur:
- 2Cl1- → Cl2 + 2e–
- -1 den sıfıra bir basamak yükselen atom 1 elektron verir. Bu tepkimeyi 2 tane Cl atomu verdiğinden kişi başı 1 elektrondan toplam 2 elektron verilir. Denklemin son hali şöyle olur:
- Bütün kimyasal tepkimelerde olduğu gibi, indirgenme ve yükseltgenme yarı tepkimelerinde de girenlerin toplam yükü, ürünlerin toplam yüküne mutlaka eşittir.
- Yükleri toplarken, her bir elektronun -1 yüklü olduğunu unutmamalıyız.
- Yazdığımız, yarı tepkimenin doğru olup olmadığına yük eşitliğini test ederek anlayabiliriz.
Örnek:
Demir atomunun 0’dan, +2’ye yükseltgendiği yarı tepkimeyi yazınız.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Bir indirgenme-yükseltgenme tepkimesine katılan alüminyum atomu, tepkimeye +3 yüklü bir katyon olarak girmiş, nötür olarak çıkmıştır.
Buna göre, alüminyumun yarı tepkimesi nasıl olmalıdır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Bir yanma tepkimesinde, O2 elementi -2 yüklenmiştir.
Buna göre, oksijen elementinin yarı tepkimesi nasıl olmalıdır?
Cevap
Örneğin çözümü:
Redoks (İndirgenme-Yükseltgenme) Tepkimeleri

- Redoks kelimesindeki, “Red”, “redüksiyon” kavramından gelir; “Oks”, “oksidasyon” kavramından gelir.
- Redoks tepkimelerinde , hem indirgenme hem de yükseltgenme tepkimeleri geçekleşir.
- Bir redoks tepkimesi, indirgenme ve yükseltgenme yarı tepkimelerinin birleşimidir.
- Redoks tepkimelerinde, alınan ve verilen elektron sayıları her zaman eşittir.
- Bu yüzden elektronlar sadeleşir ve tepkime denkleminde görünmez.
Redoks Tepkimelerini Tanımak
- Redoks tepkimelerini tanımanın iki yolu vardır:
- Ezberden tanımak
- Yükseltgenme basamağı (yük) hesaplayarak tanımak
- Redoks Tepkimelerini Ezbere Tanımak:
- Bir element bileşiğe dönüşüyorsa ortalıkta e– yoksa, tepkime bir redoks tepkimesidir.
- Yanma tepkimeleri
- Metal-asit tepkimeleri
- Metal-baz tepkimeleri
- Ametal-asit tepkimeleri
- Ametal-baz tepkimeleri
- Metal-su tepkimeleri
- Bir element bileşiğe dönüşüyorsa ortalıkta e– yoksa, tepkime bir redoks tepkimesidir.
- Yük Hesaplayarak Redoks Tepkimelerini Tanımak:
- Tepkimedeki bütün atomların teker teker yükleri (yükseltgenme basamakları) hesaplanır.
- Yükseltgenen ve indirgenen atomlar varsa, tepkime bir redoks tepkimesidir.
Yükseltgenme basamağı hesaplarken, hatırlamamız gereken temel kurallar şunlardır:
- Elementlerin yükü zaten verilmiştir. Verilmemişse sıfırdır.
- Bileşiklerde ve kök iyonlarda, herkesin bir yükü vardır fakat hiç biri görünmez.
- Bileşiklerde, bütün atomların toplam yükü sıfırdır.
- Kök iyonlarda, bütün atomların toplam yükü iyonun yüküne eşittir.
- Yapmamız gereken, bildiğimiz atomların yükünü yazmak, bilmediğimizi hesaplamaktır.
- Bilmediğimiz yükleri hesaplamak için, bileşikteki veya iyondaki herkesin yükü toplanır ve toplam yüke eşitlenir.
Örnek:
CH4 + 2O2 → CO2 + 2H2O
Yukarıda verilen tepkime için aşağıdaki soruları yanıtlayınız.
a) Tepkimedeki bütün atomların yükseltgenme basamaklarını hesaplayınız.
b) Tepkimenin bir redoks tepkimesi olduğunu ispatlayınız.
c) İndirgenme ve yükseltgenme yarı tepkimelerini yazınız.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO
Yukarıda verilen tepkime için aşağıdaki soruları yanıtlayınız.
a) Tepkimedeki bütün atomların yükseltgenme basamaklarını hesaplayınız.
b) Tepkimenin bir redoks tepkimesi olduğunu ispatlayınız.
c) İndirgenme ve yükseltgenme yarı tepkimelerini yazınız.
Cevap
Örneğin çözümü:
Redoks Tepkimelerinin Denkleştirilmesi
- Bir redoks tepkimesini klasik yöntemlerle de denkleştirebiliriz.
Klasik yöntemle, kimyasal tepkimelerin nasıl denkleştirildiğini hatırlamak için aşağıdaki bağlantıya tıklayabilirsiniz:
- Redoks tepkimelerini, klasik yoldan denkleştirmek genellikle zordur. Bu yüzden kendilerine ait denkleştirme yöntemleri vardır.
- Redoks tepkimelerini denkleştirme işlemi, sırasıyla, aşağıdaki kuralları uygulayarak gerçekleştirilir:
- Tepkimedeki bütün atomların yükleri bulunur.
- İndirgenen ve yükseltgenen atomlar tespit edilir ve indirgenme ve yükseltgenme yarı tepkimeleri yazılır.
- Yarı tepkimeler, uygun sayılarla genişletilerek, alınan ve verilen elektron sayıları eşitlenir.
- Alınan-verilen elektron sayıları eşitlendikten sonra, yarı tepkimelerdeki iyonların katsayıları, tepkimedeki bileşiklerinin önüne taşınır.
- Tepkimedeki diğer maddelerin katsayıları, klasik yöntemle hesaplanır.
Örnek:
P + HNO3 + H2O → H3PO4 + NO
Yukarıda verilen tepkimeyi denkleştiriniz.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Cu + HNO3 → Cu(NO3)2 + NO + H2O
Yukarıdaki tepkimeyi denkleştiriniz.
Cevap
Örneğin çözümü:
İndirgen ve Yükseltgen Maddeler
“İndirgenme”, “yükseltgenme”, “indirgen” ve “yükseltgen” kavramlarını anlamak için basit bir benzetme yapalım:

- Bakkal terazisinin bir kefesi yükselirse, karşısındaki kefe aşağı iner. Bu olaya daha yakından bakarsak;
- Yükselen kefe, karşısındakini aşağı indirir.
- Aşağı inen kefe de karşısındaki yükseltir.
- Bu olayı redoks tepkimelerine uyarlarsak:
- Yükseltgenen madde; karşısındaki maddenin indirgenmesini sağladığı için indirgen özellik gösterir.
- Yükseltgenen atomun oluşturduğu madde yükseltgenme ürünüdür.
- İndirgenen madde; karşısındaki maddenin yükseltgenmesini sağladığı için yükseltgen özellik gösterir.
- İndirgenene atomun oluşturduğu madde indirgenme ürünüdür.
- Yükseltgenen madde; karşısındaki maddenin indirgenmesini sağladığı için indirgen özellik gösterir.
Örnek:
Cu+2 + Fe → Cu + Fe+2
Yukarıdaki tepkime için aşağıdaki maddeleri bulunuz.
I) Yükseltgenen
II) İndirgenen
III) Yükseltgen
IV) İndirgen
V) İndirgenme ürünü
VI) Yükseltgenme ürünü
Cevap
Örneğin çözümü:
Bazı İndirgen ve Yükseltgen Maddeler ve Özellikleri
Başlıca indirgen ve yükseltgen maddeler şunlarıdır:

Redoks Tepkimeleriyle Elektrik Enerjisi Arasındaki İlişki
- Elektrik, bir çeşit enerjidir.
- Elektrik akımı, elektronların bir iletken telde hareket etmesi ile oluşur.
- Redoks tepkimelerinde, bir madde elektron verir diğer madde elektron alır.
- Elektron alış-verişi gerçekleştiği için, redoks tepkimeleri ile elektrik enerjisi üretilebilir.
- Kendiliğinden gerçekleşen (istemli) redoks tepkimeleri, kimyasal bağlardaki enerjiyi, elektrik enerjisine dönüştürür.
- İstemli tepkimeler, başlatıldıktan sorna kendi kendine devem edebilenlerdir.
- İstemli redoks tepkimelerinde, elektron alan ve veren maddeler aynı kabın içinde olursa, elektrik akımı oluşmadan elektron alış-verişi gerçekleşir.
- İstemli redoks tepkimelerinde; indirgenme yarı tepkimesini ve yükseltgenme yarı tepkimesini ayrı kaplarda gerçekleştirirsek; kaplar arasında da gerekli bağlantıları kurarsak bir elektrik akımı elde ederiz.
- Piller, bataryalar ve aküler; istemli redoks tepkimeleri ile elektrik üreterek, birçok makine ve cihaza elektrik enerjisi verirler:
- Uzaktan kumandalar
- Cep telefonları
- Tablet bilgisayarlar
- Dizüstü bilgisayarlar
- Elektrikli arabalar
- Pilli oyuncaklar
- Elektrik enerji alarak gerçekleşen redoks tepkimeleri, elektrik enerjisini kimyasal enerjiye dönüştüren tepkimelerdir. Aşağıdaki olaylarda, elektrik akımı ile istemsiz redoks tepkimeleri gerçekleştirir:
- Telefonun, tabletin, dizüstü bilgisayarın… şarj edilmesi
- Akülerin doldurulması
- Bileşiklerin elektrolizi
Örnek:
I) CH4 + 2O2 → CO2 + 2H2O
II) NaCl(k) → Na+(suda) + Cl–(suda)
III) Al + 3HCl → AlCl3 + 3/2H2
IV) HCl + NaOH → NaCl + H2O
Yukarıda verilen tepkimelerden hangileri uygun koşullar sağlandığında elektrik enerjisi üretmek için kullanılabilir?
Cevap
Örneğin çözümü:
Bu bir reklamdır:


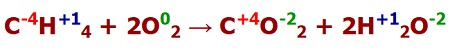




2 yorum “1. İndirgenme-Yükseltgenme Tepkimelerinde Elektrik Akımı”