Kimya ve Elektrik → 3. Bölüm
İçindekiler
- 3. Elektrot Potansiyelleri
- Standart Elektrot Potansiyelleri (Eo)
- Standart Elektrot Potansiyelleri (Eo) ve Tepkime Denklemi İlişkisi
- Standart Elektrot Potansiyelleri (Eo)
- Standart Pil Potansiyeli (Eopil)
- Standart Hidrojen Elektrot (SHE)
- Standart Pil Potansiyeli (Eopil)
- Standart Pil Potansiyeli (Eopil)
- Metallerin Aktifliği
- Metallerin Aktifliği
- Metallerin Aktifliği ve Aşınma
- Metallerin Aktifliği ve Aşınma
- Metallerin Aktifliği ve Aşınma
- Elektrolit Derişimleri 1M Değilse – Nernst Eşitliği
- Elektrolit Derişimleri 1M Değilse – Nernst Eşitliği
- Derişim Pilleri
- Derişim Pilleri
- Pil Potansiyelini Etkileyen Faktörler
- Pil Potansiyelini Etkileyen Faktörler
- Pil Potansiyelini Etkileyen Faktörler
- Pil Potansiyelini Etkileyen Faktörler
- Elektrolitik Hücreler (Şarj Hücresi)
DERS
AYT Kimya
Kimya 12
KONU
ÜNİTE I
KİMYA
ve
ELEKTRİK
III. Bölüm
3. Elektrot Potansiyelleri
Dersin Özellikleri:
- Seviye: Hiç Bilmeyenler İçin
- Gerekli Bilgiler:
- Kimya ve Elektrik – II. Bölüm
- Öğretmen:
- Muzaffer KAYA
Anlatılacak Başlıklar*:
- Elektrot Potansiyelleri (E)
- Standart Pil Potansiyeli (Eopil)
- Standart Hidrojen Elektrot
- Metallerin Aktifliği ve Aşınma
* Konu anlatımı, örneklerle zenginleştirilmiştir.
Standart Elektrot Potansiyelleri (Eo)
- Galvanik hücrede ANOT ve KATOT’u belirlemek için elementlerin standart elektrot potansiyeli (Eo) değerleri kullanılır.
- Elektrot potansiyeli (E): Bir indirgenme veya yükseltgenme tepkimesinin gerçekleşme eğilimini (isteğini) gösteren değerdir.
- Standart elektrot potansiyeli (Eo): Standart koşullarda (1 atm dış basınç ve 25oC sıcaklıkta) hesaplanan E değeridir..
- Al3+ + 3e– → Al Eo = -1,66 V
- Cu → Cu2+ + 2e– Eo = -0,34 V
- Standart elektrot potansiyeli (Eo): Standart koşullarda (1 atm dış basınç ve 25oC sıcaklıkta) hesaplanan E değeridir..
- Standart elektrot potansiyeli 2’ye ayrılır:
- Eoind : Standart indirgenme potansiyeli
- Eoyük : Standart yükseltgenme potansiyeli
- Standart indirgenme potansiyeli: İndirgenme tepkimesinin Eo değeridir.
- Bazı atomların Eo değerleri:
- Al3+ + 3e– → Al Eo = -1,66 V
- Cl2 + 2e– → 2Cl1- Eo = 1,36 V
- Bazı atomların Eo değerleri:
- Standart yükseltgenme potansiyeli: Yükseltgenme tepkimesinin Eo değeridir.
- Bazı atomların Eo değerleri:
- Al → Al3+ + 3e– Eo = 1,66V
- 2Cl– → Cl2 + 2e– Eo = -1,36V
- Bazı atomların Eo değerleri:
Standart Elektrot Potansiyelleri (Eo) ve Tepkime Denklemi İlişkisi
- Tepkime bir sayı ile çarpılırsa Eo değeri değişmez:
- Al3+ + 3e– → Al Eo = -1,66 V
- 2Al3+ + 6e– → 2Al Eo = -1,66 V
- Tepkime ters çevrilirse Eo değeri işaret değiştirir:
- Al3+ + 3e– → Al Eo = -1,66 V
- Al → Al3+ + 3e– Eo = 1,66 V
İndirgenme yarı tepkimesini ters çevirirsek yükseltgenme yarı tepkimesi olur!
- Tepkimeler toplandığında Eo değerleri de toplanır:
Standart Elektrot Potansiyelleri (Eo)
- Eo değeri ne kadar büyükse:
- Yarı tepkime o kadar istemli demektir.
- Elementin o tepkimeye girme eğilimi o kadar çoktur.
Örnek:
- Al3+ + 3e– → Al Eo = -1,66V
- Zn2+ + 2e– → Zn Eo = -0,76V
- Cu2+ + 2e– → Cu Eo = 0,34V
Yukarıda elektrot potansiyelleri verilen metallerin yükseltgenme eğilimlerini karşılaştırınız.
Örnek:
- EX/X+ = 0,55V
- EY2+/Y = 1,25V
- EZ/Z2+ = -1,34V
Yukarıda elektrot potansiyelleri verilen metallerin:
- İndirgenme eğilimlerini karşılaştırınız.
- Elektron verme isteklerini karşılaştırınız.
Standart Pil Potansiyeli (Eopil)
Anot ve Katodun Belirlenmesi
- Bir galvanik hücrede, yükseltgenme potansiyeli yüksek olan elektrot anot, indirgenme potansiyeli yüksek olan elektrot katottur.
- Yani elementler en çok eğilimi olan yarı tepkimeyi verirler.
- Bu yüzden pil tepkimesi istemlidir.
- Yani elementler en çok eğilimi olan yarı tepkimeyi verirler.
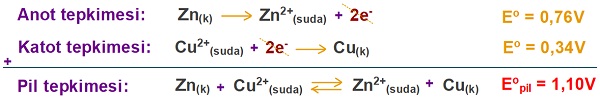
Eopil Hesaplanması
- Anot ve katot tepkimelerinin Eo değerleri ile hesaplanan pil potansiyeline Eopil (standart pil potansiyeli) denir.
- 2 şekilde hesaplanabilir:
- Eopil = Eoyükseltgenme + Eoindirgenme
veya - Eopil = Eoanot + Eokatot
Örnek:
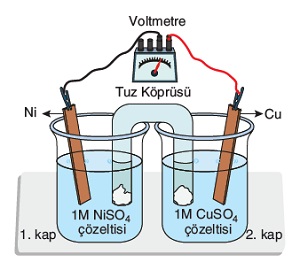
Ni2+(suda) + 2e– → Ni(k) Eo = -0,25V
Cu2+(suda) + 2e– → Cu(k) Eo = +0,34V
Galvanik hücrenin standart pil potansiyelini hesaplayınız.
Standart Pil Potansiyeli (Eopil)
Örnek:

Zn2+(suda) + 2e– → Zn(k) Eo = -0,76V
Cu2+(suda) + 2e– → Cu(k) Eo = +0,34V
Galvanik hücrenin standart pil potansiyelini hesaplayınız.
Standart Hidrojen Elektrot (SHE)
- Elementlerin Eoind veya Eoyük değerlerini hesaplamak için standart hidrojen elektrot kullanırız.
- Standart hidrojen elektrot, standart koşullardaki hidrojen gazı ve platin elektrot ile hazırlanan yarı hücreye denir.
- Hidrojen atomları platin metalinin yüzeyinde indirgenir veya yükseltgenir.
- Pt elektrot katalizördür, pil tepkimesinde görünmez, yani inert elektrottur.
- Standart hidrojen elektrotun potansiyeli keyfi olarak sıfır kabul edilmiştir.
- E2H+/H2 = 0 V
- EH2/2H+ = 0 V
- Bir elementin SHE ile birlikte oluşturduğu hücrede, elementin Eo değeri, hücrenin Eopil değerine eşit olur.

Standart Pil Potansiyeli (Eopil)
Örnek:
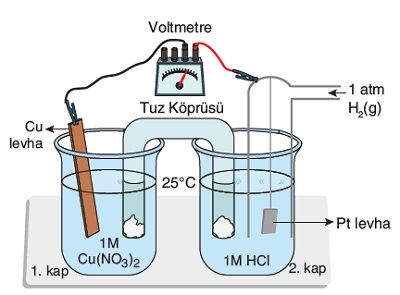
2H+(suda) + 2e– → H2(g) Eo = 0,00V
Cu2+(suda) + 2e– → Cu(k) Eo = +0,34V
Şekildeki galvanik hücre için aşağıda verilenlerden, hangisi ya da hangileri doğrudur. (Cu: 64 g/mol)
I) Dış devrede elektronlar Cu elektrota doğru akar.
II) Eopil = 0,34V olur.
III) Pil şeması: (Pt)H2(g)|H+(1M)||Cu2+(1M)|Cu şeklindedir.
IV) Pil çalışırken; Cu elektrotun kütlesi 6,4 gram artarsa, normal koşullarda 2,24 L H2 gazı tükenir.
Standart Pil Potansiyeli (Eopil)
Örnek:

Şekilde verilen Cd-SHE elektrokimyasal pilinde, Cd elektrotun kütlesi zamanla azalmaktadır. Buna göre;
I) Cd2+ ve H+ iyonlarının indirgenme potansiyellerini kıyaslayınız.
II) Anot, katot ve pil tepkimelerini yazınız.
III) İkinci kabın pH değeri zamanla nasıl değişir?
Metallerin Aktifliği
- Metaller elektron vererek kararlı bir katyon olurlar.
- Yani; elektron verme eğilimi arttıkça metalin aktifliği artar.
- Yani; daha aktif metalin yükseltgenme potansiyeli daha yüksektir.
- Yani; elektron verme eğilimi arttıkça metalin aktifliği artar.
- Soy metallerin yükseltgenme potansiyeli sıfırdan küçüktür ve hidrojenden daha pasiftirler.
- Soy metaller: Cu, Ag, Au, Hg, Pt
- Aktif metallerin yükseltgenme potansiyelleri sıfırdan büyüktür.
- Bazı metallerin aktiflik sıralaması:
- Na > Zn > Fe > H2 > Cu > Ag
- Bazı metallerin aktiflik sıralaması:
Örnek:
Al → Al3+ + 3e– Eo = 1,66V
Cu → Cu2+ + 2e– Eo = -0,34V
Ag → Ag+ + e– Eo = -0,80V
Yukarıda yarı tepkimeleri verilen metalleri aktifliklerine göre sıralayınız.
Metallerin Aktifliği
Örnek:
Ca(k) → Ca2+(suda) + 2e– Eo = 2,86V
Cu2+(suda) + 2e– → Cu(k) Eo = +0,34V
Na+(suda) + e– → Na(k) Eo = -2,71V
Yukarıda, yarı tepkimeleri verilen metalleri elektron verme eğilimlerine göre sıralayınız.
Örnek:
X(k) → X2+(suda) + 2e– EoX
Y(k) → Y2+(suda) + 2e– EoY
Z(k) → Z2+(suda) + 2e– EoZ
Yukarıda, X, Y ve Z metallerinin standart yükseltgenme potansiyelleri verilmiştir.
Bu metallerin, elektron alma eğilimleri Y>X>Z şeklinde ise standart yükseltgenme potansiyellerini sıralayınız.
Metallerin Aktifliği ve Aşınma
- Nötür bir metal bir katyon ile karşılaşırsa şu durumda aşınır/aşınmaz:
- Katyon daha aktifse yükünü vermez, aşınma/tepkime olmaz.
- Metal daha aktifse katyondan yükünü alır, aşınma/tepkime olur.
Aktif olan yükü kapar.
Örnek:

Verilen şekilde, CuSO4 çözeltisine batırılmış Ni metali vardır. Aşağıda, Cu ve Ni metallerinin elektrot potansiyelleri verilmiştir.
Ni → Ni2+ + 2e– Eo = 0,25 V
Cu → Cu2+ + 2e– Eo = – 0,34 V
Buna göre, bu kapta, Ni çubuk aşınır mı? Aşınma gerçekleşirse, aşınma tepkimesinin denklemini yazınız.
Metallerin Aktifliği ve Aşınma
Örnek:

Şekilde verilen kaplar; X, Y ve Z metallerinden yapılmıştır. Kapların içinde ise, bu metallerin sülfat tuzları çözünmüştür. Aşağıda, bu üç metalin elektrot potansiyelleri verilmiştir.
X2+(suda) + 2e– → X(k) Eo = 0,25 V
Y2+(suda) + 2e– → Y(k) Eo = – 1,55 V
Z2+(suda) + 2e– → Z(k) Eo = 0,45 V
Buna göre, hangi çözeltiler bulundukları kapta saklanabilir?
Metallerin Aktifliği ve Aşınma
Örnek:
X2+(suda) + 2e– → X(k) Eo = -0,45 V
Y2+(suda) + 2e– → Y(k) Eo = 1,30 V
Z2+(suda) + 2e– → Z(k) Eo = – 1,45 V
Yukarıda bazı metallerin standart elektrot potansiyelleri verilmiştir.
Buna göre aşağıda verilen tepkimelerden hangilerinin istemli olduğu söylenebilir?
I) X2+ + Y → X + Y2+
II) Y2+ + Z → Y + Z2+
III) Z2+ + X → Z + X2+
Elektrolit Derişimleri 1M Değilse – Nernst Eşitliği

- Bütün Galvanik hücrelerin pil potansiyeli (Epil), Nernst Eşitliği ile hesaplanır.
Nernst Eşitliği:

- Formüldeki sembollerin anlamı şöyledir:
- Epil : Hücrenin pil potansiyeli (Voltaj, emk)
- Eopil : Hücrenin standart pil potansiyeli
- 0,0592 : Nernst sabitini
- n : Pil tepkimesi bulunurken sadeleştirilen elektron sayısıdır.
- Q : Pil tepkimesinin, denge kesridir.
- Denge kesri (Q) şöyle yazılır;
- Pil tepkimesinin denge bağıntısıdır.
- Pil tepkimesindeki ürün ve girenlere bakılarak yazılır.
- Katı ve sıvılar dikkate alınmaz.
- Formülü şöyledir:

Elektrolit Derişimleri 1M Değilse – Nernst Eşitliği
- Elektrolit derişimleri 1M olursa:
- Q değeri de 1 olur.
- Bu durumda;
- log(Q) = log(1) = 0
olur. - Nernst eşitliği de şu hale gelir:
Epil = Eopil
- log(Q) = log(1) = 0
Örnek:
Şekilde verilen hücrenin pil potansiyel (Epil) değerini hesaplayınız.
Derişim Pilleri

- Derişim pillerinde:
- Farklı olan tek şey, yarı hücrelerin elektrot çözeltilerinin derişimleridir.
- Galvanik hücre, derişim farkıyla çalışır.
- Derişimi az olan yarı hücre ANOT görevi yapar.
- Derişimi çok olan yarı hücre KATOT görevi yapar.
- Derişim farkı arttıkça, pil potansiyeli yükselir.
- Pil çalışırken, zamanla, derişim farkı azalır.
- Derişimler eşitlendiğinde, derişim pili bitmiş olur.
- Eopil değerleri her zaman sıfırdır.
- Pil potansiyelleri Nernst Eşitliği ile hesaplanır:

Derişim Pilleri
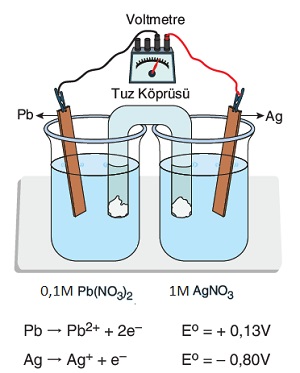
Örnek:

Şekilde verilen Galvanik Hücre ile ilgili olarak, aşağıdaki yargılardan hangisi ya da hangileri doğrudur?
I) Pil potansiyeli olarak 0,03V’tur.
II) Elektronlar 1. kaptan 2. kaba doğru akar.
III) 2. kaba, 450 mL saf su ilave edilirse Epil = 0 olur ve pil durur.
IV) 1. kaba saf su ilave edilirse, pil potansiyeli artar.
V) 1. kaba CuCl2 tuzu ilave edersek, pil potansiyeli artar.
VI) 2. kapta Cu2+(suda) + 2e– → Cu(k) yarı tepkimesi gerçekleşir.
VII) 1. kaba 0,09 mol CuCl2 tuzu eklenip tamamen çözünürse, Epil = 0 olur.
Pil Potansiyelini Etkileyen Faktörler
Zn(k) + Cu2+(suda) ⇄ Zn2+(suda) + Cu(k) + Enerji
- Pil tepkimesi:
- bir denge tepkimesidir.
- ekzotermiktir; elektrik enerjisi üretir.
- Pil tepkimesi bir dengesi tepkimesi olduğundan:
- Bütün denge tepkimeleri gibi, Le Chatelier Prensibi‘ne göre hareket eder:
- Ürünler yönüne kayarsa, pil potansiyeli artar.
- Girenler yönüne kayarsa, pil potansiyeli azalır.
- Anot elektrotu ya da katotta indirgenen iyon tükendiğinde pil bitmiş olur ve şarj edilmesi gerekir.
- Bütün denge tepkimeleri gibi, Le Chatelier Prensibi‘ne göre hareket eder:
Pil Potansiyelini Etkileyen Faktörler
Pil dengesi: Zn(k) + 2H+(suda) ⇄ Zn2+(suda) + H2(g) + Enerji
1. Sıcaklık Etkisi
- Pil dengesi ekzotermik bir denge tepkimesi olduğundan;
- Hücrenin sıcaklığı:
- Artarsa, denge, girenlere kayar ve pil potansiyeli azalır.
- Düşerse, denge ürünlere kayar ve pil potansiyeli artar.
- Hücrenin sıcaklığı:
2. Derişim
- Anot derişimi ürünlerin derişimdir.
- Arttıkça:
- Denge girenler kayar.
- Pil potansiyeli azalır.
- Arttıkça:
- Katot derişimi girenlerin derişimidir.
- Arttıkça:
- Denge ürünlere kayar
- Pil potansiyeli artar.
- Arttıkça:
3. Basınç
- Sadece gazlı tepkimelerde etkilidir.
- Basıncı artan gaz dengeyi karşıya, azalan gaz kendine çeker.
4. Metal Elektrotlar
- Katı ve sıvılar dengeyi etkilemediğinden, elektrot olarak kullanılan metallerin kütlesi ve yüzey alanının değişmesi gibi değişikler, dengeyi etkimez.
Pil Potansiyelini Etkileyen Faktörler
Örnek:

Şekilde verilen elektrokimyasal pille ilgili,
I. Pil potansiyeli 1,932 V olur.
II. Zamanla Mg elektrodun kütlesi azalır.
III. Katot yarı hücresinde Cr2+ derişimi artar.
IV. Ag elektrot Fe metali ile kaplanır.
yargılarından hangileri doğrudur?
Pil Potansiyelini Etkileyen Faktörler
Örnek:

Şekilde verilen sistemdeki metallerin aktiflikleri Mg > Cu > Ag şeklindedir.
Buna göre aşağıdaki ifadelerden hangisi yanlıştır?
(MgS için Kçç=10-12 )
A) Anotta Mg → Mg2+ + 2e– yarı reaksiyonu gerçekleşir.
B) Dış devreden elektronlar Mg elektrottan Cu elektrota doğru akmaktadır.
C) Elektrik akımı I. kaptan II. kaba doğrudur.
D) Katotta ilk önce Cu2+ + 2e– → Cu yarı reaksiyonu gerçekleşir.
E) II. kaba (NH4)2S katısı eklendiğinde pil potansiyeli artar.
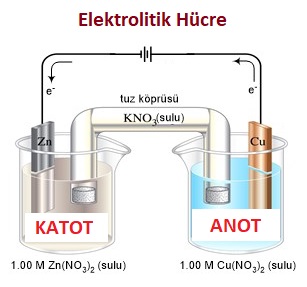
Elektrolitik Hücreler (Şarj Hücresi)
- Galvanik hücreleri şarj etmek için üreteç takılır.
- Üretecin potansiyeli pil potansiyelinden yüksek olmalıdır.
- Şarj esnasında:
- Hücre elektrolitik hücre adını alır.
- İstemsiz bir redoks gerçekleşir.
- Anot ve Katot yer değiştirir.
- Anot-katot olayları değişmez.
- Üretecin kutupları buna göre takılmalıdır.


Kimya ve Elektrik
III. Bölüm
(Elektrotlar Potansiyelleri)
Bitti 🙁
