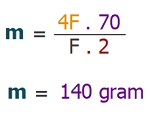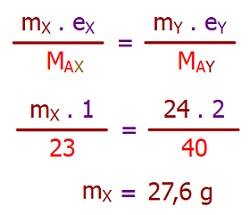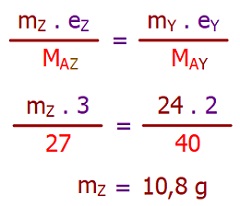İçindekiler
- Elektroliz olayı, elektrik enerjisinin zoruyla bir redoks tepkimesinin gerçekleştirilmesidir.
- Elektroliz olayında gerçekleşen redoks tepkimeleri istemsizdir.
- Elektrolitik hücreler de bir çeşit elektroliz hücresidir.
Elektrolitik Hücreler ile ilgili detaylı bilgi için aşağıdaki bağlantıyı tıklayabilirsiniz.
Tek Kaplı Elektroliz Hücresi
- Elektroliz sorularında genellikle tek kaplı elektroliz hücreleri ile karşılaşacağız.
- Tek kaplı elektroliz hücrelerinde;
- elektrotlar, aynı kabın içine konulur,
- indirgenme ve yükseltgenme yarı tepkimeleri tek bir kapta gerçekleşir.
Aşağıda, NaCl sıvısına ait bir elektroliz hücresi verilmiştir:

Elektroliz Olayında Neler Olur?
- Tek kaplı elektroliz hücrelerinde; zıt yüklü iyonlar birbirini çekeceği için, elektroliz edilen bileşiğin iyonları, yüklerine göre zıt kutuplara giderler. Buna göre;
Anot Kutbu
Anot kutbunun her zaman pozitif (“+”) kutup olduğunu unutmayalım.
- Üretecin artı kutbuna bağlı elektrottur.
- Anot elektrota anyonlar (- yüklü iyonlar) gider.
- Anota giden anyon yükseltgenir.
- Anyonlar genellikle, ametal iyonlarıdır.
- Yükseltgenen anyonlar; yükünü kaybeder ve element haline geçer:
- 2F– → F2(g) + 2e–
- 2Cl– → Cl2(g) + 2e–
- 2O2- → O2(g) + 4e–
- Anot kutbunda, birden fazla anyon varsa, önce hangisinin yükseltgeneceğine aşağıdakilerden herhangi birini tespit ederek karar veririz:
- Yükseltgenme potansiyeli daha büyük olan anyon önce yükseltgenir.
- Veya elektron verme isteği daha büyük olan anyon önce yükseltgenir.
- Veya daha pasif olan ametal önce yükseltgenir.
- Bir anyon yükseltgenirse; yükünü kaybeder ve nötür bir ametal elementi haline geçer (O2, F2, Cl2 gibi). Bu hiç bir ametalin hoşuna giden bir olay değildir. Bu yüzden, aktif olan ametaller, bu olayda geri dururlar, önce pasif ametaller yükseltgenir.
- 7A grubu ametalleri
- O-2 iyonu
- OH– iyonu; aktif anyonlar olduğundan, yükseltgenme sırasında son sıralarda olacaklardır.
- Örneğin NaCl sıvısının elektrolizinde, anot kutbunda (+), tuzun anyonu (-) olan Cl– iyonu yükseltgenir. Yükseltgenme yarı tepkimesi şöyledir:
- 2Cl– → Cl2(g) + 2e–
Katot Kutbu
Katot kutbunun her zaman negatif (“-“) kutup olduğunu unutmayalım.
- Üretecin eksi kutbuna bağlı elektrottur.
- Katot elektrota katyonlar (+ yüklü iyonlar) gider.
- Katota giden katyon indirgenir.
- Katyonlar genellikle metal iyonlarıdır.
- İndirgenen katyonlar; yükünü kaybeder ve element haline geçer.
- Katot kutbunda, birden fazla katyon varsa, önce hangisinin indirgeneceğine, aşağıdakilerden herhangi birini tespit ederek karar veririz:
- İndirgenme potansiyeli daha büyük metal önce indirgenir.
- Veya, elektron alma isteği daha büyük olan metal önce indirgenir.
- Veya, daha pasif olan metal önce indirgenir.
- Bir metalin katyonu indirgenirse; yükünü kaybeder ve nötür bir metal elementi haline geçer. Bu hiç bir metalin hoşuna giden bir olay değildir. Bu yüzden, aktif olan metaller, bu olayda geri dururlar, önce pasif metaller indirgenir. 1A ve 2A grubu metalleri, aktif metaller olduğundan, indirgenme sırasında sona sıralarda olacaklardır.
- Örneğin NaCl sıvısının elektrolizinde, katot (-) kutbunda, Na+ iyonu indirgenir. Çünkü bu iyon tuzun katyonudur. İndirgenme yarı tepkimesi şöyledir:
- Na+ + e– → Na(k)
Örnek:

Yukarıda; NaCl(s), KBr(s) ve FeCl3(s) sıvılarının bulunduğu bir elektroliz kabı verilmiştir.
Buna göre bu kap ile ilgili olarak aşağıdaki soruları cevaplandırınız. (Elektron verme eğilimleri K > Na > Fe > Br– > Cl– dir.)
I) Anot ve katotta tepkimeye girecek iyonları belirtiniz.
II) Anotta ve katotta hangi iyonlar öncelikle elektroliz olur?
III) Anotta ve katotta ilk olarak gerçekleşecek tepkimeleri yazınız.
Cevap
Örneğin çözümü:
Faraday Kanunları
- Elektroliz olayında verilen elektrik enerjisi sayesinde, anot ve katotta yarı tepkimeler gerçekleşir.
- Bu tepkimeler sonucunda; anot ve katot kutbunda elementler birikir.
- Biriken elementlerin miktarını hesaplamak için Faraday Kanunları kullanılır.
Faraday Kanunları iki tanedir:
1. Kanun
- Elektroliz devresinden ne kadar çok elektrik yükü geçerse anot ve katotta biriken madde miktarı da o kadar çok olur.
- Devreden geçen elektrik yükü 1 Faraday (F) olduğunda; devreden 96500 C yük ve 1 mol elektron geçmiş demektir:
1 mol e– = 96500 C = 1F
- Bu kanuna göre; bir elektroliz kabında kutuplarda biriken element kütlesi (m) şöyle hesaplanır:

Formüldeki sembollerin anlamları şöyledir:
- m: Anot ya da katotta biriken elementin gram olarak kütlesi.
- MA: Biriken elementin mol ağırlığı
- n: Elementin aldığı ya da verdiği elektron sayısı
- Q: Devreden geçen yük miktarı. Birimi Coloumb’dur. Bir devreden geçen akım ve bu akımını kaç saniye geçtiği biliniyorsa, yük miktarı, aşağıdaki formülle hesaplanabilir:
- Q = I . t
- I: Devreden geçen elektrik akımı (Birimi Amper’dir.)
- t: Saniye olarak akımın verildiği süredir.
Örnek:
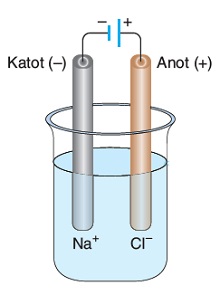
Yukarıda verilen şekil, sıvı NaCl tuzunun elektrolizine aittir.
Buna göre, bu olay ile ilgili olarak, aşağıda verilen yargılardan hangileri doğrudur?(Na: 23 g/mol, Cl: 35 g/mol)
I) Kapta gerçekleşen tepkimenin denklemi şöyledir:
2Na+(suda) + 2Cl–(suda) → 2Na(k) + Cl2(g)
II) Devreden 9650 C’luk akım geçerse, katota 2,3 gram Na metali birikir.
III) Devreden 4F akım geçerse, anotta 2 mol Cl2 gazı oluşur.
IV) Devreden 1,93 Amperlik akım, 16 dakika ve 40 saniye boyunca geçerse, katotta biriken element kütlesi 4,6 gram olur.
Cevap
Örneğin çözümü:
2. Kanun
- Faraday’ın 2 kanunu, seri bağlı elektroliz hücreleri ile ilgilidir.

- Seri bağlı elektroliz devrelerinde, kapların her birinden eşit sayıda elektron geçer.
- Bu yüzden, elektroliz kaplarının her bir kutbundan geçen:
- Elektron sayısı
- Yük miktarı
- Elektronların mol sayısı eşittir.
- Geçen yük ile, biriken elementlerin eşdeğer kütleleri doğru orantılıdır.
- Bir elektroliz kabında kutuplardan birinde biriken elementin kütlesi biliniyorsa, diğer kutuplarda biriken elementlerin kütleleri de hesaplanabilir:

Formüldeki sembollerin anlamları şöyledir:
- m1: Birinci kabın anot ya da katodunda biriken element miktarı
- m2: İkinci kabın anot ya da katodunda biriken element miktarı
- e1: Birinci kabın anot ya da katodunda biriken elementin aldığı-verdiği elektron sayısı
- e2: İkinci kabın anot ya da katodunda biriken elementin aldığı-verdiği elektron sayısı
- MA1: Birinci kabın anot ya da katodunda biriken elementin mol ağırlığı
- MA2: İkinci kabın anot ya da katodunda biriken elementin mol ağırlığı
Hangi Kapta Daha Çok Element Birikir?
- Seri bağlı elektroliz kaplarında, kutuplarda ve eşit sürede biriken elementlerden eşdeğer kütlesi daha büyük olan elementin kütlesi daha büyüktür.
- Bir elementin, eşdeğer kütlesi şöyle hesaplanır:

- MA: Elementin mol ağırlığı
- e–: Elementin aldığı veya verdiği elektron sayısıdır. Metaller için bu değer, metalin yüküne eşittir.
Tuzların Elektrolizi
- Tuzlar katı halde iken elektriği iletmezler ve elektroliz olamazlar.
- Bir tuzun elektroliz edilmesi için; ya sıvı halde olması ya da suda çözünmüş olması gerekir.
- Elektrik enerjisi verilerek, tuz bileşiği elementlerine ayrıştırılabilir.
Örnek:

Şekildeki özdeş kaplarda, grafit elektrotlar kullanılarak; XCl, YF2 ve ZBr3 eriyikleri elektroliz edilmektedir.
Bu elektroliz düzeneği için aşağıdaki soruları cevaplandırınız. (X: 23 g/mol, Y: 40 g/mol, Z: 27 g/mol)
I) Bu elektroliz düzeneğinde, aynı sürede, katotlarda biriken elementlerin kütleleri arasındaki ilişki nedir?
II) Ortadaki kabın katot kutbunda, 24 gram madde element oluştuğu anda, diğer kapların katotlarında kaçar gram madde birikir?
III) XCl sıvısının bulunduğu kapta, 2,3 gram X metali birikirse, ortadaki kabın anotundan kaç mol elektron geçmiş olur?
Cevap
Örneğin çözümü:
Suyun Elektrolizi
- Elektroliz işleminin kullanım alanlarından biri de suyun elektrolizidir.
- Saf su elektroliz bir sıvı değildir, yani saf suyun elektrik iletkenliği çok düşüktür. Bu yüzden saf su elektroliz edilirken, elektrik iletkenliği kazanması için, içinde bir miktar asit (derişik H2SO4) çözülür.
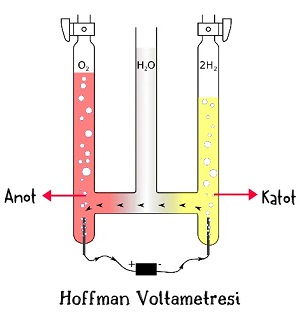
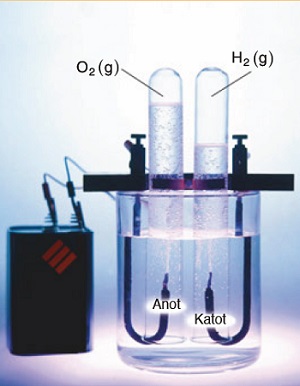
- Suyun elektrolizi sonucunda anot kutbunda oksijen gazı (O2(g)), katot kutbunda ise hidrojen gazı (H2(g)) birikir.
- Suyun elektrolizinde, katotta biriken hidrojen gazının hacmi, anotta biriken oksijen gazının hacminin iki katıdır.
- Suyun elektrolizi olayında anot ve katot tepkimeleri şöyledir:

- Elektroliz tepkimesinden anlıyoruz ki, suyun elektrolizi için kullanılan üretecin, 2,06 Volttan daha yüksek bir elektrik enerjisi uygulaması gerekir.
- Suyun elektrolizi için hazırlanmış özel bir düzenek te vardır. “Hoffman Voltametresi” adındaki bu düzenek ile elde edilen hidrojen ve oksijen gazlarının düzenekten alınması da kolaydır.
Aşağıdaki resim, bir Hoffman Voltametresine aittir: