İçindekiler
- Elektrot Potansiyeli (E) Nedir?
- Bazı Elementlerin Standart İndirgenme Potansiyelleri
- Eo Değerinin Yorumlanması
- Standart Pil Potansiyeli (Eopil)
- Anot ve Katodun Belirlenmesi
- Standart Hidrojen Elektrot
- Aktiflik
- Derişim 1M Değilse (Nernst Eşitliği)
- Pil Potansiyelini Etkileyen Faktörler
- Elektrolitik Hücreler (Şarj Düzeneği)
Elektrot Potansiyeli (E) Nedir?
- Galvanik hücrede ANOT ve KATOT’u belirlemek için elementlerin elektrot potansiyeli (E) değerleri kullanılır.
- Elektrot potansiyeli (E): Bir indirgenme veya yükseltgenme tepkimesinin gerçekleşme eğilimini (isteğini) gösteren değerdir.
- Standart elektrot potansiyeli (Eo): Standart koşullarda (1 atm dış basınç ve 25oC sıcaklıkta) hesaplanan E değeridir..
- Al3+ + 3e– → Al Eo = -1,66 V
- Cu → Cu2+ + 2e– Eo = -0,34 V
- Standart elektrot potansiyeli 2’ye ayrılır:
- Eoyük : Standart yükseltgenme potansiyeli
- Eoind : Standart indirgenme potansiyeli
- Standart elektrot potansiyeli (Eo): Standart koşullarda (1 atm dış basınç ve 25oC sıcaklıkta) hesaplanan E değeridir..
1. Standart yükseltgenme potansiyeli:
- Bir elementin yükseltgenme yarı tepkimesinin Eo değeridir.
- Bazı atomların Eo değerleri:
- Al → Al3+ + 3e– Eo = 1,66V
- 2Cl– → Cl2 + 2e– Eo = -1,36V
- Fe2+ → Fe3+ + e– Eo = – 0,77 V
- Cu → Cu2+ + 2e– Eo = – 0,34 V
- Ag → Ag+ + e– Eo = – 0,80 V
- Bazı atomların Eo değerleri:
- Elementin yükseltgenme eğiliminin ölçüsüdür.
- Değer ne kadar büyükse, elementin yükseltgenme isteği/yeteneği/potansiyeli/ o kadar yüksek demektir.
- Elektron verme isteği olarak yorumlanır.
- Metalik bir özelliktir.
- Standart yükseltgenme potansiyeli daha yüksek olan metal daha aktiftir.
- Ametallerde düşüktür.
2. Standart indirgenme potansiyeli:
- Bir elementin indirgenme yarı tepkimesinin Eo değeridir.
- Bazı atomların Eo değerleri:
- Al3+ + 3e– → Al Eo = -1,66 V
- Cl2 + 2e– → 2Cl1- Eo = 1,36 V
- Fe3+ + e– → Fe2+ Eo = 0,77 V
- Cu2+ + 2e– → Cu Eo = 0,34 V
- Ag+ + e– → Ag Eo = 0,80 V
- Bazı atomların Eo değerleri:
- Elementin indirgenme eğiliminin ölçüsüdür.
- Değer ne kadar büyükse, elementin indirgenme isteği/yeteneği/potansiyeli/ o kadar yüksek demektir.
- Elektron alma isteği olarak yorumlanır.
- Ametalik bir özelliktir.
- Standart indirgenme potansiyeli daha yüksek olan ametal daha aktiftir.
- Metallerde düşüktür.
Bazı Elementlerin Standart İndirgenme Potansiyelleri
Eo – Tepkime Denklemi İlişkisi
- Bir indirgenme ya da yükseltgenme yarı tepkimesi, her hangi bir sayı ile çarpılırsa, Eo değeri bu işlemden etkilenmez:
Al → Al3+ + 3e– Eo = 1,66 V
2Al → 2Al3+ + 5e– Eo = 1,66 V - Bir indirgenme ya da yükseltgenme yarı tepkimesi, ters çevrilirse; Eo değeri işaret değiştirir:
Al → Al3+ + 3e– Eo = 1,66 V
Al3+ + 3e– → Al Eo = – 1,66 V - Bir indirgenme yarı tepkimesinin tersi yükseltgenme yarı tepkimesidir.
- Bir yükseltgenme yarı tepkimesinin tersi ise indirgenme yarı tepkimesidir.
- YYT: Yükseltgenme yarı tepkimesi demektir.
- İYT: İndirgenme yarı tepkimesi demektir.
YYT: Al → Al3+ + 3e– Eo = 1,66 V
İYT: Al3+ + 3e– → Al Eo = – 1,66 V
Eo Değerinin Yorumlanması
- Bir yükseltgenme yarı tepkimesinde Eo değeri ne kadar büyükse;
- atom, yükseltgemeye o kadar istekli
- yükseltgenme potansiyeli o kadar yüksek
- yükseltgenme eğilimi o kadar yüksek
- atomun elektron verme isteği o kadar fazla
- atom o kadar iyi bir indirgen
- atom metalse o kadar aktif bir metal
- atom ametalse o kadar pasif bir ametal demektir.
- Bir indirgenme yarı tepkimesinde Eo değeri ne kadar büyükse;
- atom, indirgenmeye o kadar istekli
- indirgenme potansiyeli o kadar yüksek
- indirgenme eğilimi o kadar yüksek
- atomun elektron alma isteği o kadar fazla
- atom, o kadar iyi bir yükseltgen
- atom ametalse o kadar aktif bir ametal
- atom metalse o kadar pasif bir metal demektir.
Örnek:
Zn2+ + 2e– → Zn Eo = -0,76 V
Ag+ + e– → Ag Eo = 0,80 V
Yukarıda verilen yarı tepkimelerin standart potansiyellere bakarak elementlerin özelliklerini yorumlayınız.
Örneğin çözümü:
Standart Pil Potansiyeli (Eopil)
- Anot ve katot tepkimelerinin Eo değerleri ile hesaplanan pil potansiyeline Eopil (standart pil potansiyeli) denir.
- Standart pil potansiyeli anot ve katot tepkimelerine bakılarak hesaplanır.
- Anot ve katotta gerçekleşen yarı tepkimelerin Eo değerlerinin toplamı Eopil değerini verir:
- Eopil = Eoyükseltgenme + Eoindirgenme
veya - Eopil = Eoanot + Eokatot
- Eopil = Eoyükseltgenme + Eoindirgenme
Eopil Değerinin Yorumlanması
- Bir elektrokimyasal hücrenin Eopil değeri;
- Sıfırdan büyükse:
- standart koşullarda istemlidir
- elektrik üretir
- istemli bir redoks tepkimesi gerçekleşir.
- Sıfırdan küçükse:
- standart koşullarda istemsizdir
- elektrik enerjisi tüketerek çalışır
- istemsiz bir redoks tepkimesi gerçekleşir.
- Sıfırdan büyükse:
- Eğer hücre standart koşullarda değilse aynı yorumları Epil değeri için yaparız.
- Epil ifadesi aşağıdaki başlıklarda açıklanmıştır.
Anot ve Katodun Belirlenmesi
- Bir galvanik hücrede anot ve katot görevi yapacak elektrotlara karar verirken şunlara dikkat edilir:
- Elektrotların indirgenme veya yükseltgenme potansiyellerine bakılır:
- Yükseltgenme potansiyeli yüksek olan elektrot anot,
- İndirgenme potansiyeli yüksek olan elektrot katot görevi yapar.
- Yani elementler en çok eğilimi olan yarı tepkimeyi verirler.
- Bu yüzden pil tepkimesi istemlidir.
- Yani elementler en çok eğilimi olan yarı tepkimeyi verirler.
- Elektrotların indirgenme veya yükseltgenme potansiyellerine bakılır:
- ALTERNATİF YOL: Anot ve katoda karar vermenin bir diğer yolu da metal elektrotların aktifliğine bakmaktır. Daha aktif olan metal her zaman anot görevi yapar.
Örnek:
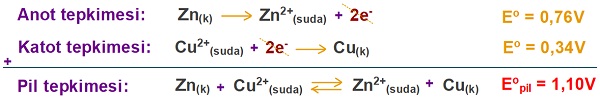
Ni2+(suda) + 2e– → Ni(k) Eo = -0,25V
Cu2+(suda) + 2e– → Cu(k) Eo = +0,34V
Galvanik hücrenin standart pil potansiyelini hesaplayınız.
Standart Hidrojen Elektrot

- Elementlerin standart elektrot potansiyellerini ölçmek için, Standart Hidrojen Elektrot kullanılır.
- Standart Hidrojen Elektrotun yapısında şunlar vardır:
- 1 atm basınçtaki H2 gazı
- Pt (platin) elektrot
- 1M HCl çözeltisi
- Standart Hidrojen Elektrotta, hidrojen elementi indirgenir ya da yükseltgenir.
- Hidrojenin yarı tepkimesi, Pt elektrotun yüzeyinde gerçekleşir.
- Yani Pt, katalizör olarak kullanılır, hücre tepkimesine katılmaz.
- Bu şekildeki elektrotlara inert elektrot denir.
- İnert elektrotları genellikle yarı hücre potansiyelinin sabit kalmasını istediğimiz durumlarda tercih ederiz.
- Hidrojen elementinin, indirgenme ve yükseltgenme potansiyeli keyfi olarak sıfır kabul edilmiştir:
- H2(g) → 2H+(suda) + 2e– Eo = 0,00V
- Bir elementin standart elektrot potansiyelini ölçmek için:
- O element ile Standart Hidrojen Elektrot arasında bir galvanik hücre oluşturulur.
- Hidrojenin potansiyeli sıfır olduğu için; galvanik hücrenin ürettiği elektrik, o elementin elektrot potansiyelini gösterir.
- Bu şekilde, bütün elementlerin standart elektrot potansiyelleri ölçülür.
Örnek:
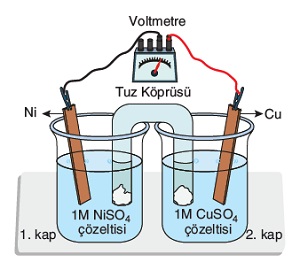
Standart koşullarda bulunan ve yukarıda verilen düzenekte, Cu elektrotun kütlesi zamanla artmaktadır. Buna göre aşağıda verilenlerden, hangisi ya da hangileri doğrudur. (Cu: 64 g/mol)
- H2 gazının basıncını arttırmak, pil gerilimini arttırır.
- 2. kaba NaOH katısı eklemek, pil gerilimini arttırır.
- Sıcaklığı 50oC’ye yükseltmek pil gerilimini arttırır.
- Dış devrede elektronlar Cu metaline doğru akar.
- Pil şeması: (Pt)H2(g)|H+(1M)||Cu2+(1M)|Cu şeklindedir.
- Pil çalışırken; Cu elektrotun kütlesi 6,4 gram artarsa, normal koşullarda 2,24 L H2 gazı tükenir.
Aktiflik
- “Aktiflik” kavramını bir kimyasal türün tepkimelere karşı ne kadar istekli olduğunu belirtir.
- Aktifliği düşük olan kimyasal türlere pasif denir.
- Aktif maddeler, kimyasal tepkimelere kolayca girebilirken, pasif maddelerin kimyasal tepkimelere katılmaları zordur.
- Pasif maddelere; inert, asal ya da soy maddeler de denir.
- Aktif maddeler, kimyasal tepkimelere kolayca girebilirken, pasif maddelerin kimyasal tepkimelere katılmaları zordur.
- Tepkimeye giren elementlerin aktifliğini bilmek, bir redoks tepkimesinin istemli olarak gerçekleşip gerçekleşmeyeceğine karar vermek için gereklidir.
- Hangi elementin daha aktif olduğuna karar verirken, elektrot potansiyelleri (E0indirgenme veya Eoyükseltgenme değerleri) kıyaslanır.
Peki; E0indirgenme değeri daha büyük olan mı daha aktiftir, E0yükseltgenme değeri daha yüksek olan mı?
İşte bu sorunun cevabı, “Bir metalden mi bahsediyoruz yoksa bir ametalden mi bahsediyoruz?” sorusunun cevabına bağlıdır. Devam edelim.
Metalik Aktiflik
- Metal atomları, elektron verdiklerinde (yükseltgendiklerinde) çok mutlu olurlar ve kararlı hale geçerler. Bu yüzden:
- Elektron verme potansiyeli daha yüksek olan metal daha aktiftir.
- Elektron alma potansiyeli (isteği) daha düşük olan metal daha aktiftir.
- Yükseltgenme potansiyeli daha yüksek olan metal daha aktif metaldir.
- İndirgenme potansiyeli daha düşük olan metal daha aktiftir.
- Başka bir açıdan bakarsak; daha aktif olan metal şu özellikleri gösterir:
- Yükseltgenme potansiyeli daha yüksektir.
- İndirgenme potansiyeli daha düşüktür.
- Daha iyi bir indirgendir.
- Daha kötü yükseltgendir.
- Elektron verme eğilimi daha yüksektir.
- Elektron ilgisi daha düşüktür.
- Elektron alma eğilimi daha düşüktür.
- Hidrojen metalik aktiflik konusunda bir sınır görevi yapar:
- Yükseltgenme potansiyeli hidrojen elementinden daha büyük olan metaller aktif metaller olarak sınıflandırılır.
- En aktif metaller su ile bile tepkimeye girebilir.
- Bütün aktif metaller asitlerle tepkimeye girer.
- Yükseltgenme potansiyeli hidrojen elementinden daha küçük olan metaller pasif metallerdir.
- Soy metaller pasif metallerdir:
- Cu, Ag, Au, Hg, Pt (Cumhur Aganın Aucunda Cıva Ptladı)
- Cu, Ag ve Hg soy metalleri ise sadece H2SO4 ve HNO3 ile tepkimeye girer.
- Au ve Pt’nin asitlerle ve suyla tepkimesi yoktur.
- Soy metaller pasif metallerdir:
- Yükseltgenme potansiyeli hidrojen elementinden daha büyük olan metaller aktif metaller olarak sınıflandırılır.
Örnek:
Al3+ + 3e– → Al Eo = – 1,66 V
Cu → Cu2+ + 2e– Eo = – 0,34 V
Ag+ + e– → Ag Eo = 0,80 V
Na → Na+ + e– Eo = 2,71 V
Yukarıda, standart elektrot potansiyelleri verilen metaller için, aşağıdaki soruları cevaplandırınız.
a) Aktiflik sıralamasını yapınız.
b) Elektron alma eğilimini sıralayınız.
c) İndirgen özelliklerine göre sıralayınız.
d) Yükseltgenme eğilimlerini sıralayınız.
Cevap
Örneğin çözümü:
Ametalik Aktiflik
- Ametallerde, aktiflik kuralları, metallerin tam tersidir.
- Çünkü, metallerin aksine ametallerin değerlik elektron sayıları 8’e yakındır.
- Yani, oktetlerini tamamlamak için genellikle bir iki elektron almaları yeterli olmaktadır.
- Bu yüzden, ametaller, elektron aldıklarında (indirgendiklerinde) çok mutlu olurlar ve kararlı hale geçerler.
- Yine bu bu yüzden:
- Elektron alma potansiyeli daha yüksek olan ametal daha aktiftir.
- Elektron verme potansiyeli (isteği) daha düşük olan ametal daha aktiftir.
- Yükseltgenme potansiyeli daha düşük olan ametal daha aktif metaldir.
- İndirgenme potansiyeli daha yüksek olan ametal daha aktiftir.
- Başka bir açıdan bakarsak; daha aktif olan ametal şu özellikleri gösterir:
- İndirgenme potansiyeli daha yüksektir.
- Yükseltgenme potansiyeli daha düşüktür.
- Daha iyi bir yükseltgendir.
- Daha kötü indirgendir.
- Elektron ilgisi ve elektron alma eğilimi daha yüksektir.
- Elektron verme eğilimi daha düşüktür.
Örnek:
I2 + 2e– → 2I– Eo = 0,53 V
Cl2 + 2e– → 2Cl– Eo = 1,36 V
O2 + 4H+ + 4e– → 2H2O Eo = 1,23 V
2H+ + 2e– → H2 Eo = 0,00 V
Yukarıda, standart elektrot potansiyelleri verilen ametaller için, aşağıdaki soruları cevaplandırınız.
a) Aktiflik sıralamasını yapınız.
b) Elektron alma eğilimini sıralayınız.
c) İndirgen özelliklerine göre sıralayınız.
d) Yükseltgenme eğilimlerini sıralayınız.
Cevap
Örneğin çözümü:
Metallerin İstemli Redoks Tepkimeleri
- Aktif olan metal nötür, pasif olan metal yüklü ise istemli bir redoks tepkimesi gerçekleşir.
- Aktif metal yükseltgenir ve yüklü olur,
- Pasif olan metal indirgenir nötr olur.
- Bu şartları taşıyan sistemlerde:
- Aktif metal, pasif metalin çözeltisinde aşınır.
- Aktif metal pasif metaller kaplanır.
- Pasif metalin çözeltisi aktif metalden yapılmış kapta saklanamaz.
- Bu metaller ile bir galvanik hücre kurulabilir. Bu yapılırsa:
- Aktif metal anot,
- Pasif metal katot olarak görev yapar.
- Aktif olan metal yüklü, pasif olan metal nötür ise istemli bir tepkime gerçekleşmez.
- Aşınma olmaz.
- Çözelti kapta saklanabilir.
Yani: Aktif metal yüke sahip olmalıdır.
Örnek:
I) 3Fe2+(suda) + 2Al → 2Al3+(suda) + 3Fe
II) Fe2+(suda) + Cu → Cu2+(suda) + Fe
III) 3Cu2+(suda) + 2Al → 2Al3+(suda) + 3Cu
IV) Cu2+(suda) + Fe → Fe2+(suda) + Cu
Aşağıda verilen standart elektrot potansiyellerine göre; yukarıda verilen redoks tepkimelerinden hangisi ya da hangileri, standart koşullarda istemlidir?
Al → Al3+ + 3e– Eo = 1,66 V
Cu → Cu2+ + 2e– Eo = – 0,34 V
Fe → Fe2+ + 2e– Eo = + 0,44 V
Cevap
Örneğin çözümü:
Metallerin Aşınması Durumu
- Çözeltiye batırılan metal çubuk, çözeltide çözünen metalden daha aktif ise metal aşınır:
- Zamanla metal çubuğun kütlesi azalır.
- Metal çubuk zamanla yükseltgenir.
- Metal çubuk zamanla bileşik halinde çözünür.
- Metal çubuk elektron verir.
- Çözeltideki metal iyonu ise tam tersi davranır.
Örnek:

Yukarıdaki şekilde, CuSO4 çözeltisine batırılmış Ni metali vardır. Aşağıda, Cu ve Ni metallerinin elektrot potansiyelleri verilmiştir.
Ni → Ni2+ + 2e– Eo = 0,25 V
Cu → Cu2+ + 2e– Eo = – 0,34 V
Buna göre, bu kapta, Ni çubuk aşınır mı? Aşınma gerçekleşirse, aşınma tepkimesinin denklemini yazınız.
Cevap
Örneğin çözümü:
Metal Kapların Aşınması Durumu
- Aktif bir metalden yapılan kaplarda, pasif bir metalin sulu çözeltisi saklanmaz. Çünkü:
- Aktif olan metal, çözeltideki pasif metalden yükünü alır ve suda çözünür.
- Bu durumda kap zamanla aşınır ve delinir.
- Çözeltideki metal iyonu ise mecburen elektron alır ve bileşiği bırakarak, metal haline geçer.
Örnek:

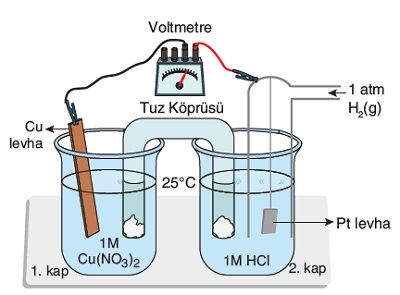
Yukarda verilen kaplar; X, Y ve Z metallerinden yapılmıştır. Kapların içinde ise, bu metallerin sülfat tuzları çözünmüştür. Aşağıda, bu üç metalin elektrot potansiyelleri verilmiştir.
X2+(suda) + 2e– → X(k) Eo = 0,25 V
Y2+(suda) + 2e– → Y(k) Eo = – 1,55 V
Z2+(suda) + 2e– → Z(k) Eo = 0,45 V
Buna göre, hangi çözeltiler bulundukları kapta saklanabilir?
Cevap
Örneğin çözümü:
Örnek:
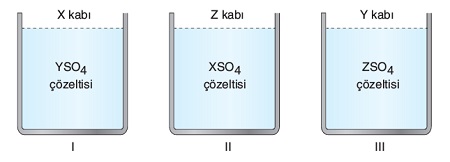
Yukarıdaki kaplar; X, Y ve Z metallerinden yapılmıştır. Bu metallerinin elektron verme eğilimleri X > Y > Z şeklindedir.
Buna göre, kaplardan hangilerinde bir süre sonra aşınma olur?
Cevap
Örneğin çözümü:
Derişim 1M Değilse (Nernst Eşitliği)

- Şimdiye kadar hesapladığımız pil potansiyellerinde, dikkat ettiyseniz, iyonların derişimleri hep 1M olarak verilmişti.
- Bu yüzden, hücrenin pil potansiyelini bulmak için, standart pil potansiyelini hesaplamak yeterli olmuştu.
- Çünkü, yarı anyon ve katyon iyonlarının derişimi 1M ise, pilin potansiyeli, pil tepkimesinin potansiyeline eşittir. (Epil = Eopil)
- Bu yüzden, hücrenin pil potansiyelini bulmak için, standart pil potansiyelini hesaplamak yeterli olmuştu.
- Fakat; yarı hücrelerdeki iyonların derişim değerleri 1M değilse, bu durumda, pil potansiyeli, standart pil potansiyeline eşit olmayabilir.
- Böyle bir durumda galvanik hücrelerinin pil potansiyeli, Nernst Eşitliği ile hesaplanır. Bu eşitlik şöyledir:

- Formüldeki sembollerin anlamı şöyledir:
- Epil : Hücrenin pil potansiyeli (Voltajı)
- Eopil : Hücrenin standart pil potansiyeli
- n : Yarı hücrelerde alınan-verilen elektron sayısıdır. Bir başka ifade ile; pil tepkimesini yazarken, sadeleştirdiğimiz elektron sayısıdır.
- Q : Pil dengesinin, denge kesridir. Yani, pil dengesinin derişimler cinsinden denge sabitidir. Diğer denge sabitleri gibi, ürünlerin ve girenlerin derişimi ile hesaplanır:

- Q eşitliğindeki:
- [ürün]: Anot iyonunun Molaritesidir.
- [giren]: Katot iyonunun Molaritesidir.
Derişimler 1M Olursa
- Ürün ve girenlerdeki iyon derişimleri 1M olursa, Q değeri de 1 olur. Bu durumda;
- log(Q) = log(1) = 0
olur. - Nernst eşitliği de şu hale gelir:
Epil = Eopil
- log(Q) = log(1) = 0
- Bu yüzden, anot ve katot derişimlerinin 1M olduğu çözeltilerde, Eopil değeri, pil potansiyeline eşittir.
Örnek:
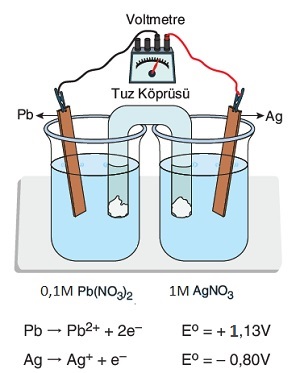
Yukarıda verilen hücrenin pil potansiyel (Epil) değerini hesaplayınız.
Cevap
Örneğin çözümü:
Nernst Yasası İle Elektrot Potansiyelleri Hesaplama
- Standart elektrot potansiyelleri hesaplanırken, derişimler 1M alınır.
- Eğer bir elementin indirgenme ya da yükseltgenme yarı tepkimelerinde derişimi 1M değilse;
- Elektrot potansiyeli; Nernst Yasası ile hesaplanabilir.
Örnek:
Zn2+(suda) + 2e– → Zn(k) E°ind = -0,76 V’tur.
Buna göre bu yarı hücrede Zn2+ iyonunun derişimi 0,01 M alındığında Eind değeri kaç volt olur? (Nernst eşitliğindeki logaritmik terimin katsayısı 0,06/n olarak alınacaktır.)
Cevap
Derişim Pilleri

- Derişim pillerinde:
- Farklı olan tek şey, yarı hücrelerdeki elektrolit çözeltilerin derişimleridir, yani elektrotların derişimleridir.
- Galvanik hücre, derişim farkından dolayı çalışır.
- Derişimi az olan yarı hücre ANOT görevi yapar.
- Derişimi çok olan yarı hücre KATOT görevi yapar.
- Derişim farkı arttıkça, pil potansiyeli yükselir.
- Pil çalışırken, zamanla, derişim farkı azalır.
- Derişimler eşitlendiğinde, derişim pili bitmiş olur.
Derişim Pillerinin “Standart Pil Potansiyeli (Eopil)”
- Derişim pillerinde, anot ve katta aynı maddeler bulunduğundan, indirgenen de aynı maddedir yükseltgenen de aynıdır.
- Mesela, bir Zn metali ile kurulmuş bir derişim pilinde anot (YYT) ve katot (İYT) tepkimeleri şöyle olacaktır:
- YYT: Zn(k) → Zn2+(suda) + 2e– Eo = + 0, 76V
- İYT: Zn2+(suda) + 2e– → Zn(k) Eo = – 0, 76V
- Derişim pillerinde, elektrot potansiyelleri birbirinin zıttı olduğundan, Standart Pil Potansiyeli (Eopil) her zaman sıfır olur:
- Eopil = Eoanot + Eokatot
- Eopil = 0,76 – 0,76 = 0V
Derişim Pillerinin “Pil Potansiyeli (Epil)”
- Derişim pillerinin Eopil değeri sıfır olduğu için, pil potansiyelleri, Nernst Eşitliğinin geriye kalan kısmı ile hesaplanır:

Örnek:

Yukarda verilen Galvanik Hücre ile ilgili olarak, aşağıdaki yargılardan hangisi ya da hangileri doğrudur?
I) Pil potansiyeli olarak 0,03V’tur.
II) Elektronlar 1. kaptan 2. kaba doğru akar.
III) 2. kaba, 450 mL saf su ilave edilirse Epil = 0 olur ve pil durur.
IV) 1. kaba saf su ilave edilirse, pil potansiyeli artar.
V) 1. kaba CuCl2 tuzu ilave edersek, pil potansiyeli artar.
VI) 2. kapta Cu2+(suda) + 2e– → Cu(k) yarı tepkimesi gerçekleşir.
VII) 1. kaba 0,09 mol CuCl2 tuzu eklenip tamamen çözünürse, Epil = 0 olur.
Cevap
Örneğin çözümü:
Pil Potansiyelini Etkileyen Faktörler
- Pil tepkimesi bir denge tepkimesidir.
- Pil potansiyeli de, bu denge tepkimesinin denge sabiti gibi düşünülebilir.
- Pil dengesi, ekzotermiktir, çünkü; elektrik enerjisi üretir.
- Pil dengesi de, bütün denge tepkimeleri gibi, Le Chatelier Prensibi‘ne göre hareket eder:
- Denge ürünler yönüne kayarsa, pil potansiyeli artar.
- Denge girenler yönüne kayarsa, pil potansiyeli azalır.
- Bir galvanik hücrenin, pil tepkimesi dengeye ulaştığında, pil bitmiş olur ve şarj edilmesi gerekir.
- Katı ve sıvılar dengeyi etkilemediğinden, elektrot olarak kullanılan metallerin kütlesinin değişmesi, yüzey alanının değişmesi gibi değişikler, dengeyi etkimez.
Pil potansiyeli bir denge tepkimesinden kaynaklandığı için, pil potansiyelini etkileyen faktörler, aslında dengeyi etkileyen faktörlerdir ve şunlardır:
1. Sıcaklık
- Pil dengesi ekzotermik bir denge tepkimesi olduğundan;
- Hücrenin sıcaklığı artarsa, denge, girenlere kayar ve pil potansiyeli azalır.
- Hücrenin sıcaklığı düşerse, denge ürünlere kayar ve pil potansiyeli artar.
2. Derişim
- Bir çözeltinin derişimi şöyle değişir:
- Çözeltiye saf su eklenirse, derişim düşer.
- Çözeltiden su buharlaştırılırsa, derişim artar.
- Çözünen madde çöktürülürse, derişim düşer.
- Çözeltiye çözünen tuzdan ilave edilip çözülürse, derişim artar.
- Kısacası, çözünen maddenin oranı arttıkça derişim artar, suyun oranı arttıkça derişim azalır.
Anot Derişimi
- Anot iyonları, pil tepkimesinin ürünlerine yer alır.
- Bu yüzden, anot derişimi azalırsa pil dengesi ürünlere kayar ve pil potansiyeli artar.
- Anot derişimi artarsa, denge girenlere kayar ve pil potansiyeli azalır.
- Anota eklenen bir iyon, anot iyonu ile bir araya geldiği zaman, suda az çözünen bir tuz oluşturuyorsa, anot iyonu çöker ve derişimi azalır, pil potansiyeli artar.
Katot Derişimi
- Katot iyonları, pil tepkimesinin girenlerinde yer alır.
- Bu yüzden, katot derişimi azalırsa pil dengesi girenlere kayar ve pil potansiyeli azalır.
- Katot derişimi artarsa, denge ürünlere kayar ve pil potansiyeli artar.
- Katoda eklenen bir iyon, katot iyonu ile bir araya geldiği zaman, suda az çözünen bir tuz oluşturuyorsa, katot iyonu çöker ve derişimi azalır, pil potansiyeli azalır.
3. Basınç
- Basınç, pil dengesinde gaz fazında bir madde varsa, pil potansiyelini etkiler.
- Le Chatelier Prensibine göre; dengenin ürünlerinde veya girenlerinde olmasına göre basınç değişimi, dengeyi farklı yönlere kaydırır.
- H2(g) + Cu2+(suda) ⇄ 2H+(suda) + Cu(k)
- Örneğin yukardaki gibi bir pil dengesinde, gaz fazındaki madde girenler yönündedir. Bu durumda:
- Gaz basıncı artarsa, denge ürünlere kayar ve pil potansiyeli artar.
- Gaz basıncı azalırsa, denge girenlere kayar ve pil potansiyeli azalır.
Elektrolitik Hücreler (Şarj Düzeneği)
- Elektrokimyasal hücrelerden ikinci; “Elektrolitik Hücre“lerdir.
- Elektrolitik Hücreler, aslında, bitmiş bir galvanik hücrenin şarja takılmış şeklidir.
- Bir galvanik hücre şu durumlarda biter:
- Hücre tepkimesi dengeye ulaştığında
- Anot elektrot tükendiğinde
- Katot çözeltisinin derişimi sıfırlandığında
- Bu yüzden; elektrolitik hücrelerde, galvanik hücrelerde gerçekleşen bütün olayların tam tersi gerçekleşir ve bitmiş olan sulu pil dolar.
- Galvanik bir hücrenin şarj edilebilmesi için, hücreye, pil potansiyelinden (Epil) daha fazla elektrik verilmesi gerekir.
- Şarj potansiyeli > Epil
Anot ve Katot Yer Değiştirir
- Elektrolitik hücrede, galvanik hücrenin tersine işler zoraki ilerler. Yani;
- İndirgenme potansiyeli düşük olan indirgenir
- Yükseltgenme potansiyeli düşük olan yükseltgenir.
- (Herkes istemediği tepkimeye verir.)
- Galvanik hücre iken yükseltgenme yarı tepkimesinin gerçekleştiği kapta, elektrolitik hücre iken indirgenme yarı tepkimesi gerçekleşir. Yani;
- Galvanik hücre iken ANOT olarak çalışan kap, elektrolitik hücre iken, KATOT olarak çalışır.
- Galvanik hücre iken indirgenme yarı tepkimesinin gerçekleştiği kapta, elektrolitik hücre iken yükseltgenme yarı tepkimesi gerçekleşir. Yani;
- Galvanik hücre iken KATOT olarak çalışan kap, elektrolitik hücre iken ANOT olarak çalışır.
- Elektrolitik hücrenin hücre tepkimesi, galvanik hücrenin tam tersidir.
Elektrolitik Bir Hücre Nasıl Tanınır?
- Elektrolit bir hücrede, Voltmetre yerine bir üreteç takılıdır.
- Hücre düzeneğine baktığımızda:
- Voltmetre görüyorsak o bir “Galvanik Hücre” demektir.
- Bir üreteç veya pil takılı olduğunda ise “Elektrolitik Hücre” demektir.
- Galvanik hücrelerde, Voltmetre aşağıdaki şekillerde karşımıza çıkar:
- Elektrolitik hücrelerde, üreteçler de karşımıza şu şekilde çıkar:
Aşağıda bir galvanik hücre ve bu hücrenin elektrolitik hücresi verilmiştir:

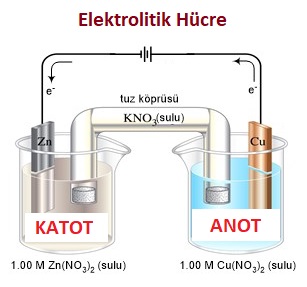
Örnek:

Zn(k) → Zn2+(suda) + 2e– Eo = + 0, 76V
Cu(k) → Cu2+(suda) + 2e– Eo = – 0, 34V
Yukarıda verilen bilgiler ışığında, aşağıda verilenlerden hangileri doğrudur?
I) Hücre; bir elektrolitik hücredir.
II) Hücrenin çalışması için, bağlanacak üretecin, 1,1V’un üzerinde bir gerilim üretmesi gerekir.
III) Dış devrede elektronlar, Zn elektrottan Cu elektrota doğru akar.
IV) Zamanla Zn elektrotun kütlesi artar.
V) Tuz köprüsündeki katyonlar Zn elektrotun bulunduğu kaba akar.











2 yorum “3. Elektrot Potansiyelleri”