İçindekiler
İstemlilik
- Bulunduğu şartlarda kendiliğinden gerçekleşen tepkimelere istemli tepkime, gerçekleşmeyen tepkimelere istemsiz tepkime denir.
- İstemli tepkimeler başlatıldıktan sonra kendiliğinden devam eder.
- İstemsiz tepkimelerin devam edebilmesi için çevreden devamlı enerji almaları gerekir.
- Elektrik enerjisi istemli redoks tepkimeleri ile elde edilir.
- Piller, aküler, bataryalar bu duruma örnektir.



Örnek:
Aşağıdaki olayların hangisinde istemli bir redoks tepkimesi gerçekleştiği söylenemez?
A) Şarja takılı olmadan cep telefonunun açılması
B) Televizyon kumandasının çalışması
C) Arabanın anahtarı yardımı ile çalıştırılması
D) Cep telefonunun şarj edilmesi
E) Pilli bir oyuncağın düğmesi açıldığında hareket etmesi.
Elektrokimyasal Hücreler Nelerdir?
- Bir kimyasal tepkime ile elektrik enerjisi arasındaki dönüşümün gerçekleştiği sistemlere elektrokimyasal hücre denir.
- 2 çeşit elektrokimyasal hücre vardır. Bunlar:
- Galvanik (Voltaik) Hücre: Kimyasal enerji, elektrik enerjisini dönüşür.
- Bitmemiş pil, batarya, aküler…
- Redoks tepkimelerinden elektrik üretir.
- Galvanik hücreler bittiğinde şarj edilmesi gerekir.
- Şarj ederken galvanik hücre, elektrolitik hücre adını alır.
- Elektrolitik hücre: Galvanik hücrenin tersidir. Elektrik enerjisi kimyasal enerjiye dönüşür.
- Şarj olan pil, batarya ve aküler.
- Elektrik enerjisi yardımı ile redoks tepkimesi gerçekleştirir.
- Galvanik (Voltaik) Hücre: Kimyasal enerji, elektrik enerjisini dönüşür.
Örnek:
Aşağıdaki olayların hangisi bir elektrolitik hücre örneğidir?
A) Şarja takılı olmadan cep telefonunun çalışması
B) Televizyon kumandasının çalışması
C) Arabanın anahtarı yardımı ile çalıştırılması
D) Tablet bilgisayarın şarj edilmesi
E) Pilli bir oyuncağın düğmesi açıldığında hareket etmesi.
Galvanik (Voltaik) Hücreler
- İstemli olarak gerçekleşen redoks tepkimelerinden, elektrik enerjisi üreten sistemelerdir.
- Galvanik bir hücre, bir çeşit sulu pildir.
Galvanik ve Voltaik isimleri, sırasıyla, Luigi Galvani ve Alessandro Volta adındaki bilim adamlarından gelir.

Ölmüş kurbağa bacağındaki kasların elektriklenmeyle titreşim gösterdiğini, kas ve sinir hücrelerinin elektrik ürettiğini keşfetmiştir. Çalışmaları kimyasal yolla elektrik üretimi çalışmalarına öncülük etmiştir.

40 yıla yakın bir süre deneysel fizik alanında profesör olarak görev yapmıştır. Galvani’nin deneylerini kontrol ederek tekrarlayan Volta, ilk elektrokimyasal hücreyi (pili) geliştirmiştir.
Bu bir reklamdır:
Galvanik Hücre Düzeneği

- Galvanik bir hücre, şu parçalardan oluşur:
- İki adet elektrolit çözelti (tuz çözeltisi)
- İki adet elektrot (metal çubuk)
- İletken bir tel
- Voltmetre (Pilin ürettiği elektrik miktarını ölçer.)
- Tuz köprüsü: İçinde tuz çözeltisi olan, uçları pamukla tıkanmış bir U borusudur.
Aşağıdaki vidyoda, Zn – Cu galvanik hücre düzeneğinin hazırlanışını ve çalışmasını görüyorsunuz:
- Galvanik hücrenin parçaları, aşağıdaki gibi bir araya getirilir:
- İki ayrı kapta birer tuz çözeltisi hazırlanır.
- Tuz çözeltilerine “elektrolit” denir.
- Tuz çözeltilerine, tuzun formülündeki metalin çubuğu batırılır.
- Mesela, tuz çözeltisi ZnSO4 tuzunun ise, çözeltiye Zn metali batırılır. (ZnSO4 çözeltisinde, Zn2+ iyonları vardır.)
- Elektrolit çözeltilere batırılan metallere, “elektrot” denir.
- Elektrolit tuz çözeltileri arasına da bir “tuz köprüsü” kurulur.
- Metal elektrotlar, iletken bir tel ile birbirine bağlanır. Bu iletken tele, bir de “Voltmetre“, seri bağlanma ile bağlanır ve bu aşamadan sonra pil kendiliğinden elektrik üretmeye başlar.
- Pilin ürettiği elektrik akımı, iletken tele bağlanmış bir Voltmetre yardımı ile ölçülür.
Tuz Köprüsü
- Tuz köprüsü, camdan yapılmış ve U şeklinde bir borudur.
- İçinde, NaCl, KCl, NH4Cl gibi tuzlardan herhangi birinin çözeltisi vardır.
- İki ucu pamuk ile gevşek bir şekilde tıkanmıştır.
- “U” borusu, tuz çözeltisi ile önce ağzına kadar doldurulur sonra iki ucu pamuk ile tıkanır.
- Tuz köprüsünün görevleri şunlardır:
- Anyonları (- yüklü iyonlar) anota (+ kutup),
- Katyonları da katota taşır.
- Bu şekilde pilin devresi tamamlanmış olur.
Anot ve Katot Kutupları

- Galvanik hücredeki iki kaptan her birine bir “yarı hücre” denir.
- Bir yarı hücrede şunlar bulunur;
- bir elektrot (metal çubuk),
- bir elektrolit çözelti ve
- bu çözeltiye daldırılmış şekilde tuz köprüsünün bir ucu bulunur
- Yarı hücrelerden biri, galvanik hücrenin “anot kutbu“, diğeri de “katot kutbu” olarak çalışır.
- Anot yarı hücresi pilin artı kutbudur.
- Katot yarı hücresi pilin eksi kutbudur.
- Anot yarı hücresinde, yükseltgenme yarı tepkimesi gerçekleşir.
- Katot yarı hücresinde, indirgenme yarı tepkimesi gerçekleşir.
Aşağıda, çalışan bir Galvanik Hücre örneği verilmiştir:

Zn(k) → Zn2+(suda) + 2e– Eo = 0,76V
Cu(k) → Cu2+(suda) + 2e– Eo = – 0,34V

Anot Yarı Hücresinde Gerçekleşen Olaylar
- Aşağıda verilen parça, Galvanik Hücre‘nin anot yarı hücresidir.
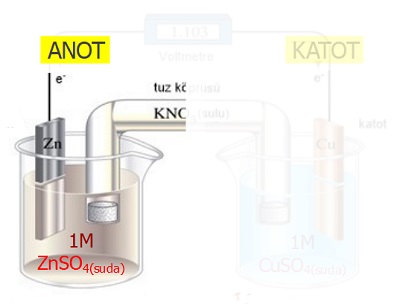
Anot yarı hücresinde şu olaylar gerçekleşir:
- Yükseltgenme yarı tepkimesi gerçekleşir.
- Zn(k) → Zn2+(suda) + 2e– Eo = 0,76V
- Anot elektrot (metal çubuk), elektron vererek, yükseltgenir.
- Yükseltgenen elektrot atomları, katyonlara dönüşerek sulu çözeltiye karışır.
- Metal elektrot, yükseltgendiği için zamanla aşınır.
- Metal elektrotun kütlesi zamanla azalır.
- Elektrot atomlarının verdiği elektronlar, iletken telden, katota doğru akar.
- Katyonlar, tuz köprüsünden katota akar.
Katot Yarı Hücresinde Gerçekleşen Olaylar
Aşağıda verilen parça, Galvanik Hücre‘nin katot yarı hücresidir.
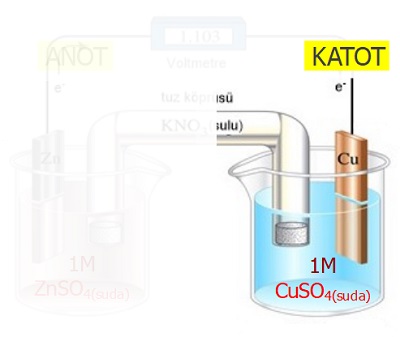
Katot yarı hücresinde şu olaylar gerçekleşir:
- İndirgenme yarı tepkimesi gerçekleşir.
- Cu2+(suda) + 2e– → Cu(k) Eo = 0,34V
- Çözeltideki metal iyonları, elektron alarak, indirgenir.
- İndirgenen iyonlar, metal haline dönüşerek elektortun yüzeyinde birikir.
- Metal elektrot, zamanla kalınlaşır ve kütlesi artar.
- Çözeltideki katyonların verdiği elektronlar, iletken telden, katota doğru akar.
- Anyonlar, tuz köprüsünden anota akar.
Bu bir reklamdır:
Pil (Hücre) Tepkimesi
- Bir galvanik hücrede gerçekleşen redoks tepkimesine “pil tepkimesi” denir.
- Pil tepkimesi, anot ve katot yarı hücresinde gerçekleşen yarı tepkimelerin toplamıdır.
- Aşağıdaki galvanik hücrenin pil tepkimesi de şöyle olacaktır:

Zn(k) → Zn2+(suda) + 2e– Eo = 0,76V
Cu(k) → Cu2+(suda) + 2e– Eo = – 0,34V
- Yukarıda verilen galvanik hücrede gerçekleşen anot ve katot tepkimesi ve pil tepkimesi şöyledir:
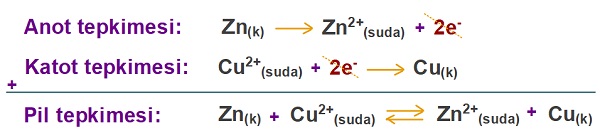
Pil tepkimelerinin genel özellikleri şöyledir:
- Anot ve katot tepkimelerinin toplamıdır.
- Anot ve katot tepkimeleri toplanırken elektronlar mutlaka eşit sayıda olmalı ve sadeleşmelidir.
- Elektronlar eşit sayıda değillerse, yarı tepkimeler uygun katsayılar ile genişletilerek elektronlar eşitlenmeli, ondan sonra toplanmalıdır.
- Bir redoks tepkimesidir.
- Pil tepkimesi bir denge tepkimesidir.
- Pil tepkimesi, ekzotermik bir denge tepkimesidir.
- Pil tepkimesi bir denge tepkimesi olduğu için, Le Chatelier Prensibi, pil tepkimesi için de geçerlidir.
- Pil tepkimesini, ürünlere doğru kaydıran her etki, pil potansiyelini arttırır.
- Pil tepkimesini, girenlere doğru kaydıran her etki, pil potansiyelini azaltır.
Hücre Diyagramı (Hücre Şeması)
- Bir elektrokimyasal hücreyi, şeklini çizmeden tarif etmenin yolu, o hücrenin “hücre diyagramını” yazmaktır.
- Hücre diyagramı için; genellikle, aşağıdaki şablon kullanılır:
Anot elektrot | Anot çözeltisindeki katyon (Derişimi) || Katot çözeltisindeki katyon (Derişimi) | Katot elektrot
- Hücre diyagramın yazılış yönünde şu sıra takip edilmelidir:
- Anot tepkimesinin gireni | ürünü
- || (Tuz köprüsü)
- Katot tepkimesinin gireni | ürünü
Örnek:
Aşağıdaki galvanik hücrenin hücre diyagramını bulalım:

Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Zn(k) | Zn2+(1M) || Ag+(1M) | Ag(k)
Yukarıda hücre diyagramı verilen galvanik hücrenin pil tepkimesini yazınız.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
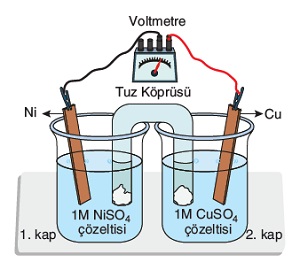
Ni2+(suda) + 2e– → Ni(k) Eo = – 0,25V
Cu2+(suda) + 2e– → Cu(k) Eo = + 0,34V
Yukarıda verilen galvanik hücre için aşağıdakilerden hangileri doğrudur? (CuS ve NiS tuzları suda çok az çözünür.)
I) Cu elektrot anottur.
II) Pil 0,59V elektrik üretir.
III) Dış devrede, elektronlar II. kaptan I. kaba doğru akar.
IV) Tuz köprüsünde anyonlar I. kaba akar.
V) II. kapta, zamanla Cu2+ derişimi artar.
VI) Ni elektrotun kütlesi zamanla artar.
VII) I. kaba Na2S tuzu eklersek, pil potansiyeli artar.
VIII) II. kaba saf su eklersek pil potansiyeli artar.
IX) 1. kapta, daha ince bir Ni(k) metali kullanırsak, pil potansiyeli azalır.


Elif says:
Hocam ametalik aktifliğin altındaki soruda
klorun ind. 1,36
oksijenin ind. 1,23
Ametalik aktiflik sıralaması Cl O I H olmalıydı.
Yanlış mıyım?
Cevap verirseniz sevinirim. 🙂
Gökalp AY says:
Haklısınız Elif hanım. Hemen düzeltiyorum.
sıla says:
hocam metal kapların aşınması durumundaki ilk sorunun cevap kısmında yanlıslık olmus sanırsam bakarsanız sevinirim
Gökalp AY says:
Teşekkürler Sıla hanım. Düzelttim.