İçindekiler
- Periyodik Sistem ve Mendeleyev
- Periyodik Sistem ve Moseley
- Günümüzdeki Periyodik Sistem
- Periyodik Sistemde Grup ve Periyot Kavramı
- Periyodik Sistemde Lantanit ve Aktinitler
- Atomlarda Elektron Dağılımı
- Grup ve Periyot Bulma
- Elementlerin Sınıflandırılması
- Periyodik Özellikler
- Konu Özeti
Periyodik sistem; periyodik tablo ya da periyodik cetvel olarak da adlandırılır.
- Periyodik sistem bir tablodur.
- Bu tabloda, bilinen bütün elementler yer alır.
- Bugün bilinen bütün elementlerin sayısı 118’dir.
- Yani, periyodik sistemde 118 tane element vardır.
- Periyodik sistemin bütün sırrı, elementlerin dizilişindedir.
- Sistemdeki elementlerin hiç biri, bulunduğu yere rastgele yerleşmemiştir.
- Periyodik sistemde, benzer özellikleri gösteren elementler, tablonun aynı bölgesinde toplanmıştır. Detaylar için okumaya devam edin…
Periyodik Sistem ve Mendeleyev
- Periyodik sistemin babası Rus kimyacı D. Mendeleyev (D. Mendelyef)’dir.
- Mendeleyev’in periyodik sistemi, 1870 yılından 1913 yılına kadar geçerliliğini korumuştur.

Mendeleyev’in Periyodik Sistemi

- Mendeleyev, o gün için bilinen 63 elementi sıralayarak bir periyodik tablo yapmıştır.
- Mendeleyev ilk kez grup kavramını kullanmıştır ve 63 elementi;
- 12 yatay sıra (periyot) ve
- 8 dikey sıra (grup) olarak düzenlemiştir.
- Mendeleyev, elementleri atom kütlelerine (A) göre sıralamıştır.
- Yaptığı sıralamada, elementlerin fiziksel ve kimyasal özelliklerinin de düzenli (periyodik) olarak tekrarladığını görmüştür.
- Mendeleyev’in periyodik sisteminde, elementler özelliklerine göre doğru bir şekilde gruplandırılmıştır.
- Tabloda bazı elementlerin yerleri boş bırakılmıştır.
- Mendeleyev, boş bırakılan yerlerin henüz keşfedilmemiş elementlere ait olduğun söylemiştir.
- Hatta, o zaman bilinmeyen bu elementlerin bazı özelliklerini de doğru bir şekilde hesaplamıştır.
- Örneğin; Alüminyum (Al) elementinin altında bulunan Galyum (Ga) elementinin özellikleri henüz element keşfedilmeden biliniyordu.
- Bu durum, Mendeleyev’in tablosunun, o dönemde diğer bilim insanlarının ortaya attığı tablolara üstünlük kazanmasını sağlamıştır.
Bu bir reklamdır:
Mendeleyev’in Eksikleri
- Mendeleyev, elementleri atom kütlesine göre sıralayarak hata etmiştir.
- Elementler, atom kütlesine göre yerleştiği için, kendisine hiç benzemeyen elementlerin grubuna düşen elementler vardı.
- Mendeleyev bunu, atom kütlelerinin ölçümünde hata olabileceğini düşünerek yorumluyordu.
Periyodik Sistem ve Moseley
- Bugün kullandığımız periyodik sistemin mimarı, Henry Moseley‘dir.
- İngiliz fizikçi Moseley; 1915 yılında Gelibolu’da ölmüştür.
- Moseley, 1913 yılında, elementlerin ürettiği X ışınları ile atom numaraları (proton sayıları da denir) arasında bir bağ olduğunu keşfetti. Bu keşif sayesinde, bütün elementlerin proton sayısını hesaplayabildi.

- Hesaplandıktan sonra anlaşıldı ki; element atomlarının proton sayıları 1’den başlayarak sırayla gidiyor:
- H atomunun protona sayısı 1
- He atomunun proton sayısı 2
- Li atomunun proton sayısı 3
- Be atomunun proton sayısı 4
- …
- Moseley, elementleri, atomlarının proton sayılarına göre sıraladı.
- Bu sıralama ile elde ettiği periyodik cetvelin -birkaç element haricinde-, Mendeleyev’in sıralaması ile de uyumlu olduğunu gördü.
- Hatta bu sıralama, Mendeleyev’in tablosunda yaşanan tutarsızlıkları da gideriyordu.
Günümüzdeki Periyodik Sistem
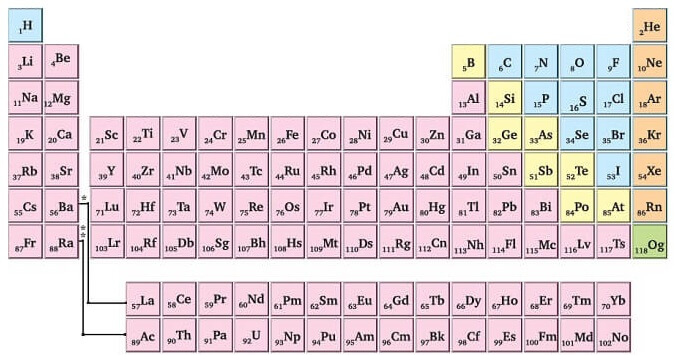
- Yukarıda, günümüzde kullanılan periyodik sistem verilmiştir. Günümüzdeki periyodik sistemde:
- Elementler, proton sayılarına göre 1’den başlayarak ve sırayla dizilmişlerdir.
- Elementler, tablonun en üstünden başlanarak, sağa ve aşağıya doğru dizilmişleridir.
- Günümüzün periyodik sisteminde, Mendeleyev’in tablosundaki gibi grup ve periyotlar vardır.
Bu bir reklamdır:
Periyodik Sistemde Grup ve Periyot Kavramı
- Periyodik sistem bir çeşit tablodur.
- Her tablo gibi periyodik sistem de, yatay ve dikey olarak dizilmiş kutucuklardan oluşmuştur.
- Periyodik sistemdeki dikey sıralara (üst üste) grup denir.
- Periyodik sistemdeki yatay sıralara periyot denir.
- Gruplar ve periyotlar, periyodik sistemdeki atomların, yerini tarif etmek için kullanılırlar.
- Bir atomun grup ve periyot numarası bir nevi o atomun adresi gibidir.
- Atomların, proton sayıları yardımı ile grup ve periyotları hesaplanabilir.
Periyodik Sistemde Gruplar
- Periyodik sistemde 18 tane grup vardır.
- Benzer kimyasal özellik gösteren elementler, aynı grupta bulunurlar.
- Gruplar için kullanılan 3 farklı adlandırma sistemi vardır:
- Numaralar ile adlandırma
- A ve B harfleri ile adlandırma
- Özel adlandırma
Şimdi sırasıyla bunları görelim:
1. Grupları Numaralar İle Adlandırma (IUPAC Sistemi)
- IUPAC, dünyada kimya birliğini sağlayan, kimya bilimi ile ilgili kuralları belirleyen bir örgüttür.
- IUPAC, periyodik sistemde grupların sırayla numaralar verilerek isimlendirilmesini tavsiye etmektedir.

- Yukarıda görüldüğü gibi: numaralama yönteminde, periyodik sistemin sol başından itibaren her bir gruba sırasıyla, 1’den 18’e kadar numaralar verilir.
- Günümüzde, grupları adlandırmak için kullanılan ve bilimsel olan sistem budur.
2. Grupları A ve B Harfleri İle Adlandırma (Yaygın Sistem)
- Grupların adlandırılması için kullanılan yaygın sistemde A ve B harfleri ve sayılar kullanılmaktadır.
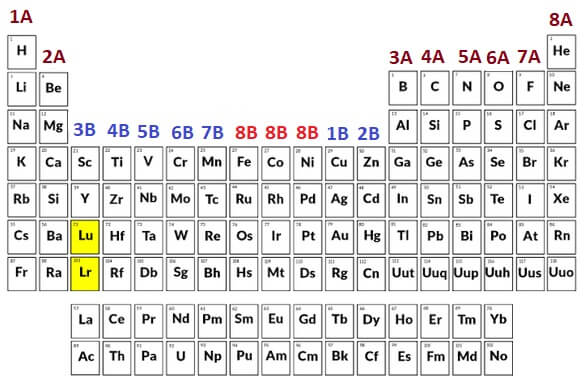
- Grupları adlandırmak için kullanılan bu yöntemde, A ve B harfleri, önlerine birer rakam yazılarak kullanılır:
- Sonuçta 8 tane A grubu, 8 tane de B grubu vardır.
- 8B grubu, 3 tanedir.
- A gruplarına “baş (ana) gruplar“, B gruplarına “yan gruplar” denir.
- Grupları adlandırmak için A ve B harflerinin kullanımı daha yaygındır.
Bu bir reklamdır:
3. Grupların Özel Adları

- Grupların bir kısmı özel adları ile daha çok tanınır.
- Özel adlar, gruptaki elementlerin özelliklerinden esinlenerek konulmuş adlardır.
- Bazı gruplar ve özel adları şöyledir:
- 1A grubu: Alkali metaller (İstisna: Bu gruptaki H elementi, bir alkali metal değildir.)
- 2A grubu: Toprak alkali metaller
- 3A grubu: Toprak metalleri
- 4A grubu: Karbon grubu
- 5A grubu: Azot grubu
- 6A grubu: Oksijen grubu (Kalkojenler)
- 7A grubu: Halojenler (Tuz oluşturanlar)
- 8A grubu: Soy gazlar (Asal gazlar)
- B grupları: Geçiş metalleri
- Lantanit ve Aktinitler: İç geçiş metalleri
Grupların Genel Özellikleri
Periyodik sistemdeki gruplar için şunlar söylenebilir:
- Periyodik sistemde, 18 tane grup vardır.
- Aynı grupta bulunun elementlerin kimyasal özellikleri benzerdir.
- Grup numarası, gruptaki element atomlarının son yörüngelerindeki elektron sayılarını verir:
- 1A grubundaki atomların son yörüngesinde 1 elektron vardır.
- 2A grubundaki atomların son yörüngesinde 2 elektron vardır.
- 3A grubundaki atomların son yörüngesinde 3 elektron vardır.
- ….
- 7A grubundaki atomların son yörüngelerinde 7 elektron vardır.
- 8A grubundaki atomların son yörüngelerinde 8 elektron vardır. İstisna: Helyum (He), bu kuralın istisnasıdır. He, 8A grubunda bulunur fakat değerlik elektron sayısı 8 değil 2’dir.
Son yörüngedeki elektron sayısı = Değerlik elektron sayısı
Periyodik Sistemde Periyotlar
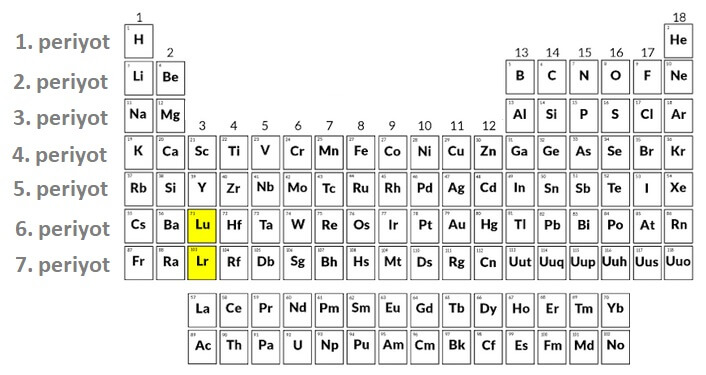
- Periyodik sistemde 7 tane periyot vardır.
- Periyot numaraları yukarıdan başlanarak verilmiştir.
- Bir atomun, periyot numarası ile yörünge sayısı eşittir. Örneğin;
- H (Hidrojen) atomu 1. periyottadır çünkü; H atomunda 1 tane yörüngesi vardır.
- Ca (Kalsiyum) atomu 4. periyottadır çünkü; Ca atomunun 4 tane yörüngesi vardır.
- Periyotlardaki element sayıları şöyledir:
- 1. periyot: 2 element
- 2. periyot: 8 element
- 3. periyot: 8 element
- 4. periyot: 18 element
- 5. periyot: 18 element
- 6. periyot: 32 element
- 7. periyot: 32 element
Bu bir reklamdır:
Periyodik Sistemde Lantanit ve Aktinitler
- Periyodik sistemin altında, ayrıca çizilen bir blok vardır.
- Periyodik sistemin yavrusu gibi, alt tarafında ve iki sıra halinde çizilen bu bloktaki elementler Lantanit ve Aktinitlerdir.
- Lantanit ve Aktinitler aslında, periyodik sistemin ana gövdesinde bulunması gereken elementlerdir.
- Fakat, periyodik sistemin şeklini bozmamak için, ayrı bir tablo halinde aşağıda gösterilirler.
Aşağıdaki periyodik sistemde, Lantanit ve Aktinitler gösteriliyor.

Lantanitler
- Lantanitler, Lantan (La) elementi ile başlayan periyottaki elementlerin ortak adıdır.
- Lantan elementi ile başladıkları için de “Lantanit” adını alırlar.
- Lantanitler, toplam 14 tanedir.
- Proton sayılarının takip edersek, Lantanitlerin 6. periyot 3B grubunda bulunduklarını anlayabiliriz.
- Hepsi bir kutuya sığamayacağı için, periyodik sistemin altına dizilmişlerdir.
Aktinitler
- Aktinitler, Aktinyum (Ac) elementi ile başlayan periyottaki elementlerin ortak adıdır.
- Aktinyum elementi ile başladıkları için de “Aktinit” adını alırlar.
- Aktinitler, toplam 14 tanedir.
- Proton sayılarının takip edersek, Aktinitlerin 7. periyot 3B grubunda bulunduğunu anlayabiliriz. Hepsi bir kutuya sığmayacağı için, periyodik sistemin altına dizilmişlerdir.
Atomlarda Elektron Dağılımı
- Elektron dağılımı demek, bir atomun elektronlarını o atomun yörüngelerine doğru bir şekilde dağıtmak demektir.
- Her atomun elektron sayısı aynı değildir.
- H atomunda sadece 1 tane elektron vardır,
- P atomunda 15 tane elektron vardır.
- Ca atomunda 20 tane…
Pauli Prensibi
- A gruplarındaki atomların elektronları, yörüngelere Pauli Prensibine göre dizilir.
- Pauli Prensibi özetle şudur:
- Her yörüngenin bir elektron kapasitesi vardır.
- Yandaki/alttaki tablo ilk 3 yörüngenin elektron kapasitesini vermektedir.
- Elektronlar, çekirdeğe en yakın yörüngeden başlayarak dizilir.
- Elektronlar, yörüngeleri doldura doldura dizilir.
- Bir yörünge dolmadan, diğerine elektron dizilmez.
- Bu kurallar TYT kimyasında sorumlu olduğumuz ilk 20 ve bütün A grubu atomları için geçerlidir.
- AYT kimyasında B grubu atomları da dahil olacak işler biraz değişecektir.
- Her yörüngenin bir elektron kapasitesi vardır.
| Yörünge Numarası | Elektron Kapasitesi |
|---|---|
| 1. yörünge | 2 elektron |
| 2. yörünge | 8 elektron |
| 3. yörünge | 8 elektron |
Bu bir reklamdır:
İlk 20 Atomun Elektron Dizilimi
1H1 : )1e–
2He2 : )2e–
3Li3 : )2e– )1e–
4Be4 : )2e– )2e–
5B5 : )2e– )3e–
6C6 : )2e– )4e–
7N7 : )2e– )5e–
8O8 : )2e– )6e–
9F9 : )2e– )7e–
10Ne10 : )2e– )8e–
11Na11 : )2e– )8e– )1e–
12Mg12 : )2e– )8e– )2e–
13Al13 : )2e– )8e– )3e–
14Si14 : )2e– )8e– )4e–
15P15 : )2e– )8e– )5e–
17Cl17 : )2e– )8e– )7e–
16S16 : )2e– )8e– )6e–
18Ar18 : )2e– )8e– )8e–
19K19 : )2e– )8e– )8e– )1e–
20Ca20 : )2e– )8e– )8e– )2e–
İyonlarda Elektron Dağılımı
- İyonların elektron sayısı bulunur, bulunan elektronlar nötr atomlarda olduğu gibi dizilir.
- İyonlar hakkında detaylı bilgi için tıklayabilirsin:
6C104-: )2e– )8e–
11Na10+ : )2e– )8e–
12Mg10+ : )2e– )8e–
3Li2+ : )2e–
17Cl18– : )2e– )8e– )8e–
19K18+ : )2e– )8e– )8e–
20Ca182+: )2e– )8e– )8e–
Örnek:
16S atomunun elektron dağılımını çizerek gösteriniz.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Periyodik sistemdeki ilk 20 atomun temel hallerinin elektron dağılımını çiziniz.
Örneğin çözümü:
Grup ve Periyot Bulma
- Temel haline ait elektron dağılımına bakarak, bir atomun grup ve periyoduna şu şekilde karar verilir:
- Atomun son yörüngesindeki elektron sayısı (değerlik elektron sayısı) kaç A grubunda olduğunu gösterir.
- Atomun sahip olduğu yörünge sayısı da kaçıncı periyotta bulunduğunu gösterir.
Örnek:
16S atomunun periyodik sistemdeki yerini (grup ve periyodunu) bulunuz.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Al+3 iyonunda 10 elektron vardır.
Buna göre Al elementinin grup ve periyot numarası kaçtır?
Cevap
Örneğin çözümü:
Elementlerin Sınıflandırılması
Elementler 4 çeşittir. Bunlar şunlardır:
- Metaller, 92 tanedir.
- Ametaller, 11 tanedir.
- Yarı metaller, 8 tanedir.
- Asal (Soy) gazlar, 7 tanedir.
Aşağıda verilen tablodaki her bir renk, bir element sınıfına aittir.

- TYT Kimyasında, bütün metalleri veya ametalleri veya diğer sınıflardaki elementleri ezbere bilmeniz beklenmiyor. Fakat ilk 3 periyodu, yani ilk 20 elementi, sınıfları ile birlikte bilmeniz gerekmektedir.
- Bunların dışında;
- Demir (Fe)
- Altın (Au)
- Gümüş (Ag)
- Platin (Pt)
- Cıva (Hg)
- Bakır (Cu) gibi yaygın metalleri de bilmeniz gerekmektedir.
Şimdi bu element sınıflarının her birine yakından bakalım.
Metaller
- Elementler içinde, 92 tane metal vardır.
- Metaller en kalabalık element sınıfıdır.
- En aktif metaller 1A ve 2A grubunda bulunur.
- Altın, demir, bakır, gümüş, alüminyum gibi metaller, günlük hayatımızda sıkça karşılaştığımız metallerdir.
Meraklısı için bazı metallerin fotografları aşağıdadır.








- Metal atomlarının son yörüngelerindeki elektron sayısı (değerlik elektron sayısı da denir) genellikle 1, 2 veya 3 tane olur.
İstisna: Hidrojen (H) atomunun son yörüngesinde 1 elektron vardır ama bir ametaldir. Helyum (He) atomunun son yörüngesinde 2 elektron vardır ama bir asal gazdır. Bor (B) atomunun son yörüngesinde 3 elektron vardır ama bir yarı-metaldir. - Ametallerle bileşik yaparken de son yörüngelerindeki bu elektronların hepsini ametale verirler.
- Yüzeyleri parlak olup ışığı yansıtırlar.
- Oda sıcaklığında (250C) cıva (Hg) hariç katı hâldedirler.
- Isıyı ve elektrik akımını iyi iletirler.
- Çoğu tel ve levha hâline getirilebilir, dövülerek işlenebilir.
- Kendi atomları arasında metalik bağ bulunduğundan genellikle sağlam yapılıdırlar.
- Erime ve kaynama noktaları, yoğunlukları genellikle ametaller ve soy gazlardan yüksektir.
- Doğada genellikle bileşikleri hâlinde bulunurlar.
- Bileşik oluştururken elektron almazlar, daima elektron vererek pozitif (+) yüklü iyon hâline geçerler.
- Ametallerle iyonik bağlı bileşikleri oluştururlar.
- Kendi aralarında bileşik oluşturamazlar fakat; birbirleri ile karıştırılarak alaşımları oluştururlar. Mesela;
- çelik,
- bronz,
- pirinç birer metal alaşımıdır.
- B gruplarındaki bütün elementler metaldir.
- Lantanit ve aktinitlerin hepsi metaldir.
Bu bir reklamdır:
Ametaller
- Hidrojen (H2), Azot (N2) ve Oksijen (O2) ametalleri renksiz gazlardır. Aşağıda bazı ametallerin fotoğrafları verilmiştir.




- Periyodik sistemdeki H, C, N, O, F, P, S, Cl, Se, Br, I elementleri ametaldir.
- Genellikle 4A, 5A, 6A ve 7A grubunda yer alırlar ve bu yüzden değerlik elektron sayıları da sırasıyla 4, 5, 6 ve 7’dir.
- Katı hâlde olanlar mat görünümlüdür, yani parlak değildir.
- Oda sıcaklığında katı, sıvı veya gaz hâlinde bulunabilirler. Örneğin iyot (I2) katı, brom (Br2) sıvı, oksijen (O2), klor (Cl2) gaz hâlindedir.
- Isıyı ve elektrik akımını iletmezler (karbonun farklı bir formu olan grafit hariç. Grafit kurşun kalemlerimizin veya uçlu kalemlerimizin ucu olan maddedir).
- Tel ve levha hâline getirilemezler, dövülerek işlenemezler. Çünkü; katı hâlde iken kırılgandırlar, ufalanırlar.
- Ametaller genellikle doğada, iki veya daha fazla atomdan oluşan moleküller hâlinde bulunurlar. (Cl2 , O2 , P4, S8…)
- Erime, kaynama noktaları ve yoğunlukları genellikle metallere göre düşüktür.
- Bileşik oluştururken elektron vererek pozitif (+), elektron alarak negatif (-) yüklü iyon hâline geçebilirler.
- Metallerle elektron alış verişi yaparak iyonik bağlı bileşikler oluştururlar.
- Kendi aralarında elektronları ortaklaşa kullanarak kovalent bağlı bileşikler oluştururlar.
Yarı Metaller
- Yarı metaller, metal-ametal sınırında bulunurlar.
- Yarı metaller, bazı özellikleri ile metallere bazı özellikleri ile ametallere benzeyen elementlerdir.
Yarı metaller hakkında bilinmesi gerekenler şunlardır:
- Periyodik sistemdeki B, Si, Ge, As, Sb, Te, Po, At elementleri, yarı metallerdir.
- Bu elementler; 3A, 4A, 5A, 6A ve 7A grubunda bulunurlar.
- Değerlik elektron sayıları 3 ile 7 arasında değişir.
- Dış görünümleri ve bazı fiziksel özellikleri ile metallere, kimyasal özellikleri ile de ametallere benzerler.
- Metallerle ametallerin arasında yer alırlar.
- Ametallerle kovalent bileşikler oluştururlar.
- Metallerle alaşımlar yaparlar.
- Hem pozitif hem de negatif yüklü iyon hâline geçebilirler.
- Hem metallerin hem de ametallerin özelliklerini taşırlar.
- Katı hâldedirler ve işlenebilirler.
- Parlak veya mat olabilirler.
- Elektriği ametallerden daha iyi, metallerden daha az iletirler.
- Sıcaklıkları arttıkça elektrik iletkenlikleri de artar.
Bu bir reklamdır:
Asal (Soy) Gazlar
- Soy gazları daha çok araba farlarında veya ışıklandırılmış köprülerde renkli ışıklar saçarken görürüz.
- Xenon farlar buna bir örnektir.
Aşağıda, rengarenk ışıkları ile soy gaz ampulleri verilmiştir.
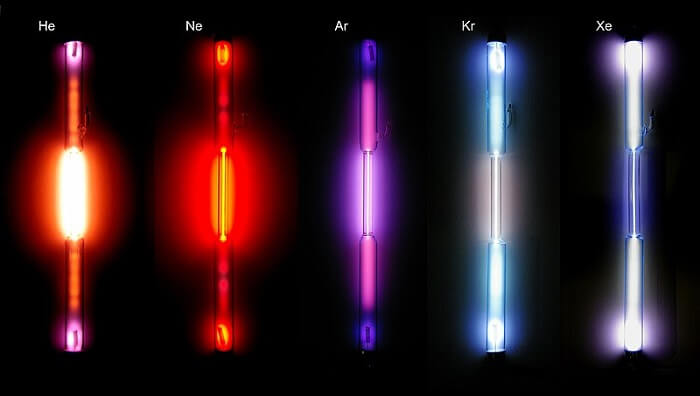
Soygazlar, periyodik sistemin en son grubudur. Soygazların başlıca özellikleri şunlardır:
- Periyodik sistemdeki 18. grupta (8A grubunda) yer alırlar.
- He, Ne, Ar, Kr, Xe, Rn elementleri soy (asal) gazları oluşturur.
- Son katmanlarında (yani son yörüngelerinde) 8 elektron bulundururlar. (He son katmanında 2 elektron bulundurur.)
- Oda koşullarında hepsi gaz hâlinde bulunurlar.
- Atomik yapılıdırlar. Yani atomları yalnız takılır, kimse ile bağ kurmazlar.
- Erime, kaynama noktaları ve yoğunlukları düşüktür.
- Kararlı yapıdadırlar ve bileşik oluşturmazlar (Kr ve Xe elementlerinin özel şartlarda bazı bileşikleri elde edilebilir.).
Periyodik Özellikler
- Periyodik özellikler, periyodik sistemde, belli bir yöne doğru giderken düzenli olarak artan ya da azalan özelliklerdir.
- Periyodik özellikler 5 tanedir ve şunlardır:
- Atom Çapı
- İyonlaşma Enerjisi
- Elektron ilgisi
- Elektronegatiflik
- Metalik-Ametalik Özellik
Gelin bu özellikleri daha yakından görelim.
1. Atom Yarıçapı
- Bu başlık altında bizden, atom çaplarını hesaplamamız değil; büyükten küçüğe veya küçükten büyüğe sıralamamız istenecektir.
- “Atom yarıçapı” kavramı, “atom hacmi” veya “atom çapı” olarak da sorulabilir. Çünkü; yarıçapı daha büyük olan her kürenin çapı da hacmi de kesin olarak daha büyüktür.
- Atomlar küre şeklindeki taneciklerdir. Her kürenin olduğu gibi atomun da bir çapı doğal olarak da bir yarıçapı vardır.
Atomların Yarıçapı Nasıl Hesaplanmıştır?
- Atom yarıçapını ölçmek için, katı halde ve aynı olan iki atomun çekirdekleri arasındaki mesafe ölçülür.
- Çekirdekler arasındaki ölçülen mesafenin yarısı atomun yarıçapı olur.

- Katı halde iken atomlar birbirine oldukça yakındır. Yarıçap ölçülürken katı halin seçilmesinin sebebi budur.
Atomların Çaplarına Göre Sıralanması
- Atomları çaplarına göre sıralarken uymamız gereken iki temel kural vardır. Bu kurallar, sırasıyla şunlardır:
- Atomlardan, yörünge sayısı daha fazla olan atom her zaman daha şişmandır, yani çapı daha büyüktür.
- Atomların yörünge sayıları aynı ise, proton sayısı küçük olan atom her zaman daha şişmandır.
- Proton sayıları da eşitse, elektron sayısı çok olanın yarıçapı daha büyük olacaktır.
Kurallara dikkat edersek, çaplarını kıyaslarken, önce atomların yörünge sayılarına bakmamız gerekiyor. Bu yüzden, çap sorularında önce, atomların elektron dağılımını yapmamız gerekiyor.
Örnek:
16S, 10Ne ve 5B atomlarının hacimlerini, büyükten küçüğe doğru sıralayınız.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Periyodik Sistemde Atom Çapı
Aynı gruptaki atomların çapları:
- Periyodik sistemin aynı grubunda, daha aşağıda bulunan atomlar her zaman daha şişmandır.
- Çünkü; aşağıya doğru inildikçe atomların yörünge sayısı artar.

Aynı periyottaki atomların çapları:

- Aynı periyotta, grup numarası arttıkça (sağa doğru) atom çapı küçülür.
- Çünkü; sağa doğru gidildikçe, proton sayısı artar.
- Periyodik sistemde, sola ve aşağı doğru gidildikçe, atom çapı artacaktır.
- Fr (Fransiyum) atomu; en solda ve en aşağıdaki atomdur.
- Bu yüzden atomlar arasında en şişman atom Fransiyumdur.

İyon Çapı
- Elektron alan bir atom, kilo almış gibi şişmanlar ve çapı artar.
- Elektron veren atom da kilo vermiş gibi zayıflar ve çapı azalır.
Örnek:
X, X+3, X-1 atom ve iyonlarının çaplarını kıyaslayınız.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
2. İyonlaşma Enerjisi (İ.E.)
- Yeterli paranız pardon enerjiniz varsa, bir atomdan bütün elektronlarını satın alabilirsiniz pardon kopartabilirsiniz.
- Yapmanız gereken tek şey, her elektronu için atomun istediği enerjiyi atoma vermektir.
- İyonlaşma enerjisinin tanımı şudur:
- Gaz hâlinde ve nötür bir atomdan bir elektron koparmak için atoma verilmesi gereken enerjiye 1. iyonlaşma enerjisi denir.
- 1. iyonlaşma enerjisi (1.İ.E.) şu tepkime ile de verilebilir:
X(g) + 130 kj/mol → X(g)+1 + 1e– - 2. iyonlaşma enerjisi (2.İ.E.) şu tepkime ile de verilebilir:
X(g)+1 + 296 kj/mol → X(g)+2 + 1e– - 3. iyonlaşma enerjisi (3.İ.E) şu tepkime ile de verilebilir:
X(g)+2 + 517 kj/mol → X(g)+3 + 1e– - …
- Elektronlar atomun yörüngelerine, birinci yörüngeden itibaren yerleştirilirken, sonuncu yörüngeden itibaren kopartılır.
- Yani nötür bir atomdan elektronlarını istediğinizde, size son yörüngesindeki elektronlardan başlayarak verecektir.
- Bir atomun kaç tane elektronu varsa o kadar iyonlaşma enerjisi vardır.
- Yeterli enerjiyi verirsek atomdan bütün elektronlarını koparabiliriz.
- Bütün elektronlarını koparırsak atom, plazma haline geçer.
Örnek:
X(g)+1 + 2670 kj/mol → X(g)+4 + 3e–
Yukarıdaki tepkimede görülen 2670 kj/mol değerindeki enerji, atomun kaçıncı iyonlaşma enerjisidir?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Bir Atomun İyonlaşma Enerjileri Arasındaki İlişki
- Bir atomdan elektron koparırken, her zaman bir sonraki elektronu daha zor kopartırız.
- Yani her zaman 2. iyonlaşma enerjisi, 1. iyonlaşma enerjisinden daha büyüktür; 3. iyonlaşma enerjisi de 2.’den daha büyüktür…
- Mesela; Bor (B) atomunun 5 tane elektronu olduğundan, 5 tane iyonlaşma enerjisi vardır ve en büyükleri 5. iyonlaşma enerjisidir.
1.İ.E. < 2. İ.E. < 3. İ.E. < 4. İ.E. < 5. İ.E.
- Bir atomlardan, elektron kopardıkça atomda şunlar değişir:
- Atomun elektron sayısı azalır.
- Atomun çapı küçülür.
- Geriye kalan elektronlar çekirdeğe yaklaşır.
- Geriye kalan elektronlar çekirdeğin çekim gücünü daha çok hissederler.
- Bu yüzden, sonraki elektron daha zor kopar ve iyonlaşma enerjisi daha yüksek bir değer alır.
Üç Buçuk (3.5) Kat Kuralı
- Bir sonraki iyonlaşma enerjisi, en az 3.5 kat daha yüksek ise, atomun son yörüngesindeki son elektronu kopartıyoruz demektir.
- Yani; 3.5 katlık artıştan önce, kaç tane iyonlaşma enerjisi varsa, atomun son yörüngesinde o kadar tane elektron var demektir.
Örnek:
Aşağıdaki tabloda, bazı atomların iyonlaşma enerjileri verilmiştir.
| Atom | 1. İ.E. (kj/mol) | 2. İ.E. (kj/mol) | 3. İ.E. (kj/mol) | 4. İ.E. (kj/mol) |
|---|---|---|---|---|
| X | 1312 | – | – | – |
| Y | 2372 | 5298 | 11850 | – |
| Z | 577 | 1816 | 2744 | 11577 |
| T | 520 | 7298 | 11815 | 15577 |
| Q | 453 | 798 | 915 | 1577 |
Buna göre, bu atomların grup numaraları için neler söylenebilir?
Cevap
Örneğin çözümü:
Atomların İyonlaşma Enerjilerine Göre Sıralanması
- Elektron dağılımına bakarak, iyonlaşma enerjilerini, sırasıyla şu kurallara göre sıralarız:
- Değerlik elektron sayısı (yani son yörüngedeki elektron sayısı) daha fazla olan atom ya da iyonun iyonlaşma enerjisi daha büyüktür, elektronu daha zor kopar.
- Değerlik elektron sayıları eşit olan atom ya da iyonlardan çapı küçük olanın iyonlaşma enerjisi daha büyüktür.
Örnek:
12Mg, 20Ca ve 10Ne atomlarının 1. ve 3. iyonlaşma enerjilerini kıyaslayınız.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Aynı Periyotta Birinci İyonlaşma Enerjisi
- İyonlaşma enerjisi kurallarına göre, aynı periyotta, 1A grubundan 8A grubuna doğru gidildikçe 1. iyonlaşma enerjisinin artması gerekir:
1A < 2A < 3A < 4A < 5A < 6A < 7A < 8A
- Fakat; gerçek sıralamada 3A grubu bir aşağı inmiş, 5A grubu bir yukarı çıkmıştır (3 aşağı 5 yukarı kuralı). Yani gerçekte, aynı periyotta, 1. iyonlaşma enerjisi sıralaması şöyledir:
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A
- Bu kuralı, grafik üzerinde de görmek için periyodik sistemdeki ilk 20 atomun Proton sayısına karşılık 1. İyonlaşma enerjisi grafiğine bakalım. Grafik şöyledir:

Periyodik Sistemde İyonlaşma Enerjisi

- Periyodik sistemde, iyonlaşma enerjisi, sağa ve yukarı doğru artar.
- İyonlaşma enerjisi en yüksek olan atom Helyum (He) atomudur (1. periyot, 8A grubu).
3. Elektron İlgisi (E.İ.)
- Elektron ilgisinde mantık, iyonlaşma enerjisinin tam tersidir.
- İyonlaşma enerjisinde atoma enerji verip elektronunu koparıyorduk, Elektron ilgisinde ise atoma elektron verip karşılığında enerji alacağız.
- Tanım: Gaz hâlindeki nötr bir atomun elektron alarak negatif yüklü iyon oluşturması sırasındaki enerji değişimine elektron ilgisi denir ve E.İ. ile gösterilir.
- Elektron alırken, dışarıya daha çok enerji veren atomların elektron ilgisi daha büyüktür.
- Aşağıdaki tepkimelerden anlıyoruz ki, X atomunun elektron ilgisi daha büyüktür:
X(g) + e– → X(g)-1 + 235 kj/mol
Y(g) + e– → X(g)-1 + 75 kj/mol
- Soy gazların elektron ilgileri çok düşük hatta sıfıra yakındır.
- Ametallerin elektron ilgileri çok yüksektir.
- Metaller elektron almaya değil de vermeye ilgi duydukları için, metallerin de elektron ilgisi düşüktür.
Bu bir reklamdır:
Periyodik Sistemde Elektron İlgisi
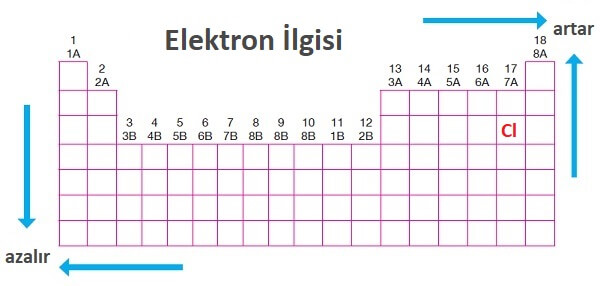
- Periyodik sistemde, sağa ve yukarıya doğru gidildikçe elektron ilgisi artar.
- Elektron ilgisi ametalik bir özelliktir.
- Periyodik sistemde, aynı periyotta soldan sağa doğru gidildikçe elektron ilgisi genellikle artar.
- Aynı grupta yukarıdan aşağıya inildikçe elektron ilgisi genellikle azalır.
- Elektron ilgisi en büyük olan atom Klorun (Cl) atomudur.
4. Elektronegatiflik
- “Elektronegatiflik” kavramı bazen karşımıza “elektronegetivite” veya “eksiçekerlik” olarak da çıkabilir.
- Elektronegatiflik, tıpkı elektron ilgisi gibi ametallerin daha üstün olduğu bir özelliktir.
- Tanım: Bir atomun, kovalent bağ elektronlarını kendine doğru çekme gücüne elektronegatiflik denir.
- Periyodik sistemde, elektronegativitesi en yüksek olan atom Flor (F) atomudur.
- Flor atomunun elektornegatiflik değeri keyfi olarak 4.0 kabul edilmiştir.
- Diğer atomların gücü hep Flor ile kıyaslanmış ve ona göre birer elektronegatiflik değeri verilmiştir.
- Mesela; bir atomun elektronegatiflik gücü Flor atomunun yarısı kadar ise bu atomun elektronegatifliği 2.0 olmuştur.
- Periyodik sistemde elektronegatifliği en büyük üç element sırası ile flor (F), oksijen (O) ve azottur (N).
- Elektronegatiflik değerlerinin bir birimi yoktur.
- Soygazların bağ kurma yetenekleri olmadığı için elektronegatiflik değerleri de çok düşüktür.
Bu bir reklamdır:
Periyodik Sistemde Elektronegatiflik

- Periyodik sistemde 2. periyot, 7A grubu atomu olan Flor atomunun elektronegatiflik değeri en büyüktür. Bu yüzden periyodik sistemde, sağa ve yukarı doğru gidildikçe atomların elektronegatiflik değerleri artar.
5. Metalik – Ametalik Özellik
- Bir elementin atomları ne kadar kolay elektron veriyorsa o element o kadar güzel bir metaldir. Bu yüzden, metal atomlarının, iyonlaşma enerjileri ve elektron ilgileri düşüktür.
- Ametallerde durum tam tersidir. Yani ametaller, elektron ilgisi, elektronegatifliği, iyonlaşma enerjisi yüksek olan elementlerdir.
Periyodik Sistemde Metalik-Ametalik Özellik
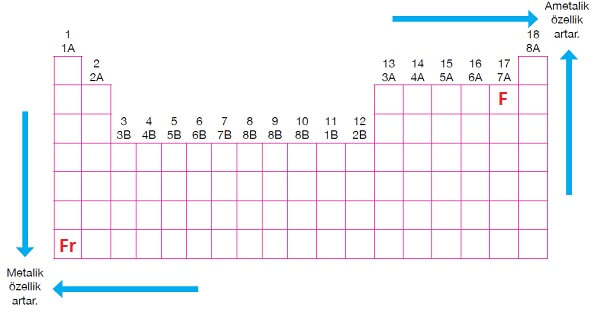
- Fr (Fransiyum) metali, metallere özgü özellikleri en yüksek seviyede gösteren elementtir. Yani en iyi metaldir.
- Periyodik sistemde Fransiyuma daha yakın olan elementlerin metalik karakterleri daha iyi olacaktır.
- F (Flor) ametali de, ametallere özgü özellikleri en yüksek seviyede gösteren elementtir. Yani en iyi ametaldir.
- Periyodik sistemde Flora daha yakın olan elementlerin ametalik karakterleri daha iyi olacaktır.
Bu bir reklamdır:
Konu Özeti
Periyodik sistem hakkında bilmemiz gerekenler kısaca şunlardır:
- Mendeleyev, elementleri atom kütlelerine göre grup ve periyotlara dizmiş ve 1913 yılına kadar geçerli bir periyodik sistem tasarlamıştır.
- Moseley, atoların proton sayılarını hesaplamış ve elementleri proton sayılarına göre dizerek bugünkü periyodik sistemin mimarı olmuştur
- Elementler periyodik sisteme, 1’den başlayarak sırayla ve proton sayılarına göre dizilmişlerdir.
- Periyodik sistemde; 18 tane grup, 7 tane periyot vardır. Grup isimleri sol baştan başlayarak, 1’den 18’e kadar değerler alır.
- Periyodik sistemdeki gruplar için A ve B harfleri de kullanılır. Bu sistemde, 8 tane A grubu, 8 tane B grubu vardır.
Periyodik sistemde bazı grupların özel isimleri şunlardır:
- 1A grubu: Alkali metaller (İstisna: Bu gruptaki H elementi, bir alkali metal değildir.)
- 2A grubu: Toprak alkali metaller
- 3A grubu: Toprak metalleri
- 4A gubu: Karbon grubu
- 5A grubu: Azot grubu
- 6A grubu: Oksijen grubu (Kalkojenler)
- 7A grubu: Halojenler (Tuz oluşturanlar)
- 8A grubu: Soy gazlar (Asal gazlar)
- Bir atomun grup numarası kaç ise, değerlik elektron sayısı odur. (Bu kural A ve B grupları için geçerlidir.)
- Periyodik sistemdeki yatay sıralara periyot denir ve 7 tane periyot vardır.
- Periyot numarası, atomun yörünge sayısı demektir.
- Lantanit ve aktinitler, periyodik sistemin altında ayıca çizilen bölmede bulunur.
- Atomların elektronlarını yörüngelerine dağıtırken Puli Prensibine uyarız.
Pauli Prensibi
- Her yörüngeye 2n2 tane elektron sığar.
- n harfi yörünge numarasıdır.
- Kaçıncı yörüngenin elektron kapasitesini merak ediyorsak, “n” yerine onu yazarız.
- Son yörüngede en fazla 8 elektron bulunur.
- Son yörüngeye 8’den fazla elektron denk geliyorsa:
- bir önceki yörüngedeki kadarını buraya koyarız,
- geriye kalanını da bir sonraki yörüngeye koyarız.
Elementleri Sınıfları
Elementler 4 çeşittir. Bunlar şunlardır:
- Metaller: 92 tane
- Ametaller: 11 tane
- Yarı metaller: 8 tane
- Asal (Soy) gazlar: 7 tane
Metallerin özellikleri şunlardır:
- Metal atomlarının son yörüngelerindeki elektron sayısı (değerlik elektron sayısı da denir) genellikle 1, 2 veya 3 tane olur. Ametallerle bileşik yaparken de son yörüngelerindeki bu elektronların hepsini ametale verirler.
İstisna: Hidrojen (H) atomunun son yörüngesinde 1 elektron vardır ama bir ametaldir. Helyum (He) atomunun son yörüngesinde 2 elektron vardır ama bir asal gazdır. Bor (B) atomunun son yörüngesinde 3 elektron vardır ama bir yarı-metaldir. - Yüzeyleri parlak olup ışığı yansıtırlar.
- Oda sıcaklığında (250C) civa hariç katı hâldedirler.
- Isıyı ve elektrik akımını iyi iletirler.
- Çoğu tel ve levha hâline getirilebilir, dövülerek işlenebilir.
- Kendi atomları arasında metalik bağ bulunduğundan genellikle sağlam yapılıdırlar.
- Erime ve kaynama noktaları, yoğunlukları genellikle ametaller ve soy gazlardan yüksektir.
- Doğada genellikle bileşikleri hâlinde bulunurlar.
- Bileşik oluştururken elektron almazlar, daima elektron vererek pozitif (+) yüklü iyon hâline geçerler.
- Ametallerle iyonik bağlı bileşikleri oluştururlar.
- Kendi aralarında bileşik oluşturamazlar fakat; birbirleri ile karıştırılarak alaşımları oluştururlar. Mesela çelik, bronz, pirinç birer metal alaşımıdır.
- B gruplarındaki bütün elementler metaldir.
- Lantanit ve aktinitlerin hepsi metaldir.
Ametallerin Özellikleri
- Periyodik sistemdeki H, C, N, O, F, P, S, Cl, Se, Br, I elementleri ametaldir.
- Genellikle 4A, 5A, 6A ve 7A grubunda yer alırlar ve bu yüzden değerlik elektron sayıları da sırasıyla 4, 5, 6 ve 7’dir.
- Katı hâlde olanlar mat görünümlüdür, yani parlak değildir.
- Oda sıcaklığında katı, sıvı veya gaz hâlinde bulunabilirler. Örneğin iyot (I2) katı, brom (Br2) sıvı, oksijen (O2), klor (Cl2) gaz hâlindedir.
- Isıyı ve elektrik akımını iletmezler (karbonun farklı bir formu olan grafit hariç. Grafit kurşun kalemlerimizin veya uçlu kalemlerimizin ucu olan maddedir).
- Tel ve levha hâline getirilemezler, dövülerek işlenemezler. Çünü; katı hâlde iken kırılgandırlar, ufalanırlar.
- Ametaller genellikle doğada, iki veya daha fazla atomdan oluşan moleküller hâlinde bulunurlar. (Cl2 , O2 , P4, S8…)
- Erime, kaynama noktaları ve yoğunlukları genellikle metallere göre düşüktür.
- Bileşik oluştururken elektron vererek pozitif (+), elektron alarak negatif (-) yüklü iyon hâline geçebilirler.
- Metallerle elektron alış verişi yaparak iyonik bağlı, kendi aralarında elektronları ortaklaşa kullanarak kovalent bağlı bileşik oluştururlar.
Yarı Metallerin Özellikleri
- Periyodik sistemdeki B, Si, Ge, As, Sb, Te, Po, At elementleri, yarı metallerdir. Bu elementler; 3A, 4A, 5A, 6A ve 7A grubunda bulunurlar.
- Yarı metaller; dış görünümleri ve bazı fiziksel özellikleri ile metallere, kimyasal özellikleri ile de ametallere benzerler.
- Metallerle ametallerin arasında yer alırlar.
- Hem pozitif hem de negatif yüklü iyon hâline geçebilirler.
- Hem metallerin hem de ametallerin özelliklerini taşırlar.
- Katı hâldedirler ve işlenebilirler.
- Parlak veya mat olabilirler.
- Elektriği ametallerden daha iyi, metallerden daha az iletirler.
Asal (Soy) Gazların Özellikleri
- Periyodik sistemdeki 18. grupta (8A grubunda) yer alırlar.
- He, Ne, Ar, Kr, Xe, Rn elementleri soy (asal) gazları oluşturur.
- Son katmanlarında (yani son yörüngelerinde) 8 elektron bulundururlar. (He son katmanında 2 elektron bulundurur.)
- Oda koşullarında hepsi gaz hâlinde bulunurlar.
- Atomik yapılıdırlar. Yani atomları yalnız takılır, kimse ile bağ kurmazlar.
- Erime, kaynama noktaları ve yoğunlukları düşüktür.
- Kararlı yapıdadırlar ve bileşik oluşturmazlar (Kr ve Xe elementlerinin özel şartlarda bazı bileşikleri elde edilebilir.).
Periyodik Özellikler
Periyodik özellikler 5 tanedir ve şunlardır:
- Atom Çapı
- İyonlaşma Enerjisi
- Elektron ilgisi
- Elektronegatiflik
- Metalik-Ametalik Özellik
1. Atom Çapı
- Atomlardan, yörünge sayısı daha fazla olan atom her zaman daha şişmandır, yani çapı daha büyüktür.
- Atomların yörünge sayıları aynı ise, proton sayısı küçük olan atom her zaman daha şişmandır.
- Genel olarak, periyodik sistemde, Fr atomuna daha yakın atomlar daha şişmandır. Yani, aşağıya ve sola doğru atom çapı artar.
- Elektron alınca bir atom, kilo almış gibi şişmanlar yani çapı artar. Elektron veren atom da kilo vermiş gibi zayıflar yani çapı azalır.
2. İyonlaşma Enerjisi (İ.E.)
- Gaz hâlinde ve nötür bir atomdan bir elektron koparmak için atoma verilmesi gereken en az enerjiye 1. iyonlaşma enerjisi denir.
- Bir atomun kaç tane elektronu varsa o kadar iyonlaşma enerjisi vardır.
- Atomdan her zaman bir sonraki elektronu daha zor kopartırız. Yani her zaman 2. iyonlaşma enerjisi, 1. iyonlaşma enerjisinden daha büyüktür; 3. iyonlaşma enerjisi de 2.’den daha büyüktür…
- Bir yörüngenin son elektronu ile altındaki yörüngenin ilk elektronuna ait iyonlaşma enerjileri arasında, en az 3.5 kat fark olur.
- Değerlik elektron sayısı (yani son yörüngedeki elektron sayısı) daha fazla olan atom ya da iyonun iyonlaşma enerjisi daha büyüktür, elektronu daha zor kopar.
- Değerlik elektron sayıları eşit olan atom ya da iyonlardan çapı küçük olanın iyonlaşma enerjisi daha büyüktür.
Aynı periyottaki atomların iyonlaşma enerjisi sırası şöyledir.
- 1. periyot: 1A < 8A
- 2. periyot: 1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A
- 3. periyot: 1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A
- Periyodik sistemde, Helyum atomuna daha yakın olan atomların 1. iyonlaşma enerjileri daha büyüktür. Yani, sola ve yukarıya doğru iyonlaşma enerjisi artar.
3. Elektron İlgisi (E.İ.)
- Gaz hâlindeki nötr bir atomun elektron alarak negatif yüklü iyon oluşturması sırasındaki enerji değişimine elektron ilgisi denir ve E.İ. ile gösterilir.
- Soy gazlar kararlı olduklarından elektron ilgileri çok düşük hatta sıfıra yakındır.
- Ametaller elektron almaya yatkın olduklarından elektron ilgileri çok yüksektir.
- Metaller elektron almaya değil de vermeye ilgi duydukları için, metallerin de elektron ilgisi düşüktür.
- Periyodik sistemde, aynı periyotta soldan sağa doğru gidildikçe elektron ilgisi genellikle artar.
- Aynı grupta yukarıdan aşağıya inildikçe elektron ilgisi genellikle azalır fakat; 7A grubunda bulunan Florun (F) elektron ilgisinin daha büyük olması beklenirken Klorun (Cl) elektron ilgisi daha büyüktür.
- Periyodik sistemde Cl atomuna doğru gidildikçe yani, sağa ve yukarıya doğru gidildikçe elektron ilgisi artar.
4. Elektronegatiflik
- Bir atomun, kovalent bağ elektronlarını kendine doğru çekme gücüne elektronegatiflik denir.
- Flor (F) atomunun elektronegatiflik değeri en büyüktür ve 4,0 olarak kabul edilip diğer elementlerin elektronegatiflikleri flor element atomu ile karşılaştırılarak bulunur.
- Elektronegatiflik değerlerinin bir birimi yoktur.
- Periyodik sistemde elektronegatifliği en büyük üç element sırası ile flor (F), oksijen (O) ve azottur (N).
- Klor (Cl), brom (Br) ve iyot (I) halojenlerinin elektronegatiflik değerleri de diğer elementlerden büyüktür.
- Periyodik sistemde atom yarıçapının azaldığı yönlerde genel olarak elektronegatiflik değerleri artar.
- Bir periyotta sağ tarafa ve grupta yukarıya doğru gidildikçe element atomlarının elektronegatiflik değerleri genel olarak artar.
- Soygazların bağ kurma yetenekleri olmadığı için elektronegatiflik değerleri de çok düşüktür.
- Periyodik sistemde 2. periyot, 7A grubu atomu olan Flor atomunun elektronegatiflik değeri en büyüktür. Bu yüzden periyodik sistemde, sağa ve yukarı doğru gidildikçe atomların elektronegatiflik değerleri artar.
5. Metalik – Ametalik Özellik
- Fr metali, metallere özgü özellikleri en yüksek seviyede gösteren elementtir. Yani en iyi metaldir. Periyodik sistemde Fransiyuma daha yakın olan elementlerin metalik karakterleri daha iyi olacaktır.
- F ametali de, ametallere özgü özellikleri en yüksek seviyede gösteren elementtir. Yani en iyi ametaldir. Periyodik sistemde Flora daha yakın olan elementlerin ametalik karakterleri daha iyi olacaktır.



13 yorum “3. Periyodik Sistem”