Mendeleyev’in periyodik sistemi için aşağıdakilerden hangisi doğru değildir?
Atom ve Periyodik Sistem → 3. Bölüm
İçindekiler
- Periyodik Sistem
- Periyodik Sistem
- Periyodik Sistem
- Periyodik Sistem
- Periyodik Sistem
- Periyodik Tablo ve Element Sembolleri
- Periyodik Sistem
- Periyodik Sistem
- Periyodik Sistem
- Periyodik Sistem
- Periyodik Sistem
- Periyodik Sistem
- Periyodik Sistem
- Periyodik Sistem
- Periyodik Sistem
- Periyodik Sistem
- Periyodik Sistem
- Periyodik Sistem
- Periyodik Sistem
- Periyodik Sistem
DERS
TYT Kimya
Kimya 9
KONU
ÜNİTE II
ATOM ve Periyodik Sistem
III. Bölüm – 1
Periyodik Sistem
Dersin Özellikleri:
- Seviye: Hiç Bilmeyenler İçin
- Gerekli Bilgiler:
- Öğretmen:
- Muzaffer KAYA
Anlatılacak Başlıklar*:
- Periyodik Sistem
- Atomların Katman Elektron Dağılımları
- Periyodik Sistemin Tarihsel Gelişimi
- Grup ve Periyot Bulma
- Elementlerin Sınıflandırılması
* Konu anlatımı, örneklerle zenginleştirilmiştir.
Periyodik Sistem
İlk 20 Atomun Katman Elektron Dağılımı
- Atomun elektronlarını yerleştirilirken:
- İlk yörüngeden başlanır
- Yörüngeler doldura doldura gidilir.
- 1. yörünge 2 elektron
- 2. yörünge 8 elektron
- 3. yörünge 8 elektron
ile dolar.
Örnek:
16S atomunun elektron dağılımı 3 farklı şekilde gösterilmiştir.

Periyodik Sistem
İlk 20 Atomun Katman Elektron Dağılımı
1H1 : )1e–
2He2 : )2e–
3Li3 : )2e– )1e–
4Be4 : )2e– )2e–
5B5 : )2e– )3e–
6C6 : )2e– )4e–
7N7 : )2e– )5e–
8O8 : )2e– )6e–
9F9 : )2e– )7e–
10Ne10 : )2e– )8e–
11Na11 : )2e– )8e– )1e–
12Mg12 : )2e– )8e– )2e–
13Al13 : )2e– )8e– )3e–
14Si14 : )2e– )8e– )4e–
15P15 : )2e– )8e– )5e–
16S16 : )2e– )8e– )6e–
17Cl17 : )2e– )8e– )7e–
18Ar18 : )2e– )8e– )8e–
19K19 : )2e– )8e– )8e– )1e–
20Ca20 : )2e– )8e– )8e– )2e–
Periyodik Sistem
İlk 20 Atomun Katman Elektron Dağılımı
İyonlarda Elektron Dağılımı
İyonların elektron sayısı bulunur, bulunan elektronlar nötr atomlarda olduğu gibi dizilir.
6C104-: )2e– )8e–
11Na10+ : )2e– )8e–
12Mg10+ : )2e– )8e–
3Li2+ : )2e–
17Cl18– : )2e– )8e– )8e–
19K18+ : )2e– )8e– )8e–
20Ca182+: )2e– )8e– )8e–
Periyodik Sistem
Periyodik Sistemin Kısa Tarihçesi
Periyodik Sistem Nedir?
- Bilinen bütün elementlerin sistematik bir şekilde sıralandığı tablodur.
Periyodik Tablo ve Element Sembolleri

Dimitri Mendeleyev ve Periyodik Sistem
- Dmitry Mendeleyev (1869) : Bilinen 63 elementi, atom kütlelerine göre (kütle numarası) sıralamıştır.

- Boş kalan yerlerin daha sonra keşfedileceğini söylemiş ve özelliklerini doğru tahmin etmiştir.

Periyodik Sistem
Periyodik Sistemin Kısa Tarihçesi
Periyodik Sistem ve Moseley

- Mendeleyev’in sorunları vardı:
- Mendeleyev’in periyodik sisteminde, bazı elementlerin özellikleri gruptaki diğer elementlere benzemiyordu.
- Mendeleyev bu durumu, bu elementlerin atom kütlelerinin yanlış hesaplandığını söyleyerek açıklamıştır.
- Mendeleyev’in periyodik sisteminde, bazı elementlerin özellikleri gruptaki diğer elementlere benzemiyordu.
- Bugün kullandığımız periyodik sistemin mimarı, Henry Moseley‘dir.
- İngiliz fizikçi Moseley; 1915 yılında Dünya Savaşı’nda Gelibolu’da ölmüştür.
- Moseley, 1913 yılında, elementlerin ürettiği X ışınları ile atom numaraları arasında bir bağ olduğunu keşfetti.
- Bu keşif sayesinde, bütün elementlerin proton sayısını hesaplayabildi.
Periyodik Sistem
Periyodik Sistemin Kısa Tarihçesi
Örnek
Atomları atom ağırlıklarına göre dizmiştir.
12 periyot ve 8 gruptan oluşur.
Bazı kutuları boştur.
Günümüzde de geçerlidir.
Henüz keşfedilmeyen elementleri öngörmüştür.
Periyodik Sistem
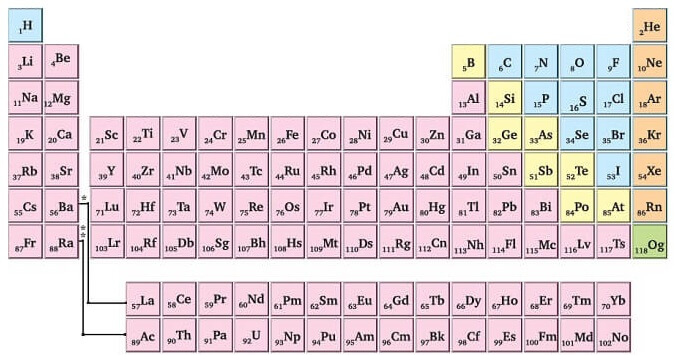
Günümüzdeki Periyodik Sistem
- Günümüzdeki periyodik sistemde, atomlar, atom numaralarına göre sırayla yerleştirilmiştir.
Periyodik Sistem
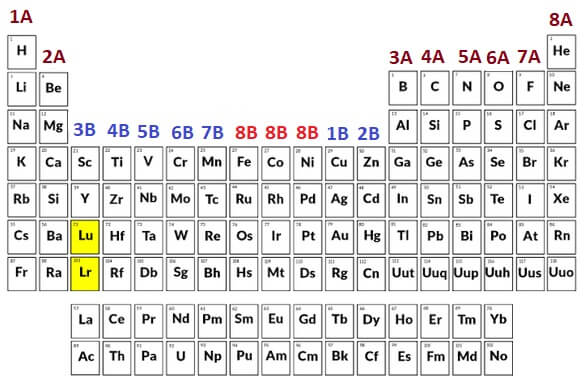
Grup ve Periyot Kavramı
Grup Nedir?
- Dikey sütunlara grup denir.
- Gruplar 1-18 arası numaralarla da adlandırılır.
- Bu adlandırma sistemi IUPAC sistemidir.

Periyodik Sistem
Grup ve Periyot Kavramı
Grup Nedir?
- Dikey sütunlardır.
- A ve B harfleri ile de adlandırılırlar.
- A gruplarında şunlar eşittir:
- Değerlik elektron sayısı
(son yörüngedeki elektron sayısı)
- Grup numarası
- Değerlik elektron sayısı
- Mesela:
- 18Ar18 : )2e– )8e– )8e–
(8A grubunda)
- 18Ar18 : )2e– )8e– )8e–
Periyodik Sistem
Grup ve Periyot Kavramı
Grupların Özel İsimleri
- 1A grubu: Alkali metaller
- 2A grubu: Toprak alkali metaller
- 7A grubu: Halojenler
- 8A grubu: Asal gazlar (Soy gazlar)

Periyodik Sistem
Grup ve Periyot Kavramı
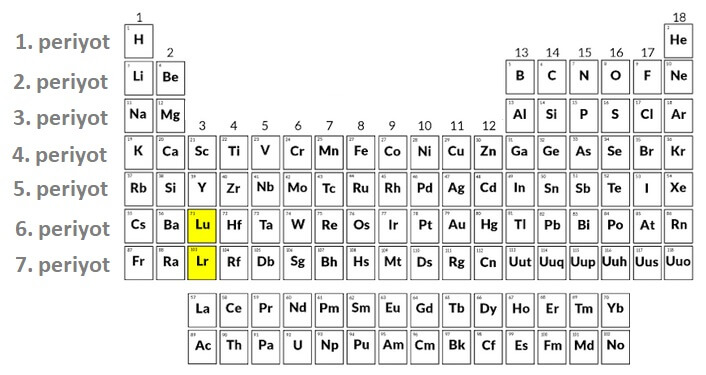
Periyot Nedir?
- Yatay sıralar periyot denir.
- Periyot numaraları, yukarıdan aşağıya doğru sırayla verilmiştir.
- Atomun yörünge sayısı periyot numarasına eşittir.
Periyodik Sistem
Periyodik Sistemin Kısa Tarihçesi
Örnek
Periyodik sistem için aşağıdakilerden hangisi doğru değildir?
Moseley’in çalışmaları ile ortaya çıkmıştır.
Elementler atom numaralarına göre sırayla dizilmiştir.
Aynı gruptaki atomların kimyasal özellikleri benzerdir.
İkinci periyotta 2 tane element vardır.
Dikey sütunlara grup, yatay satırlara periyot denir.
Periyodik Sistem
İlk 20 Atomda Grup Periyot Bulma
- Nötür ve temel haldeki her atomun:
- Periyot numarası:
- Yörünge sayısıdır.
- A grubu numarası:
- Son yörüngesindeki elektron sayısıdır.
- Periyot numarası:
- 2He atomu 8A grubundadır ve bu kuralın istisnasıdır.
Mesela:
16S16 : )2e– )8e– )6e–
atomu 3. periyot, 6A grubundadır.
Örnek:
Al+3 iyonunda 10 elektron vardır.
Buna göre Al elementinin grup ve periyot numarası kaçtır?
Çözüm:
13 Al +3 10 proton sayısı 13 olur.
13Al13 : )2e– )8e– )3e–
3. periyot, 3A grubu
Periyodik Sistem
Elementlerin Sınıflandırılması
- Elementler 4 sınıfa ayrılır. Bunlar:
- Metaller
- Ametaller
- Yarı Metaller
- Asal (Soy) Gazlar

Periyodik Sistem
Elementlerin Sınıflandırılması
1. Metaller
- Değerlik elektron sayıları genellikle 1, 2 veya 3 tane olur.
- Bileşik yaparken, son yörüngelerindeki bütün elektronları, ametallere verirler.
- Yüzeyleri parlaktır. Isıyı ve elektrik akımını iyi iletirler.
- Oda sıcaklığında (250C) cıva (Hg) hariç katı hâldedirler.
- Tel ve levha hâline getirilebilir, dövülerek işlenebilir.
- Metal atomları arasında metalik bağ vardır.
- Yoğunlukları genellikle ametaller ve soy gazlardan yüksektir.
- Doğada genellikle bileşikleri hâlinde bulunurlar.
- Ametallerle iyonik bağlı bileşikleri oluştururlar.
- Kendi aralarında bileşik oluşturamazlar fakat; birbirleri ile karıştırılarak alaşımları oluştururlar.
Periyodik Sistem
Elementlerin Sınıflandırılması
2. Ametaller
- H, C, N, O, F, P, S, Cl, Se, Br, I elementleri ametaldir.
- Genellikle 4A, 5A, 6A ve 7A grubunda yer alırlar ve bu yüzden değerlik elektron sayıları sırasıyla 4, 5, 6 ve 7’dir.
- Katı hâlde olanlar mat görünümlüdür.
- Oda sıcaklığında katı, sıvı veya gaz hâlinde bulunabilirler.
- Isıyı ve elektrik akımını iletmezler (Grafit hariç).
- Kırılgandırlar, tel ve levha hâline getirilemezler, dövülerek işlenemezler.
- Doğada, genellikle, moleküller hâlde bulunurlar. (Cl2 , O2 , P4, S8…)
- Bileşiklerinde pozitif (+) veya negatif (-) yükseltgenme basamağına sahip olabilirler.
- Metallerle iyonik bağlı kendi aralarında kovalent bağlı bileşikler oluştururlar.
Periyodik Sistem
Elementlerin Sınıflandırılması
3. Yarı Metaller
- Metal-ametal sınırında yaşarlar.
- Bazı özellikleri ile metallere bazı özellikleri ile ametallere benzeyen elementlerdir.
- Yarı metaller; dış görünümleri ve bazı fiziksel özellikleri ile metallere, kimyasal özellikleri ile de ametallere benzerler.
- Metallerle ametallerin arasında yer alırlar.
- Hem pozitif hem de negatif yüklü iyon hâline geçebilirler.
- Hem metallerin hem de ametallerin özelliklerini taşırlar.
- Katı hâldedirler ve işlenebilirler.
- Parlak veya mat olabilirler.
- Elektriği ametallerden daha iyi, metallerden daha az iletirler.
Periyodik Sistem
Elementlerin Sınıflandırılması
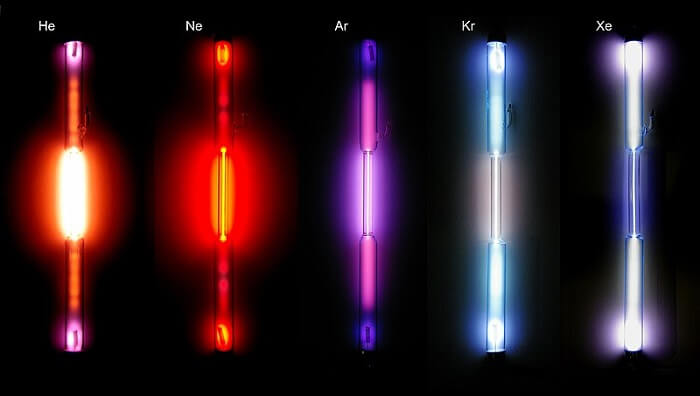
4. Asal (Soy) Gazlar
- Periyodik sistemdeki 18. grupta (8A grubunda) yer alırlar.
- He, Ne, Ar, Kr, Xe, Rn elementleri soy (asal) gazları oluşturur.
- Son katmanlarında 8 elektron bulundururlar. (He son katmanında 2 elektron bulundurur.)
- Oda koşullarında hepsi gaz hâlinde bulunurlar.
- Atomik yapılıdırlar.
- Erime, kaynama noktaları ve yoğunlukları düşüktür.
- Kararlı yapıdadırlar ve bileşik oluşturmazlar (Kr ve Xe elementlerinin özel şartlarda bazı bileşikleri elde edilebilir.).

Atom ve Periyodik Sistem
III. Bölüm – 1
(Periyodik Sistem)
Bitti 🙁









