Atom ve Periyodik Sistem → 3. Bölüm
İçindekiler
- Periyodik Sistem
- Lantanitler ve Aktinitler
- Periyodik Özelliklerin Değişme Eğilimi
- Periyodik Özelliklerin Değişme Eğilimi
- Periyodik Özelliklerin Değişme Eğilimi
- Periyodik Özelliklerin Değişme Eğilimi
- Periyodik Özelliklerin Değişme Eğilimi
- Periyodik Özelliklerin Değişme Eğilimi
- Periyodik Özelliklerin Değişme Eğilimi
- Periyodik Özelliklerin Değişme Eğilimi
- Periyodik Özelliklerin Değişme Eğilimi
- 1. İyonlaşma Enerjisi Sıralaması
- 2. İyonlaşma Enerjisi Sıralaması
- Periyodik Özelliklerin Değişme Eğilimi
- Periyodik Özelliklerin Değişme Eğilimi
- Periyodik Özelliklerin Değişme Eğilimi
- Periyodik Özelliklerin Değişme Eğilimi
- Periyodik Özelliklerin Değişme Eğilimi
- Periyodik Özelliklerin Değişme Eğilimi
- Periyodik Özelliklerin Değişme Eğilimi
- Periyodik Özelliklerin Değişme Eğilimi
DERS
TYT Kimya
Kimya 9
KONU
ÜNİTE II
ATOM ve Periyodik Sistem
III. Bölüm – 2
Periyodik Sistem
Dersin Özellikleri:
- Seviye: Hiç Bilmeyenler İçin
- Gerekli Bilgiler:
- Öğretmen:
- Muzaffer KAYA
* Konu anlatımı, örneklerle zenginleştirilmiştir.
Anlatılacak Başlıklar*:
- Periyodik Sistem
- Lantanit ve Aktinitler
- Periyodik Özelliklerin Değişme Eğilimi
- Atom/İyon Yarıçapı Eğilimi
- İyonlaşma Enerjisi Eğilimi
- Elektron İlgisi Eğilimi
- Elektronegatiflik Eğilimi
- Metalik ve Ametalik Eğilimi
Lantanitler ve Aktinitler
- Hepsi 3B grubundadır.
- Lantanitler
6. periyot - Aktinitler
7. periyottadır. - İç geçiş metalleridir.

Periyodik Özelliklerin Değişme Eğilimi
Periyodik Özellik Nedir?
- Periyodik sistemde, herhangi bir yöne doğru giderken genellikle artan ya da azalan özelliklere periyodik özellikler denir.

Periyodik Özellikler Nelerdir?
- Atom/İyon Yarıçapı Eğilimi
- İyonlaşma Enerjisi Eğilimi
- Elektron İlgisi Eğilimi
- Elektronegatiflik Eğilimi
- Metalik ve Ametalik Eğilimi
Periyodik Özelliklerin Değişme Eğilimi
1. Atom/İyon Yarıçapı Eğilimi
Atom Yarıçapı Nedir?

- Katı haldeki aynı iki atomun çekirdekleri arasındaki mesafenin yarısıdır.
Atom Yarıçapı Nasıl Karşılaştırılır?
- Atomların elektron dağılımına bakılır ve şu kurallar uygulanır:
- Yörünge sayısı daha fazla olan atomun yarıçapı daha büyüktür.
- Yörünge sayıları eşitken, proton sayısı daha az olan atomun yarıçapı daha büyüktür.
- Proton sayıları da eşitse, elektron sayısı daha fazla olan atomun yarıçapı daha büyüktür.
- Atomun yarıçapı daha büyükse, çapı ve hacmi de daha büyüktür.
Örnek:
16S16 )2e– )8e– )6e–
10Ne10 )2e– )8e–
5B5 )2e– )3e–
Yukarıda elektron dizilimleri verilen atomların hacimlerini karşılaştırınız.
Cevap:
S > B > Ne
Periyodik Özelliklerin Değişme Eğilimi
1. Atom/İyon Yarıçapı Eğilimi
İyonik Yarıçap
- Atomlar elektron verince çapları küçülür.
- Atomlar elektron alınca çapları büyür.
(Elektron vermek kilo vermeye, elektron almak kilo almaya benzetilebilir.)
Örnek:
X, X+3, X-1 atom ve iyonlarının çaplarını kıyaslayınız.
Çözüm:
X-1 > X > X+3
Periyodik Özelliklerin Değişme Eğilimi
1. Atom/İyon Yarıçapı Eğilimi
Periyodik Sistemde Atom Yarıçapı
- Aşağı ve sola gidildikçe atam yarıçapı artar.
- En şişman atom Fransiyumdur (Fr).
Kardan adam gibi değişir.


Periyodik Özelliklerin Değişme Eğilimi
2) İyonlaşma Enerjisi (İE) Eğilimi
İyonlaşma Enerjisi Nedir?
- Gaz halindeki ve nötür bir atomdan, 1 elektron koparmak için gereken enerjiye 1. iyonlaşma enerjisi denir.
- Elektronlar son yörüngeden içeriye doğru kopar.
Ver enerjisini (ücretini) al elektronu
Elektron Sayısı Kadar İyonlaşma Enerjisi Vardır

- 1. iyonlaşma enerjisi (1.İ.E.):
X(g) + 130 kj/mol → X(g)+1 + 1e– - 2. iyonlaşma enerjisi (2.İ.E.):
X(g)+1 + 296 kj/mol → X(g)+2 + 1e– - 3. iyonlaşma enerjisi (3.İ.E):
X(g)+2 + 517 kj/mol → X(g)+3 + 1e– - …
Periyodik Özelliklerin Değişme Eğilimi
2) İyonlaşma Enerjisi (İE) Eğilimi
Örnek:
X(g)+1 + 2670 kj/mol → X(g)+4 + 3e–
Yukarıdaki tepkimede görülen 2670 kj/mol değerindeki enerji, atomun kaçıncı iyonlaşma enerjisidir?
Periyodik Özelliklerin Değişme Eğilimi
2) İyonlaşma Enerjisi (İE) Eğilimi
Bir Sonraki Elektron Daha Zor Kopar
- Bir atomdan elektron koparırken, her zaman bir sonraki elektronu daha zor kopartırız.
- Yani her zaman 2. iyonlaşma enerjisi, 1. iyonlaşma enerjisinden daha büyüktür; 3. iyonlaşma enerjisi de 2.’den daha büyüktür…
1.İ.E. < 2. İ.E. < 3. İ.E. < 4. İ.E. < 5. İ.E.…
- Yani her zaman 2. iyonlaşma enerjisi, 1. iyonlaşma enerjisinden daha büyüktür; 3. iyonlaşma enerjisi de 2.’den daha büyüktür…
Elektronu Azalan Atomda Neler Olur?
- Bir atomlardan, elektron kopardıkça atomda şunlar değişir:
- Atomun elektron sayısı azalır.
- Atomun çapı küçülür. (Geriye kalan elektronlar çekirdeğe yaklaşır.)
- Elektron başına düşen çekim gücü artar.
- Bu yüzden, sonraki elektron daha zor kopar ve iyonlaşma enerjisi daha yüksek bir değer alır.
- Çekirdeğin çekim gücü değişmez.
Periyodik Özelliklerin Değişme Eğilimi
2) İyonlaşma Enerjisi (İE) Eğilimi
Üç Buçuk (3.5) Kat Kuralı
- Bir sonraki iyonlaşma enerjisi, en az 3.5 kat daha yüksek ise, atomun son yörüngesindeki sonuncu elektronu kopartıyoruz demektir.

Örnek: Aşağıdaki atomların grup numaralarını bulunuz.
| Atom | 1. İ.E. (kj/mol) | 2. İ.E. (kj/mol) | 3. İ.E. (kj/mol) | 4. İ.E. (kj/mol) |
|---|---|---|---|---|
| X | 1312 | – | – | – |
| Y | 1172 | 5298 | 11850 | – |
| Z | 577 | 1816 | 2744 | 11577 |
| T | 520 | 7298 | 11815 | 15577 |
| Q | 453 | 798 | 915 | 1577 |
Periyodik Özelliklerin Değişme Eğilimi
2) İyonlaşma Enerjisi (İE) Eğilimi
Farklı Atomların İyonlaşma Enerjilerine Göre Sıralanması
- Atomların elektron dağılımına bakılır:
- Değerlik elektron sayısı daha çok olan atomun iyonlaşma enerjisi daha büyüktür.
- Değerlik elektron sayıları eşit olan atomlardan çapı küçük olanın iyonlaşma enerjisi daha büyüktür.
Örnek:
19K, 20Ca ve 12Mg atomlarının 1. ve 2. iyonlaşma enerjilerini kıyaslayınız.
Çözüm:
1. İyonlaşma Enerjisi Sıralaması
19K19 : )2e– )8e– )8e– )1e–
20Ca20 : )2e– )8e– )8e– )2e–
12Mg12 : )2e– )8e– )2e–
Cevap:
Mg > Ca > K
2. İyonlaşma Enerjisi Sıralaması
19K18+ : )2e– )8e– )8e–
20Ca19+ : )2e– )8e– )8e– )1e–
12Mg11+ : )2e– )8e– )1e–
Cevap:
K+ > Mg+ > Ca+
Periyodik Özelliklerin Değişme Eğilimi
2) İyonlaşma Enerjisi (İE) Eğilimi
Aynı Periyottaki Atomlarda 1. İyonlaşma Enerjisi
- Aynı periyotta, ardışık atomların 1. iyonlaşma enerjisi sıralaması, gruplarına göre şöyledir:
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A
(3 aşağı 5 yukarı)

Periyodik Özelliklerin Değişme Eğilimi
2) İyonlaşma Enerjisi (İE) Eğilimi
Periyodik Sistemde İyonlaşma Enerjisi
- Aşağı ve sola gidildikçe atam yarıçapı artar.
- En cimri atom Helyumdur (He).

Periyodik Özelliklerin Değişme Eğilimi
3) Elektron İlgisi (Eİ)
Elektron İlgisi Nedir?
- Gaz hâlindeki nötr bir atomun elektron alarak negatif yüklü iyon oluşturması sırasındaki enerji değişimine elektron ilgisi denir.
- Elektron ilgisi “E.İ.” ile gösterilir.
X(g) + e– → X(g)-1 + 235 kj/mol
Y(g) + e– → Y(g)-1 + 75 kj/mol
- Elektron ilgisi “E.İ.” ile gösterilir.
- Soy gazların elektron ilgileri çok düşük ve sıfıra yakındır.
- Ametallerin elektron ilgileri çok yüksektir.
- Metaller elektron almaya değil de vermeye ilgi duydukları için, metallerin de elektron ilgisi düşüktür.
Periyodik Özelliklerin Değişme Eğilimi
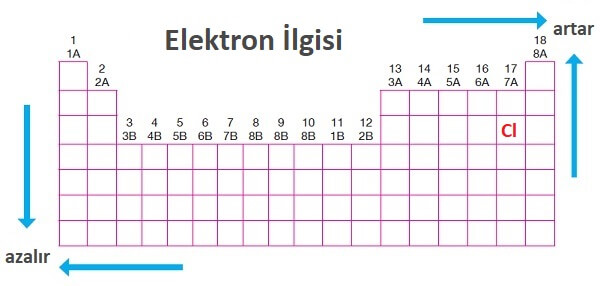
3) Elektron İlgisi (Eİ)
Periyodik Sistemde Elektron İlgisi
- Yukarı ve sağa doğru gidildikçe elektron ilgisi artar.
- En cömert atom Klor atomudur (Cl).
Periyodik Özelliklerin Değişme Eğilimi
4) Elektronegatiflik (En) Eğilimi
Elektronegatiflik (En) Nedir?
- Tanım: Bir atomun, kovalent bağ elektronlarını kendine doğru çekme gücüne elektronegatiflik (elektronegativite veya eksiçekerlik) denir.
- Ametallerin daha üstün olduğu bir özelliktir.
- Elektronegativitesi en yüksek olan atom Flor (F) atomudur.
- Flor atomunun elektornegatiflik değeri keyfi olarak 4.0 kabul edilmiştir.
- Diğer atomların elektronegatiflik değeri F’ye oranla hesaplanmıştır.
- Periyodik sistemde elektronegatifliği en büyük üç element sırası ile flor (F), oksijen (O) ve azottur (N).
- Elektronegatiflik değerlerinin bir birimi yoktur.
- Soygazların elektronegatiflik değerleri de çok düşüktür.
Periyodik Özelliklerin Değişme Eğilimi
4) Elektronegatiflik (EN) Eğilimi
Periyodik Sistemde Elektronegatiflik
- Yukarı ve sağa doğru gidildikçe elektron ilgisi artar.
- En çekici atom Flor atomudur (F).
- İki atom arasındaki elektronegatiflik farkı ne kadar fazla ise, bağları o kadar çok iyonik karakterli olur.

Periyodik Özelliklerin Değişme Eğilimi
5) Metalik – Ametalik Aktiflik
Metalik-Ametalik Aktiflik Nedir?
- Metalik özellikleri daha iyi gösteren elementlerin metalik aktifliği daha yüksektir.
- Başlıca metalik özellikler şunlardır:
- Elektron verme eğilimi,
- Elektrik iletkenliği,
- Parlak yüzey,
- İyonik ve metalik bağ kurabilme yeteneği,
- Şekil alabilme
- Ametalik özellikleri daha iyi gösteren elementlerin ametalik aktifliği daha yüksektir.
- Başlıca ametalik özellikler şunlardır:
- Elektron alma eğilimi,
- Elektrik yalıtkanlığı,
- Mat yüzey,
- Kovalent bağ kurabilme yeteneği
Periyodik Özelliklerin Değişme Eğilimi
5) Metalik – Ametalik Aktiflik
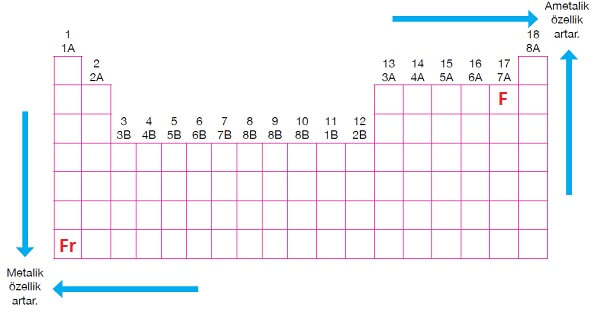
Periyodik Sistemde Metalik-Ametalik Aktiflik
- Yukarı ve sağa doğru gidildikçe ametalik özellik artar.
- En iyi ametal Flor atomudur (F).
- Aşağı ve sola doğru gidildikçe metalik özellik artar.
- En iyi metal Fransiyum atomudur (Fr).

Atom ve Periyodik Sistem
III. Bölüm – 2
(Periyodik Sistem)
Bitti 🙁