İçindekiler
- Lewis Elektron Nokta Yapısı
- Atomlar Neden Kimyasal Bağlar Kurarlar?
- İyonik Bağ
- Kovalent Bağ
- III. Metalik Bağ
Güçlü etkileşimler, zayıf etkileşimlere göre koparılması daha yüksek enerji gerektiren bağlardır.
- Güçlü etkileşimleri koparmak için gereken enerji (bağ enerjisi de denir) genellikle 40 kj/mol veya daha büyüktür.
- Zayıf etkileşimlerin bağ enerjileri genellikle 40 kj/mol değerinin altındadır.
- Güçlü etkileşimler 3 tanedir:
- İyonik Bağ
- Kovalent Bağ
- Metalik Bağ
- Güçlü etkileşimlerden:
- İyonik ve kovalent bağa kimyasal bağlar da denir.
- Metalik bağ, güçlü bir etkileşimdir fakat bir kimyasal bağ olarak geçmez.
Sevgili öğrencim, güçlü etkileşimleri anlatmaya geçmeden önce, Lewis Nokta Yapısı hakkında bilgi vermek istiyorum, çünkü; Lewis Nokta Yapıları, kimyasal bağları daha basit bir şekilde göstermemizi sağlayan yapılardır.
Lewis Elektron Nokta Yapısı
- “Lewis Elektron Nokta Yapısı” kavramı;
- “Lewis Yapısı” veya
- “Lewis Nokta Yapısı” veya
- “Lewis Sembolleri” veya
- “Lewis Formülleri” olarak da isimlendirilebilir.
- Lewis Nokta Yapısı (Lewis Elektron Nokta Yapısı da denir) demek, bir atomun sembolünün etrafına noktalar koymak demektir.

- Bir atomun bütün kimyasal özellikleri, son yörüngesindeki elektronlarda saklıdır.
- Bu yüzden, atomların son yörüngesindeki elektronlar çok değerlidir ve bu yüzden:
- son yörüngedeki elektronlara değerlik elektronları denir;
- son yörüngedeki elektron sayısında da sayısına değerlik elektron sayısı da denir.
- Lewis adındaki kimyacı bunu fark etmiştir ve atomun sadece son yörüngesindeki elektronları bilsek bu bize yeter diye düşünmüştür.
- Lewis, bu amaçla atomların sembollerinin etrafına değerlik elektron sayıları kadar nokta koymuştur.
- Etrafında noktalar olan bu sembollere biz Lewis Nokta Yapısı diyoruz.
- Atomlarda Elektron Dağılımı konusunda, bir atomun son yörüngesinde en fazla 8 elektron olabileceğini öğrenmiştik.
- O zaman, Lewis nokta yapısında da en fazla 8 nokta olabilir demektir.
Noktalar Nasıl Konulur?
- Önce atomun elektron dağılımını yapıp son yörüngesinde kaç elektron olduğunu bulacağız. Atomun son yörüngesindeki elektron sayısı, Lewis nokta yapısındaki nokta sayısı demektir.
- Noktaları koymaya başlamadan önce, atomların sembollerini görünmez bir dikdörtgen içinde hayal edeceğiz. Yani sembollerin etrafında dört tane kenarı olduğunu kabul edeceğiz.
- İlk dört noktayı bu dört kenarın her birine birer tane olacak şekilde koyacağız. Hangi kenardan başlayacağınız hiç önemli değil.
- Beşinci nokta ile birlikte artık kenarlara ikinci noktaları koymaya başlayacağız.
- Aşağıda, 1 noktadan 8 noktaya kadar, Lewis nokta yapısında karşılaşabileceğimiz bütün gösterimler verilmiştir.

- Nötür bir atomun, değerlik elektron sayısı kaç ise, grup numarası da oldur.
- Aşağıda, 2. periyottaki atomların 1A’dan 8A’ya doğru sırayla Lewis Nokta Yapıları verilmiştir.

Örnek:
13X atomunun Lewis elektron nokta yapısı aşağdakilerden hangisindeki gibidir?
![]()
Cevap
Örneğin çözümü:
Noktaları Çizgi ile Gösterebilirsiniz
- Son olarak, aynı kenara koyduğunuz iki noktayı bir tane kısa çizgi olarak (—) gösterme hakkımız vardır, istediğimiz zaman bu hakkımızı kullanabiliriz, bu karar tamamen bize aittir.
- Kenarlardaki bir çizgi iki elektron demektir.
- Aşağıda, 2. periyottaki atomların 1A’dan 8A’ya doğru sırayla Lewis Nokta Yapıları verilmiştir. Yukarıdakinden farklı olarak, aynı kenarlardaki iki nokta bir çizgi ile gösterilmiştir.

Örnek:
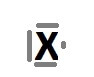
Yukarıda, temel haline ait Lewis Elektron Nokta Yapısı verilen X atomu hakkında aşağıdakilerden hangisi kesinlikle yanlıştır?
A) Değerlik elektron sayısı 7’dir.
B) 7A grubunda bulunan bir atomdur.
C) Bir metal atomudur.
D) Tabiatta katı, sıvı veya gaz halinde bulunabilir.
E) Diğer atomlar ile hem iyonik bağ hem de kovalent bağ kurabilir.
Cevap
Örneğin çözümü:
İlk 20 Atomun Lewis Nokta Yapıları
Aşağıda, periyodik sistemin ilk 20 atomunun temel hallerine ait Lewis Nokta Yapıları verilmiştir.
Aynı grupta bulunan atomların Lewis nokta yapılarının da aynı olduğuna dikkat edin.

Anyonların Lewis Nokta Yapısı
- Anyonlar; atomların elektron almasıyla oluşur.
- Anyonlarda, Lewis Yapısını bulmak için:
- Anyonun elektron sayısını hesaplarız.
- Elektron dağılımını yaparız.
- Elektron dağılımında, son yörüngesine bakarak Lewis Nokta Yapısını yazabiliriz.
Öğretici Örnek:
Gelin 17Cl– iyonunun Lewis Nokta Yapısını yapalım:
- 17Cl1- iyonunun elektron sayısı 18’dir.
- Lewis Nokta Yapısını göstermek için önce bu iyonun elektron dağılımını yapalım:
- 17Cl-118 )2e– )8e– )8e–
- Bu durumda Cl– iyonunun değerlik elektron sayısı 8’dir. O zaman Lewis Nokta Yapısı, 8A atomları gibi 8 noktalı olmalıdır:

(Yük ile Lewis nokta yapısı karışmasın diye köşeli parantez kullanılmıştır.)
Katyonların Lewis Nokta Yapısı
- Katyonlar, son yörüngelerinden elektron vermiş olan atomlardır.
- Katyonlar bu yüzden pozitif (+) yüklüdürler.
- Bir katyonun Lewis elektron yapısını yaparken:
- Önce nötür (temel) halinin Lewis yapısı bulunur.
- Sonra, bu yapıdan, katyonun yükü kadar nokta silinir ve işlem biter.
- Eğer atom, son yörüngesindeki bütün elektronları vermiş ise o zaman Lewis yapısında hiç nokta olmayacak demektir.
Öğretici Örnek:
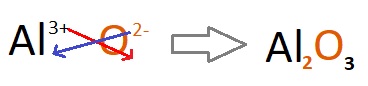
Gelin 13Al3+ (Alüminyum) katyonunun Lewis Elektron Nokta Yapısını bulalım.
- İlk adım, katyonun temel haline ait Lewis elektron nokta yapısını bulmaktır:
- 13Al atomunun nötür iken elektron dağılımı şöyledir:
13Al13 )2e– )8e– )3e– - Değerlik elektron sayısı 3 olduğu için Lewis elektron nokta yapısı şöyledir:

- 13Al atomunun nötür iken elektron dağılımı şöyledir:
- Şimdi Al atomunun etrafından 3 nokta silelim:
- Al atomunun Lewis yapısından 1 nokta silersek, atom 1 elektron vermiş olur ve Al+ iyonuna dönüşür:

(Köşeli parantez; yük ile noktalar karışmasın diye çizilmiştir.) - Al+ iyonunun Lewis yapısından 1 nokta silersek, atom 1 elektron daha vermiş olur ve Al2+ iyonuna dönüşür:

- Al2+ iyonunun Lewis yapısından 1 nokta silersek, atom 1 elektron daha vermiş olur ve Al3+ iyonuna dönüşür:

- Aslında, Al3+ iyonunun Lewis yapısında köşeli paranteze de gerek yoktur. Çünkü; ortalıkta, iyonun yükü ile karışacak bir nokta yoktur, hepsini verip +3 yük kazanmıştır. Yani şu gösterim de bu iyonun Lewis yapısıdır aslında:
- Al atomunun Lewis yapısından 1 nokta silersek, atom 1 elektron vermiş olur ve Al+ iyonuna dönüşür:
Al3+
Atomlar Neden Kimyasal Bağlar Kurarlar?
- Kimyasal bağların; iyonik ve kovalent bağlar olduğunu daha önce öğrenmiştik.
- Atomların iyonik veya kovalent bağ kurarken, amaçları kararlı olmaktır.
- Atomları kararlı yapan şey, kendilerine an yakın asal gaz atomunun elektron düzenine sahip olmaktır.
- Aşağıda ilk 4 asal gazın elektron sayıları ve düzenleri verilmiştir:
- He2 )2e–
- Ne10 )2e– )8e–
- Ar18 )2e– )8e– )8e–
- Kr36 )2e– )8e– )18e– )8e–
- Dikkat edersek He asal gazında sadece 2 elektron vardır. Diğerler asal gaz atomlarının değerlik elektron sayısı 8’dir.
- He soy gazına yakın atomlar, elektron sayıları 2 (duble) olunca He gibi kararlı olurlar.
- Bu kurala dublet kuralı denir.
- 2 elektronu olan bir atom dubletini tamamlamıştır.
- Diğer soy gazlara daha yakın olan atomlar; son yörüngelerinde 8 (okta) elektron (oktet) olunca kararlı olurlar.
- Bu kurala oktet kuralı denir.
- Değerlik elektron sayısı 8 olan bir atom oktetini tamamlamıştır.
- İşte, kimyasal bağ kurmak, atomların dublet ve oktetlerini tamamlayıp, kararlı olmalarını sağlar.
- Asal gazlar zaten kararlı oldukları için kimyasal bağlar kurmazlar.
- Asal gazların elektron düzenlerinde dublet ve oktet zaten tamamlanmıştır.
Oktet ya da dubletini tamamlayan atomlara kararlı atomlar denir.
Öğretici Örnek:
- Aşağıdaki atom ve iyonlar dubletini tamamlamıştır:
- 2He2 )2e– (dubletini tamamlamış)
- 3Li+2 )2e– (dubletini tamamlamış)
- 1H–2 )2e– (dubletini tamamlamış)
- Aşağıdaki atom ve iyonlar, oktetini tamamlamıştır:
- 20Ca182+ )2e– )8e– )8e– (oktetini tamamlamış)
- 10Ne10 )2e– )8e– (oktetini tamamlamış)
- 17Cl18-1 )2e– )8e– )8e– (oktetini tamamlamış)
İyonik Bağ
- İyonik bağ ile iyonik bağlı bileşikler oluşur.
- İyonik bağın kuruluşu ve iyonik bağlı bileşiğin oluşumu şöyle gerçekleşir:
- İyonik bağ her zaman, bir metal atomu ile bir ametal atomu arasında kurulur.
- Metal atomlarının son yörüngesinde genellikle 1, 2 veya 3 elektron vardır.
- Ametal atomlarının son yörüngesinde, genellikle 5, 6 ve 7 elektron vardır.
- İyonik bağ kurulurken atomlar elektron alış-verişi yapar.
- Metal atomu, son yörüngesindeki bütün elektronları ametal atomuna verir ve kararlı bir katyona dönüşür.
- Ametal atomu, son yörüngesini tamamen dolduracak kadar elektron alır ve kararlı bir anyona dönüşür.
- Oluşan katyon ve anyonun yükleri çaprazlanarak, iyonik bağlı bileşiğin formülü bulunur.
- İyonik bağ her zaman, bir metal atomu ile bir ametal atomu arasında kurulur.
Bohr Atom Modeli İle İyonik Bağın Gösterimi
- Metal ve ametal atomlarını yörüngeleri ile çizerek, alınan ve verilen elektron sayısını gösterebiliriz.
- Böylede iyonik bir bağı da göstermiş oluruz.
- Bu gösterime Bohr Atom Modeli ile gösterim denir.
Aşağıda 11Na ve 17Cl atomunun iyonik bağ kurarak NaCl bileşiğini nasıl oluşturduğu gösterilmiştir:

- Aşağıda, Na (Sodyum) metali ve Klor (Cl) ametali arasında kurulan iyonik bağın simülasyonu verilmiştir:
Lewis Nokta Yapısı ile İyonik Bağın Oluşumu
- İster iyonik bağ olsun ister kovalent bağ olsun, atomların son yörüngesindeki elektronlar ile kurulur.
- Lewis nokta yapısındaki elektronlar da zaten son yörüngedeki elektronlardır.
- Bu yüzden iyonik ve kovalent bağları Lewis Yapıları ile göstermek daha pratiktir.
Öğretici Örnek:
Lewis nokta yapısı ile İyonik bağın kurulumunu ve iyonik bir bileşiğin oluşumunu 11Na ve 17Cl örneği atomlarını bağlayarak gösterelim.
- Bağlayacağımız atomların türüne karar veriyoruz: Na ile Cl atomlarının, metal mi ametal mi olduğunu ezberden bilemiyorsak şöyle anlayabiliriz:
- Na atomunun proton sayısı 11’dir.
- Na atomunun, elektron dağılımı şöyledir:
11Na11 )2e– )8e– )1e– - Değerlik elektron sayısı 1 olduğu için Na atomu bir metaldir.
- Na atomunun, elektron dağılımı şöyledir:
- Cl atomunun proton sayısı 17’dir.
- Cl atomunun elektron dağılımı şöyledir:
17Cl17 )2e– )8e– )7e– (temel haldeki Na atomu) - Değerlik elektron sayısı 7 olduğu için Cl atomu bir ametaldir.
- Cl atomunun elektron dağılımı şöyledir:
- Na atomunun proton sayısı 11’dir.
- Bağın türüne karar veriyoruz: Elimizde bir metal bir de ametal atomu varsa bir iyonik bağ kuracağız demektir.
- Şimdi bu iki atomun Lewis yapılarını gösterelim:
- Na atomunun Lewis yapısı şöyledir:

- Cl atomunun Lewis yapısı da şöyledir:

- Na atomunun Lewis yapısı şöyledir:
- Sıra elektron alış-verişinde. İyonik bağda elektron alış-verişi her zaman şöyle olur:
- Metal son yörüngesindeki bütün elektronları verir, Lewis yapısı boş kalır.
- Na metalinin son yörüngesinde 1 tane elektron olduğundan, bu elektron gidince atom, bileşiğinde +1 yüklü bir iyona dönüşecektir:
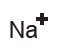
- Na metalinin son yörüngesinde 1 tane elektron olduğundan, bu elektron gidince atom, bileşiğinde +1 yüklü bir iyona dönüşecektir:
- Ametal son yörüngesini 8’e tamamlar ve Lewis yapısı fullenir, 8 nokta olur.
- Cl atomu, 7 elektronunu 8 yapmak için 1 elektron alacak ve -1 yüklenecektir:
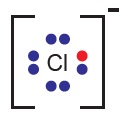
- Cl atomu, 7 elektronunu 8 yapmak için 1 elektron alacak ve -1 yüklenecektir:
- Artık, Na+ ve Cl– iyonları, iyonik bağ ile birleştiler. Bu yüzden bu iki iyonu, ayrı ayrı göstermek doğru olmaz. Bu iki iyonun Lewis yapılarını yan yana yazarsak, NaCl bileşiğinin Lewis Nokta Yapısını göstermiş oluruz:

- Metal son yörüngesindeki bütün elektronları verir, Lewis yapısı boş kalır.
- Gelin şimdi, en başından en sonuna kadar, NaCl bileşiğini oluşumuna ait anlattığımız her şeyi, bir tepkime denkleminde özetleyelim:

Çaprazlama Yöntemi ile Bileşik Formülü Bulma
- Verilen elektron sayısı ile alınan elektron sayısı eşit olmazsa, bileşiğin formülünü bulmak için çaprazlama işlemi yaparız.
- Çaprazlama yöntemi, bir iyonik bağlı bileşiğin formülünü bulmanın en kolay yoludur.
- Çaprazlama yönteminde tek ihtiyacımız olan şey, bileşik kuracak iyonların yükleridir.
- Yüklerini biliyorsak basit bir çaprazlama işlemi ile formülü anında bulabiliriz.
- Çaprazlama işleminde şu kurallara uyulur:
- Önce artı yüklü iyon sonra eksi yüklü olacak şekilde iki iyon yan yana yazılır.
- Sonra bu iki iyonun yükleri, karşılıklı olarak birbirinin sağ alt köşesine gönderilir.
- Eğer çaprazlanan sayılar sadeleşebiliyorsa sadeleştirilir.
- Sayısı 1 olan atomların altına 1 yazmak gereksizdir.
- Mesela; NaCl bileşiğinde bir tane Na bir tane de Cl vardır. Bileşiğin formülünü Na1Cl1 şeklinde yazmak gereksizdir.
Örnek:
Mesela, Al+3 ile O-2 iyonlarının bileşiği aşağıdakilerden hangisidir?
A) Al2O
B) AlO3
C) AlO
D) Al3O2
E) Al2O3
Cevap
Örneğin çözümü:
Örnek:
Pb4+ ve O2- iyonları ile aşağıdaki bileşiklerden hangisine aittir?
A) PbO2
B) Pb2O4
C) Pb2O
D) PbO
E) Pb4O2
Cevap
Örneğin çözümü:
Örnek:
Ca2+ ve Sn4+ iyonları arasında kurulacak bileşiğin formülü aşağıdakilerden hangisi olmalıdır?
A) CaSn2
B) Ca2Sn4
C) CaSn4
D) Ca2Sn
E) Bileşik oluşmaz.
Cevap
Örneğin çözümü:
Öğretici Örnek:
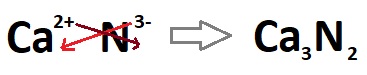
20Ca (Kalsiyum) ve 7N (Azot) arasında kurulacak bileşiğin formülünü bulalım:
- Önce, atomların, bileşik kurmadan önce (temel halde iken) son yörüngelerine bir göz atmamız gerekiyor. Bunun için, ikisinin de elektron dağılımlarını yapmalıyız:
- 20Ca20 )2e– )8e– )8e– )2e– (Temel hal)
- Temel haline baktığımızda, Ca atomunun son yörüngesinde 2 elektron görüyoruz.
- Bu da demek oluyor ki; bu atom, 2A grubunda yaşayan bir metal atomudur
- İyonik bağ yaparken 2 elektron verir ve böylece oktetini tamamlar.
- 2 elektron vereceği için Ca, bileşiğinde +2 yüklü olacak demektir.
- 7N7 )2e– )5e– (Temel hal)
- Temel haline baktığımızda, N atomunun son yörüngesinde 5 elektron görüyoruz.
- Bu da demek oluyor ki; bu atom, 5A grubunda yaşayan bir ametal atomudur.
- İyonik bağ yaparken 3 elektron alır ve son yörüngesini 8 yapar; böylece oktetini tamamlar.
- 3 elektron alacağı için N, bileşiğinde -3 yüklü olacak demektir.
- 20Ca20 )2e– )8e– )8e– )2e– (Temel hal)
- Sonuçta anladık ki, atomlardan biri metal, diğeri ametaldir.
- O zaman kurulacak bileşik iyonik bir bileşiktir ve yükler çaprazlanarak bileşiğin formülü bulunabilir.
- Yine anladık ki; bu bileşikte, Ca2+ yüklü, N3- yüklü olmalıdır.
- O zaman bu iyonların oluşturacağı bileşiğin formülü (Ca3N2), çaprazlama ile basitçe bulunabilir:
Örnek:
11Na (Sodyum) ile 16S (Kükürt) arasında kurulacak bileşiğin formülünü ve bu bileşiğin Lewis Nokta Yapısını gösteriniz.
Cevap
Örneğin çözümü:
MERAKLISINA
Yukarıda, çaprazlama ile bulduğumuz Na2S formülünü, Lewis yapıları ile de bulamak istersek, aşağıdaki tepkimeyi yazmamız yeterli olacaktır:

İyonik Bileşiklerin Genel Özellikleri
- İyonik bileşikler, iyonik bağ ile oluşur.
- İyonik bileşikler, metal ile ametal elementlerinin iyonik bağ kurması ile oluşur.
- İyonik bağ en sağlam kimyasal bağdır. Bu yüzden iyonik bileşiklerin erime ve kaynama noktaların yüksektir.
- İyonik bağ, en sağlam kimyasal bağ olduğu için, iyonik bileşikler tabiatta katı halde bulunurlar.
- İyonik bileşikler, suda iyonlarına ayrışarak çözünürler. Bu yüzden iyonik bileşiklerin sulu çözeltileri elektrik akımını iletir yani elektrolit çözeltilerdir.
- İyonik bileşikler katı halde iken, kristallerden meydana gelirler. Kristaller, atom ya da iyonların düzgün bir şekilde istiflenmesiyle oluşur.

İyonik Bağlı Bileşiklerin Sistematik Adlandırılması
- İyonik bileşiklerin sistematik adlandırılması demek, bütün dünyada kabul edilen ve her kimyacının bildiği, bilimsel adlandırmalar demektir.
- İyonik bileşiklerin formüllerinde, önce bir katyon sonra da bir anyon vardır.
- Katyon ve anyonun yükü, çaprazlama ile birbirinin altına inmiştir ve görünmez. Aşağıda, bu duruma bazı örnekler verilmiştir. Mesela:
- NaCl bileşiği:
- Na+ ve Cl– iyonlarından oluşmuştur.
- CaCl2 bileşiği:
- Ca2+ ve Cl– iyonlarından oluşmuştur.
- PbO bileşiği:
- Pb2+ ve O2- iyonlarından oluşur.
- PbO2 bileşiği:
- Pb4+ ve O2- iyonlarından oluşur.
- NaCl bileşiği:
- İyonik bileşiklerin adını söyleyebilmek için, katyon ve anyonların adını bilmek gerekir.
Katyonlar
- Katyonlar “+” yüklü iyonlardır.
- Katyonlar, genellikle, bileşik formüllerinin başında bulunur.
- Katyonların isimleri genellikle nötür atomu ile aynıdır.
Aşağıda, iyonik bileşiklerde karşımıza çıkabilecek katyonlar ve isimleri verilmiştir:
+1 ve +2 Yüklü İyonlar
| Katyon | Adı | Katyon | Adı |
|---|---|---|---|
| H+ | Hidrojen | Be2+ | Berilyum |
| Li+ | Lityum | Mg2+ | Magnezyum |
| Na+ | Sodyum | Ca2+ | Kalsiyum |
| K+ | Potasyum | Ba2+ | Baryum |
| Hg+ | Cıva(I) | Hg2+ | Cıva(II) |
| Cu+ | Bakır(I) | Cu2+ | Bakır(II) |
| Ag+ | Gümüş | Fe2+ | Demir(II) |
| NH4+ | Amonyum | Pb2+ | Kurşun(II) |
| H3O+ | Hidronyum | Sn2+ | Kalay(II) |
| Co2+ | Kobalt(II) |
+3 ve +4 Yüklü İyonlar
| Katyon | Adı | Katyon | Adı |
|---|---|---|---|
| Al3+ | Alüminyum | Pb4+ | Kurşun(IV) |
| Fe3+ | Demir(III) | Sn4+ | Kalay(IV) |
| Co3+ | Kobalt(III) |
DİKKAT:
Bazı metallerin isminin sonunda yükü de söylenir:
Fe2+ : Demir (II)
Fe3+ : Demir (III)
Bu metaller, bileşiklerinde birden fazla yük alabilen metallerdir. Bu yüzden, metalin o bileşikte hangi yükte olduğunu belirtmek için, ismi ve yükü birlikte söylenir.
Böyle metallerin, bileşikteki yükünü görmek için, çaprazlama ile karşıya gönderdiği sayıya dikkat etmemiz gerekir:
FeCl2 bileşiğindeki demir : Fe2+ (Demir-II-)
FeCl3 bileşiğindeki demir : Fe3+ (Demir-III-)
PbO bileşiğindeki kurşun : Pb2+ (Kurşun-II-)
PbO2 bileşiğindeki kurşun : Pb4+ (Kurşun-IV-)
Anyonlar
- Anyonlar “-” yüklü iyonlardır.
- Anyonlar, genellikle bileşik formüllerinin sonunda bulunur.
- Anyonların isimleri genellikle nötür atomlarından farklıdır.
- Ametaller, anyon olarak okunurken genellikle isimlerinin sonuna “-ür” eki alırlar:
- F–: Florür
- Cl–: Klorür
- Br–: Bromür
- I–: İyodür
- O2-: Oksit
- S2-: Sülfür
- N3-: Nitrür
- P3-: Fosfür
- C4-: Karbür
- Ametaller, anyon olarak okunurken genellikle isimlerinin sonuna “-ür” eki alırlar:
Aşağıda, iyonik bileşiklerde karşımıza çıkabilecek anyonlar ve isimleri verilmiştir:
-1 ve -2 Yüklü İyonlar
| Anyon | Adı | Anyon | Adı |
|---|---|---|---|
| H– | Hidrür | O2- | Oksit |
| F– | Florür | S2- | Sülfür |
| Cl– | Klorür | CO32- | Karbonat |
| Br– | Bromür | SO42- | Sülfat |
| I– | İyodür | SO32- | Sülfit |
| OH– | Hidroksit (Hidroksil) | MnO42- | Manganat |
| CN– | Siyanür | ||
| NO3– | Nitrat | ||
| CH3COO– | Asetat | ||
| MnO4– | Permanganat | ||
| HCO3– | Bikarbonat | ||
| HSO4– | Bisülfat | ||
| HSO3– | Bisülfit |
-3 ve -4 Yüklü İyonlar
| Anyon | Adı | Anyon | Adı |
|---|---|---|---|
| N3- | Nitrür | C4- | Karbür |
| P3- | Fosfür | ||
| PO43- | Fosfat |
İyonik Bileşiklerin Sistematik Adları
- İyonik bileşikleri okurken, yapmamız gereken tek şey:
- bileşikte gördüğümüz katyon ve anyonları sırayla okumaktır.
- Bu yüzden öncelikle, biraz ezber yaparak, iyonik bileşiklerde karşımıza çıkabilecek anyon ve katyonları öğrenmemiz gerekiyor.
Aşağıda, iyonik bağılı bazı bileşiklerin sistematik adları verilmiştir:
- NaCl : Sodyum klorür
- NaNO3 : Sodyum nitrat
- PbO : Kurşun(II) oksit
- NH4NO3 : Amonyum nitrat
- CaCO3 : Kalsiyum karbonat
- MgH2 : Magnezyum hidrür
- Hg2O : Cıva(I) oksit
- BaSO4 : Baryum sülfat
- Ca(OH)2 : Kalsiyum hidroksit
- Al4C3 : Alüminyum karbür
- Ca(NO3)2 : Kalsiyum nitrat
- Ba3(PO4)2 : Baryum fosfat
- PbI2 : Kurşun(II) iyodür
- Fe2(SO4)3 : Demir(III) sülfat
- FeSO4 : Demir(II) sülfat
Kovalent Bağ
- Güçlü etkileşimlerin ikincisi kovalent bağdır.
- Kovalent bağ, ametaller arasında kurulur.
- Ametal atomları son yörüngelerinde genellikle; 5, 6 veya 7 tane elektron bulundururlar.
- İki ametal atomu birer elektronunu ortaklaşa kullanınca, 1 kovalent bağ kurulmuş olur.
- Her kovalent bağ, 2 elektronun ortaklaşa kullanılması ile oluşur.
- 2 elektron 1 çizgi olarak gösterilebildiği için, kovalent bağlar, atomların arasında ve birer kısa çizgi olarak gösterilir.
- Ametal atomlarının, kovalent bağ kurmak için, ortaklaşa kullandıkları elektronlar, son yörüngelerindeki elektronlardır.
- Kovalent bağ kurarken, ametal atomları, karşılıklı olarak birer elektronunu ortaklaşa kullanırlar.
- Bir ametal atomu, son yörüngesini fullemek için (8 elektron olması için) kaç tane elektrona ihtiyaç duyuyorsa o kadar sayıda elektronunu ortaklaşa kullanır ve kovalent bağ kurar.
(Hidrojen bu kuralın istisnasıdır. Hidrojen atomu 1 tane kovalent bağ kurar.)
- Bir ametal atomu, son yörüngesini fullemek için (8 elektron olması için) kaç tane elektrona ihtiyaç duyuyorsa o kadar sayıda elektronunu ortaklaşa kullanır ve kovalent bağ kurar.
- Kovalent bağ ile birbirine bağlanmış atom topluluğuna molekül denir.
- Aynı atomlar kovalent bağ kurarsa element molekülü, farklı atomlar kovalent bağ kurarsa bileşik molekülü oluşur.
Örnek:
I) H2
II) H2O
III) CO2
IV) Cl2
V) O3
VI) NH3
Yukarıda verilen molekülleri element ve bileşik molekülü olarak sınıflandırınız.
Cevap
Bohr Atom Modeli İle Kovalent Bağ Gösterimi
- Bohr Atom Modeline ile kovalent bağı gösterirken şu kurallara uyulur:
- Atomlar yörüngeleri ile çizilirler,
- Atomların son yörüngeleri kesiştirilir.
- Kesişim bölgelerine ortaklaşa kullanılan elektronlar konulur.
Aşağıda bazı kovalent bağların oluşumu gösterilmiştir:

Kovalent bağ ile su molekülünün oluşumu:
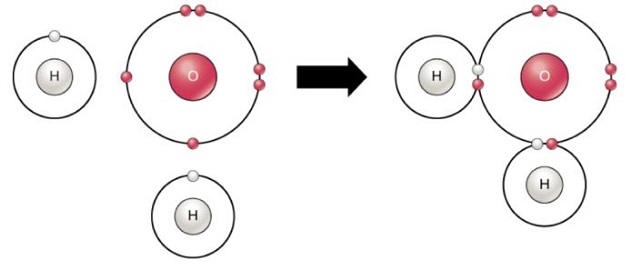
Kovalent bağ ile O2 molekülünün oluşumu:

Lewis Elektron Nokta Yapısı İle Kovalent Bağ Gösterimi
- Ametal atomları, Lewis Yapılarındaki yalnız elektronları kadar kovalent bağ kurmak ister.
- Lewis Elektron Nokta Yapısı ile kovalent bağ kurarken, yapmamız gereken tek şey, yalnız elektronları karşılıklı olarak eşleştirmektir. (Kimse yalnız kalmasın.)
- İki atom, birer yalnız elektronunu ortaya koyar ve 1 adet kovalent bağ kurulmuş olur.
- Her kovalent bağ, bir çift elektron demektir.
- Her kovalent bağ bir çizgi ile gösterilebilir.
Öğretici Örnek:
Gelin 1H ve 17Cl atomlarının nasıl bağlandığını Lewis yapıları ile aşama aşama gösterelim.
- Bağlayacağımız atomların türüne karar veriyoruz: H ile Cl atomlarının, metal mi ametal mi olduğunu ezberden bilemiyorsak şöyle anlayabiliriz:
- H atomunun proton sayısı 1’dir.
- H atomunun, elektron dağılımı şöyledir:
1H1 )1e– - H atomu bir metaldir. (H değerlik elektron sayısı 1 olan tek ametaldir.)
- H atomunun, elektron dağılımı şöyledir:
- Cl atomunun proton sayısı 17’dir.
- Cl atomunun elektron dağılımı şöyledir:
17Cl17 )2e– )8e– )7e– (temel haldeki Na atomu) - Değerlik elektron sayısı 7 olduğu için Cl atomu bir ametaldir.
- Cl atomunun elektron dağılımı şöyledir:
- H atomunun proton sayısı 1’dir.
- Bağın türüne karar veriyoruz: Elimizde iki tane ametal atomu varsa bir kovalent bağ kuracağız demektir.
- Şimdi bu iki atomun Lewis yapılarını gösterelim:
- H atomunun Lewis yapısı şöyledir:

- Cl atomunun Lewis yapısı da şöyledir:

- H atomunun Lewis yapısı şöyledir:
- Sıra elektron ortaklaşmasında. Kovalent bağda yalnız elektronlar karşılıklı olarak eşleştirilir:
- Cl atomunun, 1 tane yalnız noktası vardır ve kovalent bağ kurarken bu elektronu paylaşır.
- H atomunun da 1 tane yalnız noktası vardır ve kovalent bağ kurarken bu elektronu paylaşır.
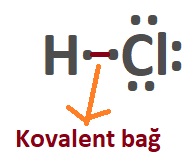
- Aynı molekülü şöyle de gösterebiliriz:
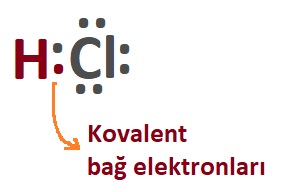
- Hidrojen ve Klor atomlarının, kovalent bağ kurarak HCl molekülünü oluşturması olayını, şöyle bir tepkime denklemi ile de gösterebiliriz:

- Yukarıda verilen tepkime, şu şekilde de yazılabilir:

Örnek:
Cl2 molekülünün Lewis Elektron Nokta Yapısını gösteriniz. (17Cl)
Cevap
Örneğin çözümü:
Örnek:
H2O molekülünün Lewis Elektron Nokta Yapısını gösteriniz. (1H, 8O)
Cevap
Örneğin çözümü:
Örnek:
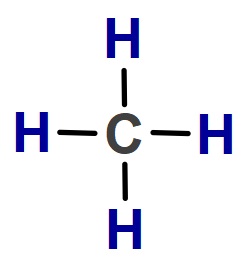
CH4 molekülünün Lewis Elektron Nokta Yapısını gösteriniz. (1H, 6C)
Cevap
Örneğin çözümü:
Örnek:
CH4 molekülünün atomlarından oluşumunu gösteren tepkime denklemini Lewis Elektron Nokta Yapısını ile gösteriniz. (1H, 6C)
Cevap
Örneğin çözümü:
Örnek:
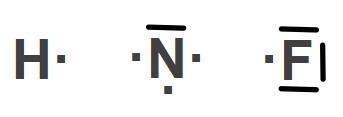
Yukarıda Hidrojen (H), Azot (N) ve Flor (F) atomlarının temel hallerine ait Lewis Elektron Nokta Yapıları verilmiştir.
Buna göre H2, N2 ve F2 moleküllerinin Lewis Yapılarını gösteriniz.
Cevap
Örneğin çözümü:
Örnek:
O2 (Oksijen) molekülünün Lewis Elektron Nokta Yapısını gösteriniz. (8O)
Cevap
Örneğin çözümü:
Örnek:

Yukarıda, NH3 (Amonyak) molekülünün Lewis Elektron Nokta Yapısı verilmiştir.
Bu yapıya bakarak, Azot (N) atomunun temel haline ait Lewis yapısını ve grup numarasını bulunuz.
Cevap
Örneğin çözümü:
Örnek:
CO2 (Karbon dioksit) molekülünün, Lewis Elektron Nokta Yapısını gösteriniz. (6C, 8O)
Cevap
Örneğin çözümü:
Tekli, İkili ve Üçlü Kovalent Bağlar
- İki ametal atomu arasında, karşılıklı birer elektron paylaşımı ile 1 tane kovalent bağ kurulursa, tekli kovalent bağ oluşur.
- Aşağıda, H2 molekülünde bulunan tekli kovalent bağı görüyorsunuz:

- İki ametal atomu arasında, karşılıklı ikişer elektron paylaşımı ile 2 tane kovalent bağ kurulursa, ikili kovalent bağ oluşur.
- Aşağıda, O2 molekülünde bulunan ikili kovalent bağı görüyorsunuz:

- İki ametal atomu arasında, karşılıklı üçer elektron paylaşımı ile 3 tane kovalent bağ kurulursa, üçlü kovalent bağ oluşur.
- Aşağıda, N2 molekülünde bulunan üçlü kovalent bağı görüyorsunuz:
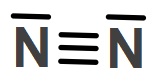
İkili ve üçlü kovalent bağlara çoklu kovalent bağ da denir.
Öğretici Örnek:
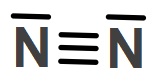
Yukarıda Lewis formülü verilen N2 molekülü için, şu bilgiler doğrudur:
- Ortaklanmış (kovalent bağ kurmuş) elektron çifti sayısı: 3
- Ortaklanmamış elektron çifti sayısı: 2
- Ortaklanmış elektron sayısı: 6
- Ortaklanmamış elektron sayısı: 4
Polar – Apolar Kovalent Bağ
- Polar kelimesi, “kutuplu” demektir.
- Polar kovalent bağlar, tıpkı bir mıknatıs gibi kutupları olan bağlardır.
- Apolar kelimesi “kutupsuz” demektir.
- Apolar kovalent bağlar, kutupları olmayan bağlardır.
Apolar Kovalent Bağ
- Aynı atomlar arasında kurulan kovalent bağlar apolar kovalent bağlardır.


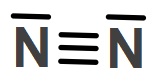
- Yukarıda verilen moleküllerde, aynı atomlar arasında kurulduğu için kovalent bağların hepsi apolardır.
Polar Kovalent Bağ
- Farklı atomlar arasında kurulan kovalent bağlar polar kovalent bağlardır.
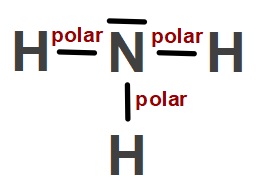


- Yukarıda gösterilen kovalent bağlara dikkat edersek, hepsinde, kovalent bağın iki tarafında farklı ametal atomları vardır.
- Bu yüzden, bu kovalent bağların hepsi polar kovalent bağlardır.
Örnek:
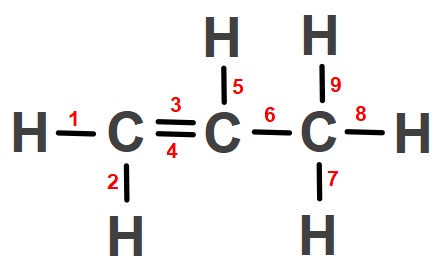
Yukarıda verilen molekülde, kovalent bağlar numaralar ile etiketlenmiştir.
Buna göre bu kovalent bağları polar ve apolar olarak sınıflandırınız.
Cevap
Örneğin çözümü:
Örnek:
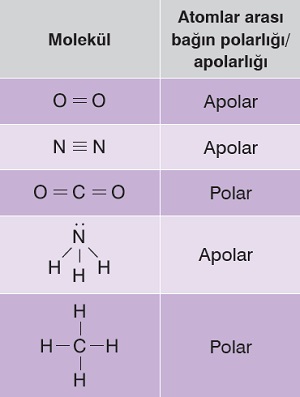
Şevket, kimya dersinde, performans ödevi olarak yukarıdaki tabloyu hazırlamıştır. Öğretmeni, tabloda bir molekülün “Atomlar arası bağın polarlığı/apolarlığı” bilgisinin yanlış olduğunu söylemiştir.
Buna göre öğretmenin bahsettiği hata hangi moleküldedir?
A) O2
B) N2
C) CO2
D) NH3
E) CH4
Cevap
Örneğin çözümü:
Kovalent Bağlı Bileşiklerin Sistematik Adlandırılması
- Kovalent bağlı bileşikler adlandırılırken, bileşik formülündeki sayılar da söylenir.
- Fakat bu sayılar Türkçe değil Latince söylenir.
- Kovalent bağlı bileşikleri adlandırabilmek için, Latince 10’a kadar bilmek gerekir. Bu sayılar aşağıda verilmiştir.
1: Mono
2: Di
3: Tri
4: Tetra
5: Penta
6: Hekza
7: Hepta
8: Okta
9: Nona
10: Deka
- Ametallerin, bileşiğin başında ve sonunda iken isimleri farklıdır:
- Bileşiğin başında iken ametaller, bildiğimiz isimleri ile adlandırılır.
- Bileşiğin sonunda iken isimlerine genellikle “-ür” eki eklenir. Aşağıda, ametallerin bileşiğin sonunda iken isimleri verilmiştir:
H: Hidrür
C: Karbür
N: Nitrür
O: Oksit
F: Florür
Cl: Klorür
Br: Bromür
I: İyodür
Se: Selenür
P: Forfür
S: Sülfür
- Kovalent bileşiğin ismini söylerken;
- önce ametalin adı söylenir,
- sonra Latince olarak sayısı söylenir.
- Bileşikteki ilk ametalin sayısı 1 ise, bu sayı söylenmez, sadece ametalin adı söylenir.
Öğretici Örnek:
Aşağıda, bazı kovalent bağlı bileşiklerin formülleri ve sistematik isimleri verilmiştir:
H2O : Dihidrojen monooksit
N2O5 : Diazot pentaoksit
NF3 : Azot triflorür
CO2 : Karbon dioksit
CO : Karbon monooksit
SO2 : Kükürt dioksit
CCl4 : Karbon tetraklorür
CF4 : Karbon tetraflorür
PCl3 : Fosfor triklorür
Örnek:
I. N2O4
II. SF6
III. P4S3
IV. PCl5
V. H2S
Serkan’ın kimya sınavında, yukarıdaki bileşiklerin sistematik adı sorulmuştur. Soruda, her bir bileşiğin doğru adı 3 puan değerindedir. Serkan, bu soruyu aşağıdaki gibi cevaplandırarak 12 puan almıştır.
Buna göre, öğretmeni Serkan’ın hangi cevabından puan kırmıştır?
A) N2O4 : Diazot tetraoksit
B) SF6 : Kükürt hekzaflorür
C) P4S3 : Tetrafosfor trisülfür
D) PCl5 : Fosfor pentaklorür
E) H2S : Dihidrojen monokükürt
Cevap
Örneğin çözümü:
III. Metalik Bağ
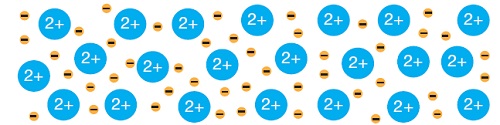
- Güçlü etkileşimlerden üçüncüsü ve sonuncusu metalik bağdır.
- Metalik bağ; güçlü olmasına rağmen bir kimyasal bağ değildir.
- Metallerin, değerlik elektronları, çok zayıf bağlıdır.
- Hatta, bazen atomlarını terk edip komşu atomun son yörüngesine bile geçebilirler, veya
- atomlarını terk edip ortalıkta boş boş dolanabilirler.
- Bu yüzden, bu başıboş değerlik elektronları, metal atomları arasında bir elektron denizi oluştururlar.
- Elektron denizinde, atomlarını terk eden elektronlar, atomların katyon haline geçmesine sebep olur.
- Bu elektron denizi, metal atomları arasında, güçlü bir bağ kurulmasına sebep olur.
- İşte bu şekilde kurulan bağa metalik bağ denir.
- Değerlik elektron sayısı arttıkça, genellikle, metalik bağın kuvveti artar.
- Metalik bağ sayesinde, metaller şu özellikleri taşırlar:
- Isı ve elektriği iletirler.
- Yüzeyleri parlaktır.
- Tel ve levha hâline getirilebilirler.
- Esnektirler, dövülebilir ve şekillendirilebilirler.
Örnek:
Muzaffer hoca sınıfa: “Metalik bağ ile ilgili olarak 5 tane cümle kuracağım fakat bir tanesi yanlış olacak. Yanlışı bulan öğrenciye, sıfır bir iPhone 12 hediye edeceğim” demiştir.
Muzaffer hoca, bunu dedikten sonra aşağıdaki cümleleri kurmuş ve ödülü de Yağmur almıştır.
Buna göre Yağmur hangi cümlenin yanlış olduğunu söylemiştir?
A) Metal atomları arasında oluşan güçlü bir bağdır.
B) Etkileşimler, katyonlar ve anyonlar arasında kurulur.
C) Metalik bağ sayesinde, metallerin yüzeyi parlaktır.
D) Bağın sebebi serbest hareket eden değerlik elektronlarıdır.
E) Değerlik elektronlarının sayısı arttıkça metalik bağ kuvveti artar.



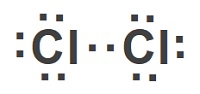

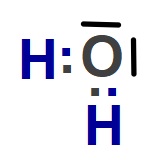




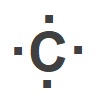
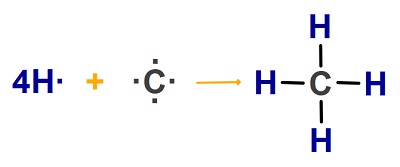
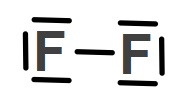
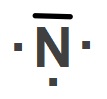

Ömer says:
Metalik bağ kimyasal bir bağ değildir yazıyor , araştırdım biraz çoğu kaynak kimyasal bir bağdır diyor
Gökalp AY says:
Kimyasal bağlar kimyasal olaylarda oluşur ya da kopar. Metalik bağ kimyasal bir bağ olsaydı, metallerin kaynaması ya da erimesi kimyasal olay olurdu. Çünkü metaller hal değiştirirken metalik bağlar kopar ya da oluşur. Hal değişim olayları fiziksel ise metalik bağ fiziksel bir bağdır.