İçindekiler
- Alkanlar (Parafinler – Mumlar)
- IUPAC Adlandırma Sistemi
- Alkenler (Olefinler)
- Alkenlerin Adlandırılması
- Alkenlerde Cis-Trans İzomeri
- Alkenlerin Fiziksel Özellikleri
- Alkenlerin Eldesi
- Alkenlerin Kimyasal Tepkimeleri
- I. Alkenlerin Yanma Tepkimeleri
- II. Alkenlere H2 Katılması
- Öğretici Örnek:
- III. Alkenlere Halojen (X2) Katılması
- IV. Alkenlere Hidrojen Halojenür (HX) Katılması
- Öğretici Örnek:
- Öğretici Örnek:
- V. Alkenlere H2O Katılması
- Öğretici Örnek:
- Öğretici Örnek:
- VI. Alkenlerin KMnO4 ile Tepkimeleri
- VII. Alkenlerin Polimerleşme Tepkimeleri
- Öğretici Örnek:
- Öğretici Örnek:
- Öğretici Örnek:
- Alkenlerin Kullanım Alanları
- Alkenil Grupları
- Alkinler (Asetilenler)
- Aromatik Bileşikler
- Bazı Aromatik Bileşikler ve Kullanım Alanları
- Hidrokarbonlar; sadece hidrojen (H) ve karbon (C) elementinden oluşan bileşiklerdir.
- Aşağıda, hidrokarbon bileşiklerinden bazı örnekler verilmiştir:
- CH4 (Metan)
- C2H2 (Asetilen)
- C2H4 (Etilen)
- C2H6 (Etan)
- C6H6 (Benzen)
- …
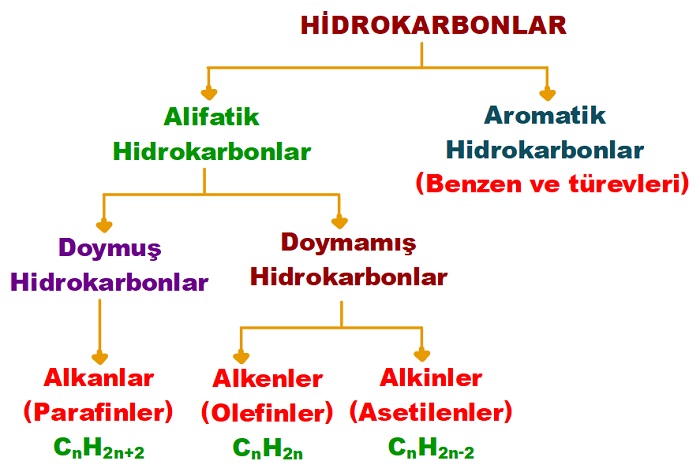
Hidrokarbonlar; aşağıda verilen şemada görüldüğü gibi sınıflandırılır.
Alkanlar (Parafinler – Mumlar)
- Alkanlar, alifatik hidrokarbonlardır.
- Alifatik hidrokarbon demek, aromatik olmayan hidrokarbon demektir, yani; alifatik hidrokarbonlar, benzen bileşiği içermeyen hidrokarbonlardır.
- Alakanlar; doymuş hidrokarbonlardır.
- Doymuş hidrokarbon demek, C atomları pi bağı kurmayan hidrokarbonlar demektir.
- Doymuş hidrokarbonlarda, bütün karbon atomları 4 tane sigma bağı kurar.
- Alkan moleküllerindeki bütün C atomları, sp3 hibritleşmesi yapmıştır.
- Alkan moleküllerindeki her bir C atomu, düzgün dörtyüzlü şeklinde bağlar kurmuştur.
- Alkanların genel formülü; CnH2n+2‘dir. Yani; alkan bileşiklerinde, H sayısı C sayısının 2 katından 2 fazladır.
İlk 10 Alkan
- Alkanların sistematik adı “-an” son eki ile biter.
- İlk dört alkan hariç diğer alkanların isimleri, Latince sayılardan türer.
- Latince sayılar şöyledir:
- 1: Mono
- 2: Di
- 3: Tri
- 4: Tetra
- 5: Penta
- 6: Hekza
- 7: Hepta
- 8: Okta
- 9: Nona
- 10: Deka
- Aşağıda ilk 10 alkanın sırasıyla formülü ve adı verilmiştir:
| Molekül Formülü (CnH2n+2) | Adı |
|---|---|
| CH4 | Metan |
| C2H6 | Etan |
| C3H8 | Propan |
| C4H10 | Bütan |
| C5H12 | Pentan |
| C6H14 | Hekzan |
| C7H16 | Heptan |
| C8H18 | Oktan |
| C9H20 | Nonan |
| C10H22 | Dekan |
Siklo Alkanlar
- Karbon atomları, kapalı bir geometrik şekil oluşturacak şekilde dizilmiş ise, böyle bileşiklere halkalı bileşikler denir.
- Halkalı bir bileşik, halkasız isminin önüne “siklo” öneki eklenerek adlandırılır.
- Bir bileşiğin halkalı formülü, halkasız/düz zincirli formülünden 2 tane H atomu eksiktir.
- En küçük siklo bileşik, 3 karbonludur.
- En küçük siklo alkan, 3 karbonlu bir alkan olan propanın halkalı şeklidir ve siklopropan olarak adlandırılır.

- Alkanların genel formülü CnH2n+2‘dir; siklo alkanların genel formülü CnH2n‘dir.
Aşağıda sırasıyla; 4 karbonlu, 5 karbonlu ve 6 karbonlu halkalı alkanlar verilmiştir:

Homolog Seri
- Peş peşe gelen iki molekülü arasındaki fark hep aynı ise, böyle bileşik aileleri homolog seri oluşturur.
- Peş peşe gelen iki alkan bileşiği arasında, -CH2– kadar fark vardır. Bu yüzden alkan bileşikleri, homolog seri oluşturur.
- Aşağıda, 3 karbonlu ve 4 karbonlu iki alkanın yarı açık formülleri verilmiştir:
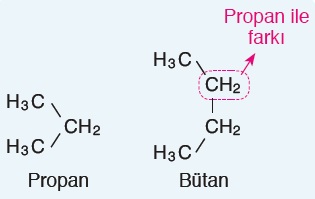
- Aşağıda, 3 karbonlu ve 4 karbonlu iki alkanın yarı açık formülleri verilmiştir:
Alkil Grupları (R-)
- Bir hidrokarbon bileşiğinden bir tane H atomu koparsa, bir alkil grubu oluşur.
- Alkil grupları, genel olarak “R-” ifadesi ile gösterilir.
- Alkil grubunun adı, “-il” son eki ile biter.
- Alkil grubu, hangi bileşikten oluştu ise, o bileşiğin son eki “-il” eki ile değiştirilir ve alkil grubunun adı elde edilir.
Aşağıda, alkan bileşiklerinden elde edilen bazı alkil grupları verilmiştir. Alkandan kopan hidrojen kırmızı renk ile belirtilmiştir.

Primer – Sekonder – Tersiyer Karbon Atomları
- Primer: Birincil veya 1o demektir.
- Sekonder: İkincil veya 2o demektir. “sec-” şeklinde kısaltılır.
- Tersiyer: Üçüncül veya 3o demektir. “ter-” şeklinde kısaltılır.
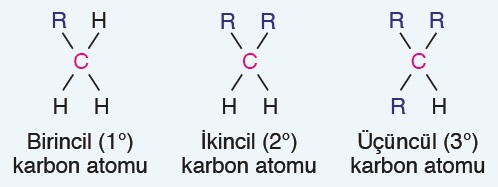
- Primer C atomu: 1 tane C atomuna bağlı olan C atomlarına primer C atomu denir.
- Sekonder C atomu: 2 tane C atomuna bağlı olan C atomlarına sekonder C atomu denir.
- Tersiyer C atomu: 3 tane C atomuna bağlı olan C atomlarına tersiyer C atomu denir.
Aşağıda; primer, sekonder ve tersiyer C atomları gösterilmiştir:
Primer – Sekonder – Tersiyer Hidrojen Atomları
- Birincil H atomu: Birincil C atomuna bağlı olan H atomlarına denir.
- İkincil H atomu: İkincil C atomuna bağlı olan H atomlarına denir.
- Üçüncül H atomu: Üçüncül C atomuna bağlı olan H atomuna denir.
Aşağıdaki örneği inceleyebilirsiniz:
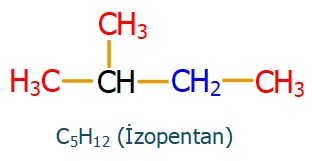
Yukarıda verilen molekülde;
- Kırmızı renkteki C ve H atomları birincildir.
- Mavi renkteki C ve H atomları ikincildir.
- Siyah renkteki C ve H atomları üçüncüldür.
IUPAC Adlandırma Sistemi
- Alkanların adlandırılmasında ve diğer bütün organik bileşiklerin adlandırılmasında, kullanılan sistem IUPAC sistemidir.
- IUPAC (International Union of Pure and Applied Chemistry): Uluslararası Temel ve Uygulamalı Kimya Birliği demektir.
Organik Bileşikler IUPAC Sistemine Göre Adlandırılırken Şu Kurallar Takip Edilir:
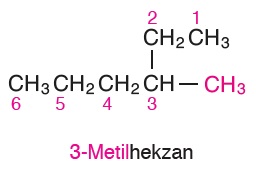
- Moleküldeki en uzun karbon zinciri seçilir. (Kalemi kaldırmadan üzerinden geçebileceğiniz en fazla sayıda karbon atomu tespit edilir.)
- Seçilen en uzun karbon zinciri, bileşiğin gövdesi olur.
- Bileşiğin gövdesine bağlı alkil guruplarına veya diğer gruplara bileşiğin dalları denir.
- Bileşiğin gövdesindeki karbon atomlarına 1’den başlayarak numaralar verilir.
- Numaralandırma işlemi, dallanmaya daha yakın uçtan başlayarak yapılır. İlk dallanma iki ucu da aynı uzaklıkta ise, ikinci dallanmaya yakın taraftan, orda da eşitlik varsa üçüncü dallanmaya yakın taraftan başlanır. Eşitliğin bozulmadığı durumlarda, alfabetik öncelik dikkate alınır.
- Aynı uzunlukta iki gövde bulunursa, dal sayısı daha çok olan gövde tercih edilir.
- Adlandırma işlemine, dallar okunarak başlanır, gövde okunarak bitirilir.
- Birden çok dal varsa, önce alfabetik önceliği olan dal okunur.
- Dalın isminden önce, bağlı olduğu C atomunun numarası da yazılır.
- Aynı daldan birden çok var ise, her birinin numarası ayrı ayrı belirtilir ve dalın isminden önce sayısı (di, tri, tetra, …) yazılarak dal, tek seferde okunur.
- Gövdedeki karbon sayısına göre ismi yazılır ve adlandırma biter.
- Gövde halkalı yapıda ise, isminin önüne “siklo” ön eki getirilir.
- Halkalı yapılarda adlandırma yaparken halkalı yapıya;
- Tek bir grup bağlı olduğunda bu grubun yerini belirtmeye gerek yoktur.
- İki farklı grup bağlı olduğunda ise alfabetik sıraya göre önce gelen gruptan başlanarak numaralandırma yapılır.
- Üç ve daha fazla grup bağlı ise toplamda gruplara en küçük sayı gelecek şekilde numara verilir.
Bazı alkanların IUPAC isimlerini yazarak kuralları anlamaya çalışalım.
Örnek:

Yukarıda verilen alkan bileşiğinin IUPAC sistemine göre adı nedir?
Cevap
Örneğin çözümü:
Örnek:

Yukarıda verilen alkan bileşiğinin IUPAC sistemine göre adı nedir?
Cevap
Örneğin çözümü:
Öğretici Örnek:
Numaralandırma işlemi, ilk dallanmaya yakın taraftan başlanarak yapılır: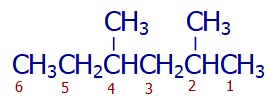
Aynı daldan birden çok varsa, tek seferde, her birinin numarası belirtilerek ve isminden önce de sayısı belirtilerek okunur: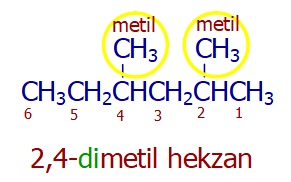
Öğretici Örnek:
Dal uzaklıkları aynı ise, alfabetik önceliği olan dala daha yakın taraftan başlanır.
Aşağıdaki bileşikte, Brom dalının Klor dalına göre alfabetik önceliği olduğundan, numaralandırma soldan başlamıştır:
Öğretici Örnek:
Dallar, alfabetik öncelik sırasına göre okunur: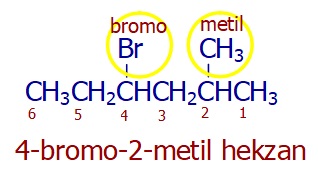
Öğretici Örnek:
Dal zannettiklerimiz gövdede olabilir.
Aşağıdaki moleküle bakalım: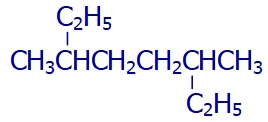
Formülü daha açık yazarsak şöyle olur: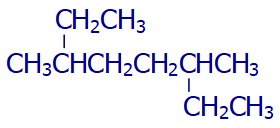
En uzun zincir seçimi ve adlandırma şöyle olur:
Öğretici Örnek:
Eşit uzunlukta iki gövde bulduysak, dal sayısı çok olanı tercih etmeliyiz.
Aşağıdaki bileşik gövde için, 6 C atomundan oluşan iki seçenek vardır:
Birinci seçenek, aşağıda görülen gövdedir ve iki tane dalı vardır: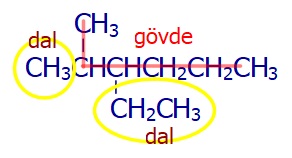
İkinci seçenek, aşağıda görüldüğü gibi tek dala sahiptir:
Tabi IUPAC sistemine göre doğru gövde daha çok dalı olandır. Bileşiğin adı şudur:
Öğretici Örnek:
Siklo bileşikte; tek bir dal varsa, dal numarası belirtilmez.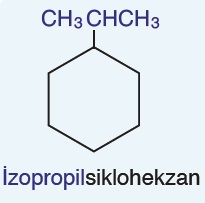
Öğretici Örnek:
Siklo bileşiğe; iki farklı grup bağlı olduğunda ise alfabetik sıraya göre önce gelen gruptan başlanarak numaralandırma yapılır; diğer grubun numarası küçük olacak şekilde devam edilir.
Şartlar eşitse, bağlı grupların toplam numarası küçük olacak şekilde numaralandırma yapılır:
Öğretici Örnek:
Siklo bileşiğe; üç ve daha fazla grup bağlı ise toplamda gruplara en küçük sayı gelecek şekilde numara verilir.
Öğretici Örnek:
Aşağıda, incelemeniz için, bazı organik bileşikler ve IUPAC isimleri verilmiştir.

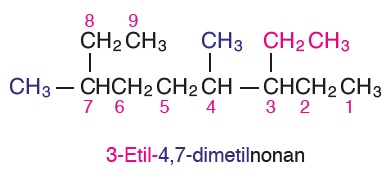

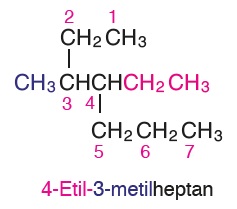
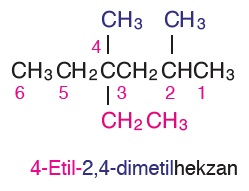

Öğretici Örnek:
Aşağıdaki organik bileşiğin adını bulup, çizgi-bağ formülünü yazalım.
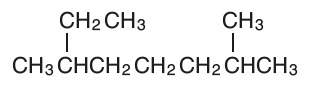
Yukarıdaki bileşiğin IUPAC adı şöyledir:
Aynı bileşiğin çizgi-bağ formülü de şöyle olmalıdır: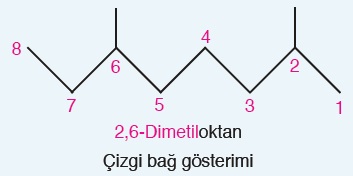
Alkanların Fiziksel Özellikleri
- Oda sıcaklığında ve 1 atm basınçta, düz zincirli alkanların;
- ilk 4 üyesi gaz,
- karbon sayısı 5’ten 18’e kadar olanlar sıvı,
- 18 ve daha fazla karbon içeren alkanlar ise katı hâldedir.
- Doymuş hidrokarbonlardır, hiç pi bağları yoktur.
- Bir alkanın, yapısındaki bütün bağlar sigmadır.
- Alkanların bütün karbonları sp3 hibritleşmesi yapmıştır.
- Kimyasal tepkimelere karşı isteksiz oldukları için “parafin” olarak adlandırılırlar.
- Alkanlara “mumlar” da denir.
- Homolog sıra oluştururlar. (Ardışık iki alkanın formülleri arasında her zaman -CH2– kadar fark vardır.)
- Karbon sayısı daha çok olan alkanın kaynama noktası daha yüksektir.
- Dallanma sayısı arttıkça, alkanın kaynama noktası düşer.
- Alkanlar apolar bileşiklerdir, suda çözünmeleri ya da suyu çözmeleri beklenmez.
- Apolar oldukları için hidrofobdurlar, suyu sevmezler. Elma kabuğu veya kalın yapraklı bitkilerin yapraklarının yüzeyi katı alkan ile kaplıdır. Bu yüzden, bu bitkilerin yüzeyinde su durmaz.
- Alkanlar, organik bileşikler içinde yoğunluğu en düşük bileşiklerdir. Karbon sayısı arttıkça genellikle yoğunlukları da artar.
- Apolar maddeler için çözücü olarak kullanılırlar.
- Genellikle, petrolden ve doğalgazdan elde edilirler.
- Petrolün önemli bir kısmı alkanlardan oluşur.
Alkanlarda İzomeri
- Aynı atomların, farklı dizilmesi ile oluşan bileşiklere “izomerler” denir.
- Bir başka ifade ile, kapalı (molekül) formülleri aynı, açık (yapı) formülleri farklı bileşiklere izomer denir.
- İzomerlerin molekül formüller aynı olsa da şu özellikleri farklıdır:
- İzomerlerinin IUPAC adları farklıdır.
- İzomerlerinin, fiziksel özellikleri (erime ve kaynama noktaları, yoğunlukları) farklıdır.
- İzomerlerinin kimyasal özellikleri farklıdır.
- Organik bileşiklerde izomerlik yapı izomerliği ve stereo izomerlik olmak üzere 2’ye ayrılır. Bunlardan bizi ilgilendiren izomerlik, yapı izomerliğidir.
- Organik bileşiklerde yapı izomerliği kendi içinde 3 çeşittir. Bunlar şunlardır:
- Zincir (Dallanma) İzomerliği
- Konum İzomerliği
- Fonksiyonel Grup İzomerliği
1. Zincir (Dallanma) İzomerliği
- Aynı kapalı (molekül) formüle sahip bileşiklerde, karbon atomları farklı bir sırada dizilmişse, bu bileşikler, birbirinin zincir veya dallanma izomeridir.
Öğretici Örnek:
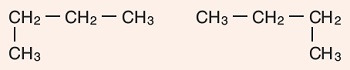
Aşağıda, C4H10 alkanının iki farklı zincir izomeri verilmiştir:

Öğretici Örnek:
Aşağıdaki üç bileşiğin de kapalı formülü C5H12 dir. Fakat, karbon zincirleri aynı olmadığı için, zincir izomerleridir:

- Metan, etan ve propan moleküllerinin zincir izomerleri mümkün değildir. Zincir izomerisi olan en küçük alkan, 4 karbonlu bütandır.
- Karbon zincirinin en sonundaki karbon atomu dal olamaz. Bu yüzden aşağıdaki molekülleri izomer değil aynı moleküllerdir:
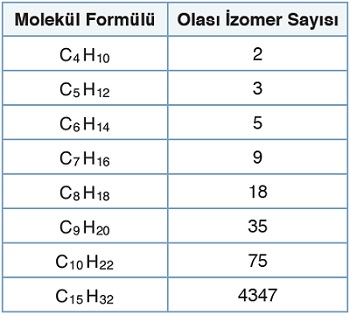
- Moleküldeki karbon sayısına göre alkanların izomer sayısı şöyledir:
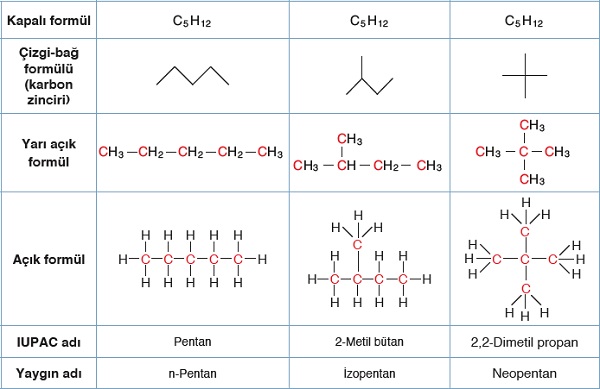
- Pentan molekülüne ait üç farklı izomerin detayları aşağıdaki tabloda verilmiştir:
- Bütan ve pentan molekülünün izomerlerinin çizgi-bağ gösterimlerini inceleyebilirsiniz:

2. Konum İzomerliği
- Aynı karbon zincirinde, fonksiyonel grubun yeri değişirse bir konum izomeri oluşur.
- Fonksiyonel grup, bir organik bileşiğin türünü belirleyen atom grubudur.
- Mesela, bir organik molekülde, karbon atomuna -OH grubu bağlı ise, bileşik bir alkol bileşiğidir.
- Aşağıda bazı fonksiyonel gruplar ve anlamları verilmiştir:
- -OH: Bileşiği alkol yapar.
- -COOH: Bileşiği organik asit (karboksilli asit) yapar.
Öğretici Örnek:
Aşağıda, aynı kapalı formüle sahip iki alkol bileşiği verilmiştir. Fonksiyonel grupları farklı yerlerde olduğu için bu iki alkol, birbirinin konum izomerleridir:

Halkalı Bileşiklerde Yapı İzomerliği
- Karbon zinciri kaplı bir geometrik şekil oluşturuyorsa, böyle moleküllere halkalı moleküller denir.
- Halkalı moleküllerin de dalları olabilir.
- Halkalı bir molekülde, aynı dallar farklı köşelere bağlandığında yapı izomerleri oluşur.
- Halkalı bir molekülün yapı izomerleri en az iki adet dala sahip olmalıdır.
Öğretici Örnek:
Aşağıda, halkalı yapıdaki C6H12 bileşiğinin konum izomerleri verilmiştir:

Orto-Meta-Para İzomerliği
- Aşağıda, aromatik bileşiklerin temelini oluşturan benzen (C6H6) bileşiğinin formülleri verilmiştir.
- Verilen formüllerin hepsi birbirine eşittir:
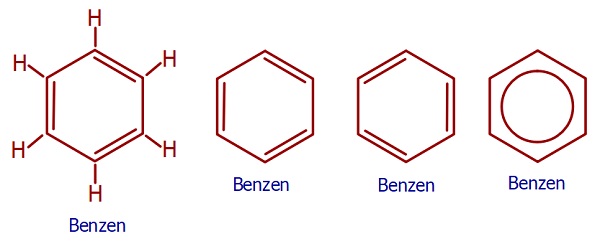
- Benzen bileşiğinde, 2 tane dal varken, bu dalların konumuna göre;
- orto
- meta
- para izomerleri oluşur.
- Bu izomerlerin anlamları şöyledir:
- Orto izomerliği (o-): Benzen halkasındaki iki dal, komşu köşelerdedir.
- Meta izomerliği (m-): Benzen halkasındaki iki dalın arasında bir tane boş köşe vardır.
- Para izomerliği (p-): Benzen halkasındaki iki dal karşılıklı olarak bağlanmıştır, yani; aralarından iki tane boş köşe vardır.
Öğretici Örnek:
Aşağıda, “dikloro benzen” bileşiğinin orto-meta-para izomerleri verilmiştir:

- Benzen halkasına 2’den fazla grup bağlı ise veya benzen halkasından başka bir halkaya 2 tane grup bağlı ise, orto-meta-para izomerliği geçerli değildir.
Öğretici Örnek:
Aşağıdaki moleküllerde orto-meta-para izomerliği yoktur:

3. Fonksiyonel Grup İzomerliği
Fonksiyonel grup izomerliği, henüz bilmediğimiz organik bileşiklerde görülen bir izomerlik türüdür. O yüzden bu izomerlik türü yeri geldikçe açıklanacaktır. Şimdilik şu bilgilerin ezberlenmesi faydalı olacaktır:
- Aşağıdaki bileşik çiftlerinde, formülleri aynı olan üyeler birbirinin fonksiyonel grup izomerleridir.
- Alkol ile eter
- Aldehit ile keton
- Karboksilli asit ile ester
Alkanların Kimyasal Tepkimeleri
- “Parafin” kelimesi “az etkinlik” anlamındadır.
- İsimlerinden de anlaşıldığı gibi alkanlar, kimyasal tepkimelere karşı isteksiz bileşiklerdir.
- Alkan bileşiklerindeki C-C ve C-H bağları, güçlü bağlardır ve bu bağların kırılması için çok yüksek sıcaklıklara kadar ısıtılmaları gerekir.
- Bu durum, alkanlara kararlılık kazandırır.
Alkanlar şu tepkimeleri verir:
I. Alkanların Yanma Tepkimeleri
- Organik bileşikler, yandıkları zaman CO2 ve H2O oluşur. Alkanlar için de bu durum geçerlidir.
- Düz zincirli bir alkanın genel formülü CnH2n+2‘dir ve yanma tepkimesi her zaman şu şablona göre gerçekleşir.

- Halkalı (siklo) alkanların genel formülü CnH2n‘dir. Yanma tepkimeleri aşağıdaki şablona göre gerçekleşir.
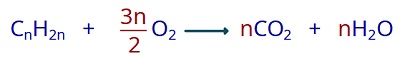
- Alkanların yanma tepkimelerinde, yüksek miktarda ısı enerjisi açığa çıkar. Bu yüzden; metan, etan, propan veya bütan gibi gaz halindeki alkanlar yakıt olarak kullanılır.
- Genellikle; dallanma arttıkça, yanma tepkimesinin verdiği ısı azalmaktadır.
Aşağıda bazı alkanların yanma tepkimeleri verilmiştir:
CH4 + 2O2 → CO2 + 2H2O ΔH < 0
C2H6 + 7/2O2 → 2CO2 + 3H2O ΔH < 0
C3H8 + 5O2 → 3CO2 + 4H2O ΔH < 0
II. Alkanların Halojenlerle Yer Değiştirme Tepkimeleri
- Halojenler 7A grubu ametalleridir: F2, Cl2, Br2, I2
- Alkanlar ısı veya ışık etkisi ile halojenler ile yer değiştirme tepkimesi verir.
- Yer değiştirme tepkimesinde, alkanın H’leri ile halojen atomları yer değiştirir.
- Tepkime sonucunda, “alkil halojenür veya haloalkan” bileşikleri oluşur.
Alkanların, halojenler ile verdikleri yer değiştirme tepkimeleri genel olarak şöyle gösterilebilir:

- CH4‘ün (metan), Cl2 ile verdiği yer değiştirme tepkimesi aşağıda verilmiştir. Tepkimeye bakıldığında, yeterince Cl2 gazı kullanıldığında, CH4‘ün bütün hidrojenleri Cl atomları ile yer değiştirebilir:
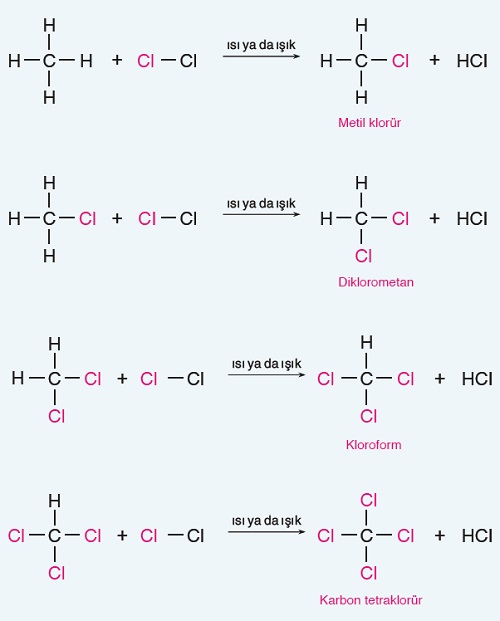
- Alkanların, halojenler ile verdiği yer değiştirme tepkimeleri “radikaller” üzerinden yürür ve 3 basamakta gerçekleşir. Bu basamaklar şunlardır:
- Başlangıç tepkimesi
- Zincir tepkimesi
- Tepkimenin durması
- Radikal, ortaklaşa kullanmadığı bir yalnız elektronu olan atom ya da moleküllerdir. Radikallerin Lewis nokta yapılarına bakıldığında, bir kenarlarında yalnız bir noktalarının olduğu görülür.
CH4‘ün (metan), Cl2 gazı ile verdiği yer değiştirme tepkimesinin basamakları aşağıda verilmiştir.
1. Başlangıç tepkimesi:
- Tepkimenin başlayabilmesi için öncelikle ortamda bulunan klor moleküllerinde, klor atomları arasındaki bağların kırılarak klor radikallerinin oluşması gerekir.
- Bunun için gerekli enerji, ultraviyole ışınlardan ya da yüksek ısıdan sağlanır.

- Cl2 molekülünde, klor atomları arasındaki bağın bağ enerjisi, 242,7 kJ/mol’dür.
- CH4 molekülünde C-H bağının enerjisi ise 414 kJ/mol’dür.
- Bu yüzden önce Cl2 bağı kopar.
2. Zincir tepkimesi:
- Radikaller çok aktif kimyasallardır. Hemen tepkimeye girerler ve başka radikallerin oluşmasına sebep olurlar.

3. Tepkimenin Durması:
- İki radikal birbiri ile tepkimeye girerse, yeni bir radikal oluşmayacağı için tepkime durur:

- Yukarıda da görüldüğü gibi bu basamakta, Cl2 ve C2H6 gibi istenmeyen ürünler de oluşabilmektedir.
Alkanların Kullanım Alanları
- Alkanların dünyada en önemli doğal kaynakları fosil yakıtlar olarak bilinen doğal gaz, petrol ve kömürdür.
- Fosil yakıtlar, enerji verimliliği yüksek maddeler olduğu için özellikle enerji üretiminde kullanılır.
- Doğal gaz, %90-95 oranında metan, %5-10 etan, propan, bütan, 2-metilpropan gibi kaynama noktası düşük bazı alkanların bir karışımıdır.
- Yer altından çıkarılan petrole ham petrol denir.
- Ham petrolden elde edilen başlıca kimyasallar şunlardır:
- Benzin
- Asfalt
- Fuel-oil
- LPG (Likit Petrol Gazı)
- Nafta
- Gaz yağı
- Motorin (dizel ya da mazot)
- Madeni yağ
- LPG (Sıvılaştırılmış Petrol Gazı); karbon sayısı 1 ile 4 arasında olan alkanlardan oluşur.
- Fuel-oil; kalorifer yakıtı olarak bilinir. Çevreci bir yakıt değildir ve kullanımı sınırlıdır. İçerdiği S oranına göre dört çeşit fuel-oil vardır. Bunlar:
- Fuel-oil 3: S oranı en düşük olandır.
- Fuel-oil 4
- Fuel-oil 5
- Fuel-oil 6
- Ülkemizde kullanılan LPG; bütan ve propandan oluşmaktadır.
- Asfalt; karbon sayısı 80 ve üzeri olan hidrokarbonlardan oluşan oldukça yoğun bir maddedir. Zift ve katran üretiminde kullanılır. Katran; akışkanlığı az olan siyah bir sıvıdır. Ziftin akışkanlığı katrandan da azdır.
- Hekzan (C6H12) gibi sıvı alkanlar, çözücü olarak da kullanılırlar.
Katalitik Kraking Tepkimesi
- Alkanlar; yüksek sıcaklık ve basınç altında, parçalanırlar.
- Bu parçalanma tepkimelerine “radikalik kraking tepkimeleri” veya “katalitik kraking tepkimeleri” denir.
- Radikalik Karking Tepkimelerinde, büyük bir alkan molekülü kırılarak daha küçük hidrokarbonlara dönüşür.
- Aşağıda C8H18 alkanını verdiği bazı kraking tepkimeleri verilmiştir:
C8H18 → C8H18 + H2
C8H18 → C4H10 + C4H8
C8H18 → C4H8 + C3H6 + CH4
Benzinin Oktan Sayısı
- Benzin; petrolün damıtılması (rafinasyonu) ile elde edilen bir sıvıdır.
- Benzin; 6 ile 9 karbona sahip hidrokarbonların bir karışımıdır.
- Düz zincirli alkanlar yanarken parlarlar. Bu motorlarda vuruntuya sebep olur ve istenmez.
- En vuruntusuz şekilde yanan alkan 2,2,4-trimetilpentan (izooktan) bileşiğidir. Bu alkanın “oktan sayısı” 100 kabul edilir.
- Vuruntusu en fazla olan alkan, heptandır ve heptanın oktan sayısı sıfır kabul edilmiştir.
- Oktan sayısı arttıkça, benzinin kalitesi artar.
- Ham petrolden elde edilen benzinin oktan sayısı düşüktür ve katalitik kraking tepkimeleri ile oktan sayısı yükseltilir.
Metan Eldesi
- CH4 (metan) elde etmenin bir yolu da aşağıdaki kimyasal tepkimedir:
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
Alkenler (Olefinler)

- Alkenlerin alkanlardan farkı, karbon zincirinde, aralarında ikili kovalent kurmuş karbon çiftlerine sahip olmasıdır.
- Alken ailesinin en küçük üyesi 2 karbonludur. Tek karbonlu alken yoktur.
- Alken hidrokarbonlarının isimleri “-en” veya “-ilen” son eki ile biter.
- Alkenlerin genel formülü CnH2n‘dir. Aşağıda 10 karbonluya kadar olan alkenlerin kapalı formülleri (molekül formülleri) ve isimleri verilmiştir:
| Alkenin Adı (CnH2n) | Molekül Formülü |
|---|---|
| C2H4 | Eten (Etilen) |
| C3H6 | Propen (Propilen) |
| C4H8 | Büten (Bütilen) |
| C5H10 | Penten (Pentilen) |
| C6H12 | Hekzen (Hekzilen) |
| C7H14 | Hepten |
| C8H16 | Okten |
| C9H18 | Nonen |
| C10H20 | Deken |
- Aşağıda alkenlerden bazı örnekler verilmiştir:
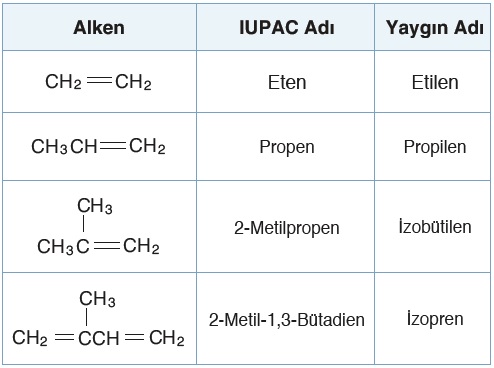
- Sikloalkenlerin genel formülü CnH2n-2‘dir.
- Alkenlerden 1 tane H atomu çıkarılırsa “alkenil” grupları oluşur.
- Aşağıda alkenil gruplarına bazı örnekler verilmiştir:

Alkenlerin Adlandırılması
IUPAC sistemine göre alkenlerin adlandırılması, alkanlara benzer şekilde ve şöyle yapılır:
- İçinde çift bağlı karbonların da olduğu en uzun zincir seçilir. Bu zincir, alken bileşiğinin gövdesidir. Zincirdeki karbonlara bağlı olan diğer gruplar, bileşiğin dallarıdır.
- Gövdedeki karbonlar, çift bağa yakın taraftan başlanarak numaralandırılır. Çift bağ, gövdenin her iki ucuna da eşit uzaklıkta ise, dala yakın taraftan başlanır.
- Önce numaraları ile birlikte dallar, sonra da gövde okunur.
- Gövdenin isminden önce, ikili bağ karbonlarının numaralarından küçük olan da belirtilir.
- Gövdenin ismi “-en” son eki ile biter. Gövdede 2 tane çift bağ varsa, gövdenin ismi “-dien“, 3 tane varsa “-trien” son eki ile biter.
- Birden çok ikili bağ içerek alkenlere “polialken” denir.
Öğretici Örnek:
Numaralandırma çift bağa yakın uçtan başlar ve alkenin isminden önce çift bağın küçük numarası belirtilir.
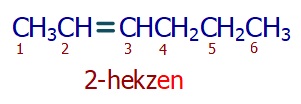
Öğretici Örnek:
Birden fazla çift bağ varsa, numaraları belirtilir ve alkenin isminde -dien, -trien… son ekleri kullanılır.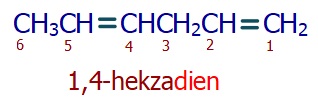
Öğretici Örnek:
Numaralandırma yapılırken, dala değil çift bağa yakın tarafın önceliği vardır.
Öğretici Örnek:
Çizgi bağ formüllerinde, her bir zik zak çizgisinin başında ve sonunda görünmeyen bir C atomunun olduğunu hatırlayalım.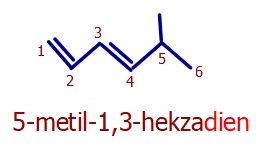
Öğretici Örnek:
Halkalı alkenlerin gövdeleri -siklo ön eki ile adlandırılırlar.
Öğretici Örnek:
Halkalı alkenlerde, numaralandırma işlemi ikili bağdan başlar ve dala yakın tarafa doğru gider. 1 ve 2 numara ikili bağa ait olmalıdır.
Öğretici Örnek:
En uzun zincir, ikili bağı da içermelidir.
Aynı bileşik, çizgi bağ formülü ile de sorulabilir:
Öğretici Örnek:
Çift bağ her iki tarafa da eşit uzaklıkta ise, numaralandırma işlemi, dala yakın taraftan başlanır.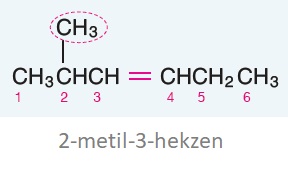
Aynı bileşik, çizgi bağ formülü ile de sorulabilir:
Öğretici Örnek:

Aynı bileşik, çizgi bağ formülü ile de sorulabilir:
Öğretici Örnek:
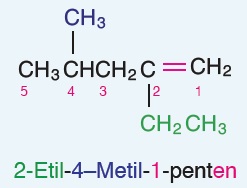
Aynı bileşik, çizgi bağ formülü ile de sorulabilir: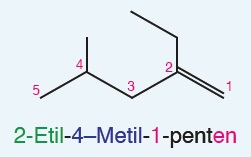
Öğretici Örnek:
Sikloalkenlerin adlandırılmasına bazı örnekler: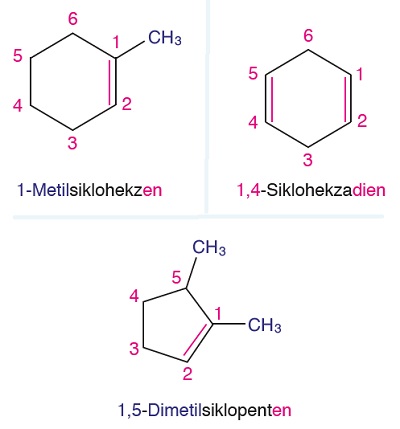
Alkenlerde Cis-Trans İzomeri
- Cis-trans izomeri; bir yapı izomerisi türü değil, bir geometrik izomeri türüdür.
- Cis-trans izomerlerinin hem kapalı formülleri hem de açık formülleri aynıdır.
- Alkenlerde, çift bağlı karbonun etrafındaki gruplardan iki tanesi aynı ise o alkende cis-trans izomeri vardır.

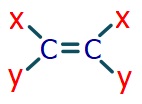
- Aynı olan iki grup aynı karbonda bağlı ise, o alkende cis-trans izomerliği yoktur.
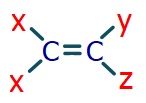
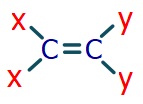
- Aynı gruplar, aynı tarafta ise cis izomerliği vardır.

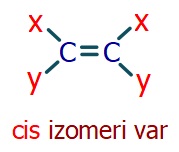
- Aynı gruplar, zıt taraflarda ise trans izomerliği vardır.


Bir çift bağın etrafında oluşabilecek bütün durumlar aşağıda verilmiştir:
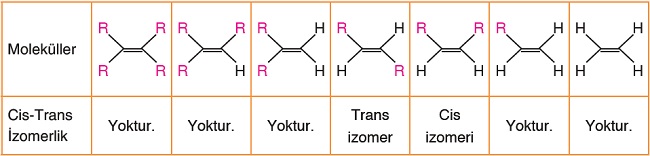
- Cis ve Trans izomerler, IUPAC adının en başına yazılır.
Öğretici Örnek:
Cis ve Trans izomerler, IUPAC adının en başına yazılır.
Aynı moleküller şöyle de sorulabilir: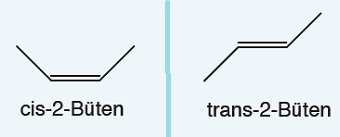
Öğretici Örnek:
Örnek bir cis-trans adlandırması: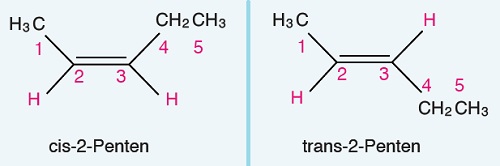
Öğretici Örnek:
Aynı gruplar aynı karbonda ise, cis-trans izomerliği yoktur.
Aşağıda verilen molekül çiftleri birbirinin aynısıdır, cis-trans izomeri göstermezler.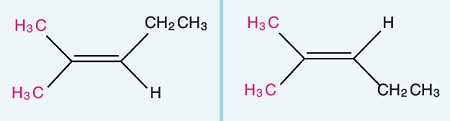
Aşağıda verilen molekül çiftleri birbirinin aynısıdır, cis-trans izomeri göstermezler.
- Cis ve trans izomerlerin, fiziksel özellikleri ve kimyasal tepkimelere girme istekleri farklıdır.
- Cis izomerinin kaynama noktası, trans izomeriden daha yüksektir.
Alkenlerin Fiziksel Özellikleri
- Alkenlerin 5 karbonluya kadar olan üyeleri gaz halindedir.
- Alkenler de tıpkı alkanlar gibi apolar bileşiklerdir.
- Suda çözünmezler; organik ya da apolar çözücülerde çözünürler.
- Yoğunlukları sudan daha düşüktür, bu yüzden sıvı alkenler suyun üzerinde toplanır.
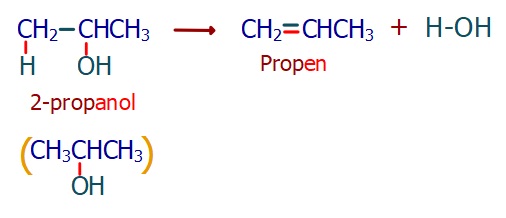
Alkenlerin Eldesi
- Alkol bileşiklerinden, 170oC’de ve H2SO4 katalizörlüğünde su çekilerek alken elde edilebilir:
- Alkil halojenülerden (R-X) H-X çekilmesi ile:
- Tepkimede, NaOH ve KOH bazlarının alkol çözeltileri kullanılır.
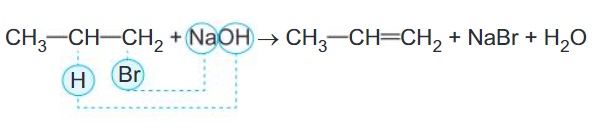
- Alkanların dehidrojenasyonu (H2 çekilmesi) ile:
- Tepkime, 800oC’de ve Al2O3 katalizörlüğünde gerçekleşir.

- Alkinlere kısmen H2 katılması ile:
- Tepkime, Lindlar (aktifleşmiş Pb/CaCO3) katalizörlüğünde gerçekleşir.

Alkenlerin Kimyasal Tepkimeleri
- Pi (π ) bağı, alkenlere kimyasal olarak aktiflik kazandırır.
- Alkenler; pi (π ) bağları sayesinde katılma tepkimeleri verirler.
- Alkenler; pi (π ) bağları sayesinde polimerleşme tepkimeleri verirler.
I. Alkenlerin Yanma Tepkimeleri
- Organik bileşikler, yandıkları zaman CO2 ve H2O oluşur. Alkanlar için de bu durum geçerlidir.
- Düz zincirli bir alkanın genel formülü CnH2n‘dir ve yanma tepkimesi her zaman şu şablona göre gerçekleşir.

- Sikloalkenlerin genel formülleri CnH2n-2’dir ve yanma tepkimeleri şu şablona göre gerçekleşir:

II. Alkenlere H2 Katılması
- Alkenin pi (π ) kopar, pi bağını kaybeden C atomları birer tane H atomu ile bağ kurar.
- Alkenlere H2 katılması tepkimesi; Ni, Pt ve Pd katalizörlüğünde gerçekleşir.
- Alkenlere H2 katılması tepkimesi sonucu, alken bileşiği bir alkana dönüşür.

Öğretici Örnek:
- Propene H2 katarsak, propan oluşur:

III. Alkenlere Halojen (X2) Katılması
- Alkenin pi (π ) kopar, pi bağını kaybeden C atomları birer tane halojen atomu ile bağ kurar.
- Alkenlere halojen katılması tepkimesi sonucu, alken bileşiği bir “alkil halojenüre” dönüşür.
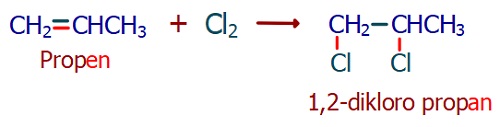
- Bromlu (Br2) su kırmızı-kahverengi renkli bir maddedir. Alkenler ile tepkimeye girdiğinde, brom atomları alkil halojenüre dönüşür ve çözelti renksiz hale gelir. Bu tepkime, alkenlerin tanınmasında kullanılır.
IV. Alkenlere Hidrojen Halojenür (HX) Katılması
- Alkenlere, HX katılması tepkimesi, “Markovnikov Kuralı“na göre yürür.
- Markovnikov Kuralı‘na göre, alkenlere HX katılırken, alkenin pi (π ) bağı kopar, pi bağını kaybeden C atomlarından hidrojen sayısı çok olana HX molekülündeki H atomu bağlanır.
- Pi bağı kopan karbonlarda eşit sayıda H atomu varsa, tepkimede Markovnikov kuralı düşünülmez.
- Alkenlere halojen katılması tepkimesi sonucu, alken bileşiği bir “alkil halojenüre” dönüşür.
Öğretici Örnek:
Morkovnikov kuralına göre yürümeyen bir katılma tepkimesi:

Öğretici Örnek:
Markovnikov kuralına göre yürüyen bir katılma tepkimesi:

- Propenin HCl ile verdiği katılma tepkimesi %100 Markovnikov Kuralına göre gerçekleşmez.
- Yani, bu tepkimede, yan ürün olarak, az da olsa 1-kloro propan bileşiği de oluşur.
- Markovnikov kuralına göre yürüyen diğer tepkimelerinde de durum böyledir.
V. Alkenlere H2O Katılması
- Alkenlere su katılması tepkimesi de Markovnikov kuralına göre yürür. Yani karbonlar arasındaki pi bağı kopar ve hidrojen sayısı çok olan karbon, suyun H atomu ile bağ kurar, diğeri OH ile bağ kurar.
- Alkenlere su katıldığında, bir alkol bileşiği elde edilir.
- Bu tekime asit katalizörlüğünde gerçekleşir.
Öğretici Örnek:
Markovnikov kuralına gerek kalmayan bir su katılması tepkimesi:

Öğretici Örnek:
Markovnikov kuralına göre yürüyen bir su katılması tepkimesi:
Bu tepkimede, Markovnikov kuralına uymayan bazı propen ve su molekülleri de olacaktır; H ve OH atomları ters şekilde de bağlanacaktır. Bu şekilde, tepkimenin yan ürünü oluşacaktır:
VI. Alkenlerin KMnO4 ile Tepkimeleri
- Sadece alkenler KMnO4 çözeltisi ile yükseltgenerek diollere dönüşürler.
- Bu tepkime, Bayer Testi olarak bilinir ve alkenleri tanımada kullanılır.

VII. Alkenlerin Polimerleşme Tepkimeleri
- Pi bağı içeren bütün hidrokarbonlar, polimerleşme tepkimesi verebilirler.
Polimerler konusunu hatırlamak için, Kimya 10 dersinde gördüğümüz şu başlığı tekrarlayabilirsiniz.
Öğretici Örnek:
Etilen monomerinden Polietilen (PE) polimerinin oluşumu:
Öğretici Örnek:
Vinil klorür monomerinden Polivinil klorür (PVC) polimerinin oluşumu:
Öğretici Örnek:
Tetrafloro eten monomerinden Polietetrafloreten (TEFLON) polimerinin oluşumu:
Alkenlerin Kullanım Alanları
- Etilen (C2H4), bir bitkinin meyvesinin olgunlaşmasını sağlayan bir bitki hormonudur. Domates ve muz gibi meyvelerin olgunlaşmasına yardımcı olur.
- A vitamini kaynağı olan ve havuca rengini veren β-karoten, 11 tane ikili bağ içeren bir polialkendir.
- Alkil halojenürler ve alkollerin üretilmesinde kullanılan alkenler, polimerlerin üretiminde başlangıç maddesi olarak kullanılmaktadır.
- Alkenlerin en az karbon sayılı bileşikleri olan eten ve propen, endüstriyel amaçlar doğrultusunda üretilen en önemli bileşiklerdir.
- Eten, birçok endüstriyel bileşiğin üretiminde başlangıç maddesi olarak kullanılmaktadır. Bu bileşiklerden başlıcaları etilklorür, etanol ve polietilendir.
Alkenil Grupları
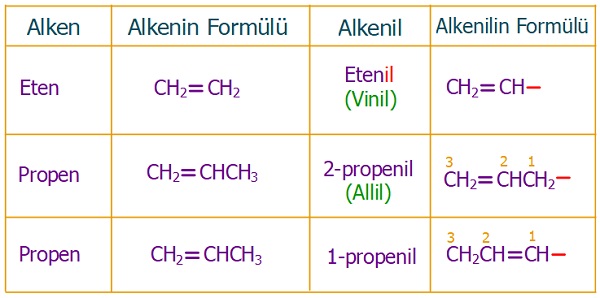
- Alkenlerden bir H atomu koparsa, alkenil grupları oluşur.
- Alkenil grupları da, tıpkı alkil grupları gibi organik bileşiklerde dal olarak bulunurlar.
- Alkenil gruplarının IUPAC adı, türediği alkenin adının sonuna “-il” son eki konularak bulunur.
- Aşağıda bazı alkenil grupları verilmiştir:
Alkinler (Asetilenler)

- Alkinlerin, alkanlardan farkı, karbon zincirinde, aralarında üçlü kovalent kurmuş karbon çiftlerine sahip olmasıdır.
- Alkin ailesinin en küçük üyesi 2 karbonludur. Tek karbonlu alkin yoktur.
- Alkin hidrokarbonlarının isimleri “-in” son eki ile biter.
- Alkinlerin genel formülü CnH2n-2‘dir. Aşağıda 10 karbonluya kadar olan alkinlerin kapalı formülleri (molekül formülleri) ve isimleri verilmiştir:
| Alkinin Adı (CnH2n-2) | Molekül Formülü |
|---|---|
| C2H2 | Etin (Asetilen) |
| C3H4 | Propin |
| C4H6 | Bütin |
| C5H8 | Pentin |
| C6H10 | Hekzin |
| C7H12 | Heptin |
| C8H14 | Oktin |
| C9H16 | Nonin |
| C10H18 | Dekin |
- Alkinlerin en bilinen üyesi, aynı zamanda alkin ailesinin ilk üyesi olan C2H2 (asetilen) bileşiğidir. Bu yüzden alkinlere asetilenler denir.
- Asetilen molekülü, aşağıdaki şekillerde gösterilir:

Aşağıda, alkinlerden bazı örnekler verilmiştir:

Alkinlerin Adlandırılması
- Alkinlerin adlandırılma kuralları, alkenler ile aynıdır. Aradaki tek fark; alkinlerin adının -in son eki ile bitmesidir.
- Alkin molekülünde ana zincirde ikili ve üçlü bağ zincirin ucuna eşit uzaklıktaysa ikili bağa öncelik verilir (İkili bağa küçük sayı gelecek şekilde numaralandırılır.)
Öğretici Örnek:
Hem yarı açık hem de çizgi bağ formülü verilen bir alkin bileşiği:
Öğretici Örnek:
Hem yarı açık hem de çizgi bağ formülü verilen bir başka alkin bileşiği:
Öğretici Örnek:
Hem yarı açık hem de çizgi bağ formülü verilen bir başka alkin bileşiği: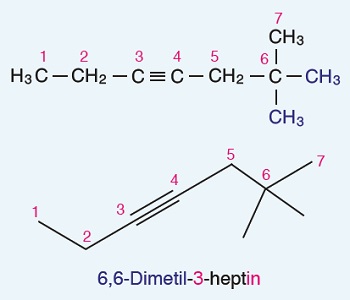
Öretici Örnek:
Hem yarı açık hem de çizgi bağ formülü verilen bir başka alkin bileşiği:
Asetilenli Adlandırma
- Alkinler, asetilen türevi bileşikler olduğundan, asetilene bağlı alkil grupları ile de adlandırılabilir.
- Aşağıda bu durumun örnekleri verilmiştir:

Alkinlerin Fiziksel ve Kimyasal Özellikleri
- Etin, propin ve 1-bütin; oda sıcaklığından gaz haldedir.
- Oda sıcaklığında sıvı olan alkinlerin yoğunluğu 1g/mL’den küçüktür, yani; sudan daha hififtirler.
- Alkinler, apolar maddelerdir ve apolar çözücülerde çözünürler, su gibi polar çözücülerde çözünmezler.
- Asetilen (C2H2), sanayide kullanım alanı olan, bir çok maddenin üretiminde başlangıç maddesi olan kullanılan bir alkindir.
- Endüstride asetilen; kireç taşı, kömür (C) ve su kullanılarak şu tepkimeler ile üretilir:

- Asetilen; yandığında çok yüksek sıcaklıkta (yaklaşık 3000oC) alevler elde edildiği için, metallerin kesilmesinde ve kaynatılmasında kullanılır.

- Asetilen, kararsız bir yapıda olduğu için uygun bir katalizörle ya da basınç altında şiddetli bir patlamayla yapısal bozunmaya uğrayarak elementlerine ayrışır. Asetilenin güvenli bir şekilde taşınması için düşük basınçta, aseton gibi organik bir çözücüde çözünmesi gerekir.
- Pi bağı taşıyan diğer organik bileşikler gibi, asetilen de katılma tepkimesi verir.
- Asetilene H2 katılarak, etilen üretilir:

- Asetilene, hidrojen halojenür (HX) ve halojen (X2) katılması da mümkündür:

- Asetilene FeCl3 katalizörlüğünde HCI katıldığında vinil klorür elde edilir. Tepkimenin ikinci adımında 1,1-diklor etan elde edilir.

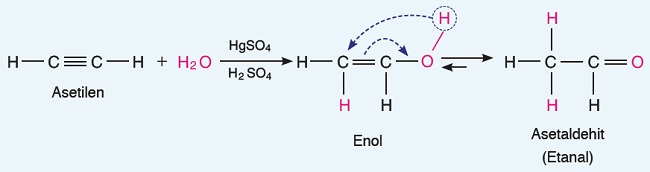
- Asetilene HgSO4 (Cıva-II-sülfat) katalizörlüğünde asidik ortamda su katılmasıyla asetaldehit (etanal) elde edilir.
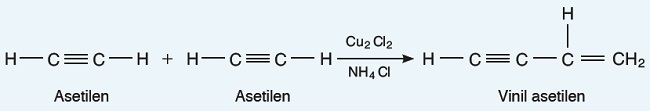
- Asetilen molekülü başka bir asetilen molekülü ile katılma tepkimesi (dimerleşme) verebilir. Elde edilen ürün, vinil asetilendir. Vinil asetilen, yapay kauçuk üretiminde kullanılan önemli bir maddedir:
- Asetilen molekülleri, uygun katalizörler kullanıldığında yaklaşık 400 °C’ta kendi aralarında tepkimeye girerek benzen molekülünü oluşturur.

- Üçlü bağ yapmış C atomuna bağlı olan H’ler asidik karakterlidir.
- Asidik H atomu içerek alkinler metallerle yer değiştirme tepkimesi veririler.
- Asetilen, amonyaklı bakır (I) klorür çözeltisi (Fehling ayracı) ile tepkimeye girdiğinde bakır metali hidrojen atomları ile yer değiştirerek kırmızı renkli bir çökelek oluşturur:

- Asetilen, amonyaklı gümüş nitrat çözeltisi (Tolenz ayracı) ile tepkimeye girdiğinde ise gümüş metali, hidrojen atomları ile yer değiştirerek beyaz renkli bir çökelek oluşturur:

- Asetilenin ağır metal tuzları (bakır asetilenür, gümüş asetilenür gibi) asetilenin birincil patlayıcı tuzları olarak ifade edilir. Bu tuzlar kuru hâlde iken ufak bir sarsıntıda bile şiddetli şekilde patlayabilir.
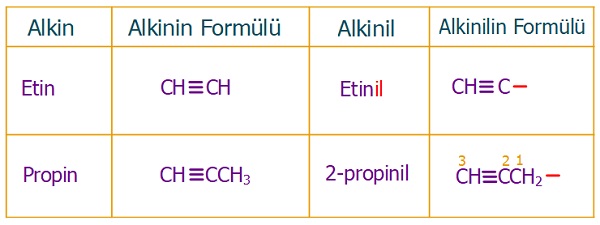
Alkinil Grupları
- Alkinlerden bir H atomu koparsa, alkinil grupları oluşur.
- Alkinil grupları da, tıpkı alkil grupları gibi organik bileşiklerde dal olarak bulunurlar.
- Alkinil gruplarının IUPAC adı, türediği alkinin adının sonuna “-il” son eki konularak bulunur.
- Aşağıda bazı alkinil grupları verilmiştir:
Aromatik Bileşikler
- Alkan, alken ve alkinlere; alifatik hidrokarbonlar dendiğini daha önce öğrenmiştik.
- Alifatik olamayan hidrokarbonlara aromatik hidrokarbonlar denir.
- “Aromatik” kelimesi “güzel kokulu” anlamına gelir.
- Aromatik bileşiklere sistematik olarak “arenler” denir.
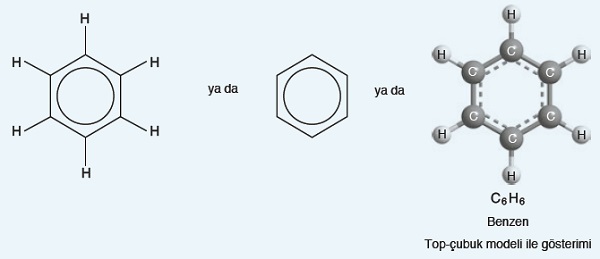
- Aromatik bileşikler, benzen halkası (C6H6) ve türevi bileşiklerdir.
- Benzen halkası için August Kekule tarafından önerilen formüller şöyledir:

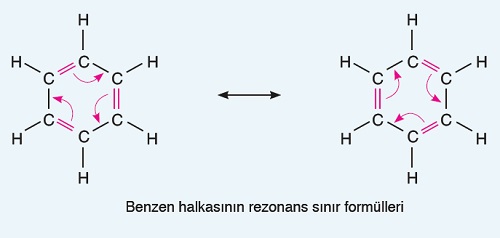
- Günümüzde yapılan çalışmalar ile, benzen halkasındaki pi bağlarının sabit olmadığı, devamlı yer değiştirdiği anlaşılmıştır.
- Pi bağlarının yer değiştirmesi ile oluşan farklı molekül formüllerine “rezonans sınır formülleri” denir.
- Benzen halkasının rezonans sınır formülleri şunlardır:
- Pi bağlarının devamlı hareket ettiğini göstermek için, benzen halkasının içine bir halka çizilir:
- Aromatik bileşiklerin ana kaynağı kömürdür.
- Benzen halkasında tekli ve ikili bağlar ardışık olarak gelir. Bu özelliğe “konjuge bağ yapısı” denir.
Bazı Aromatik Bileşikler ve Kullanım Alanları
Benzen
- Benzen; petrol ve kömürden elde edilen, renksiz, yanıcı ve kanserojen bir sıvıdır.
- Benzen molekülü de diğer hidrokarbonlar gibi apolar bir moleküldür.
- Benzenin erime noktası 5.5oC, kaynama noktası 80oC’dir.
- Benzen, iyi bir organik çözücüdür.
- Benzen halkası, pi bağına sahip olan diğer organik bileşiklerden farklı olarak, kararlı bir yapıdadır ve kimyasal tepkimelere karşı isteksizdir.
- Benzen; pi bağına sahip diğer bileşikler gibi katılma tepkimesi vermez. Çok yüksek sıcaklık ve basınçta; H2 ile çok yavaş da olsa katılma tepkimesi verir ve C6H12 oluşur.

- Bezenin en önemli tepkimesi yer değiştirme tepkimesidir. Benzenin H atomları yer değiştirme tepkimesi verir.
- Bezen Br2 ile yer değiştirme tepkimesi vererek Brombenzen oluşturur.

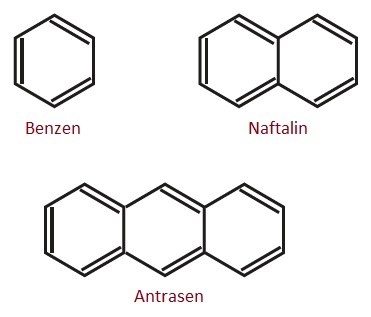
- İki tane beznen halkası bağlandığında naftalin, üç tane benzen halkası bağlandığında antrasen bileşiği oluşur.
Fenol
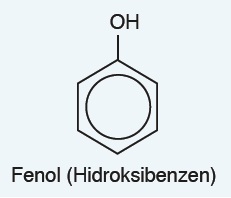
- Benzen halkasındaki bir H atomu OH grubu ile yer değiştirirse, fenol bileşiği oluşur.
- Fenol bileşiği alkollere benzemesine rağmen zayıf bir asittir.
- Derişik çözeltileri tüm canlılara zarar verir.
Anilin

- Anilin, benzen halkasına amino (-NH2) grubunun bağlanması ile elde edilir.
- Zayıf baz özellik gösteren anilin, aminobenzen olarak da adlandırılır.
- Renksiz, kokulu bir sıvı olan anilin, özellikle boya üretiminde kullanılır. Deri boyamacılığında, fotoğrafçılıkta, matbaacılıkta kullanılan anilinden üretilmiş bu tür boyalar, anilin boyalar olarak adlandırılır.
- Mavi renkli indigo boyasının üretiminde kullanılan başlangıç maddesi de anilindir.
- Anilinin asidik ortamda yükseltgenmesiyle polianilin elde edilir.
- Kolay işlenebilirliği, yüksek dayanıklılığı, düşük maliyetli bir malzeme olması ve yüksek iletkenlik kontrolüne sahip olması gibi özelliklerinden dolayı polianilin, önemli bir yarı iletken polimerdir.

Naftalin
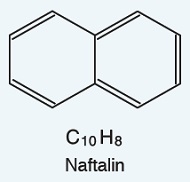
- Naftalin (C10H8), bitişik iki benzen halkası içeren önemli bir aromatik bileşiktir.
- Beyaz pulcuklar hâlinde bir maddedir.
- Tablet haline getirilmiş naftalin oda koşullarında katı hâldedir.
- Suda çözünmeyen naftalin, oda koşullarında katı hâlden (sıvı hâle geçmeden) doğrudan gaz hâle geçebilmektedir (süblimleşme).
- Kolaylıkla buharlaşabildiği için böceklerle mücadelede, özellikle güveleri yünlü kumaşlardan uzaklaştırmada kullanılır.
- Ayrıca lavabolarda koku giderici madde olarak da kullanılmaktadır.
- Ancak insan sağlığına zararlı olduğu saptanan naftalin, kırmızı alyuvarlara zarar verir ya da alyuvarların parçalanmasına neden olur.
- Kanserojen etkileri nedeniyle naftalinin 2008 yılından itibaren Avrupa’da kullanımı yasaklanmıştır.
- Sanayide yakıt ve boya ham maddesi olarak kullanılan naftalin, eczacılık ve parfümeride bazı bileşiklerin üretilmesinde ara madde olarak kullanılmaktadır.
Toluen

- Toluen, karakteristik bir kokuya sahip, renksiz ve suda çözünmeyen bir sıvıdır.
- Fenil grubuna (C6H5-) metil (–CH3) bağlanmasıyla elde edilen aromatik bir hidrokarbondur. Benzen ve ksilen eldesinde, boyalarda inceltici olarak, dezenfektanlarda ve ayrıca patlayıcı yapımında (TNT, trinitro toluen) kullanılır.
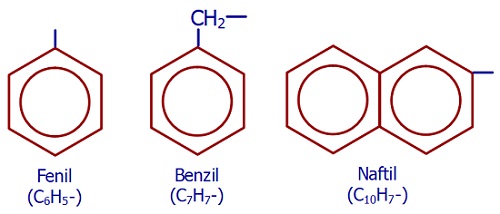
Aril (Ar-) Grupları
Aromatik bileşiklerden bir H atomu koparsa, aril grupları oluşur. Aril grupları, tıpkı alkil grupları gibi, dal olarak okunabilirler.
Aşağıda, bazı aril grupları verilmiştir:
Aromatik Bileşiklerin Adlandırılması
- Benzen halkasında tek bir grup varsa, bu bileşik şu şablona göre okunur:
- Grubun adı + benzen
- Ya da varsa özel adıyla okunur.
Öretici Örnek:

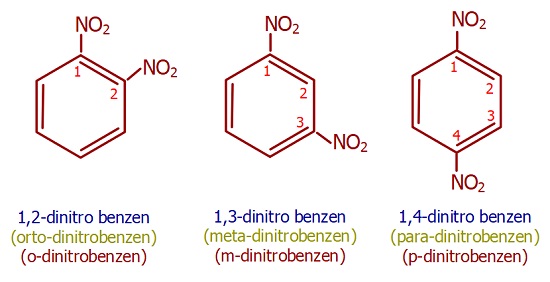
- Benzen halkasında iki veya daha fazla grup varsa, bu gruplara aşağıdaki öncelik sırasına göre numara verilir:
- -COOH (Karboksil)
- -CHO (Aldehit)
- -C=O (Karbonil)
- -OH (Hidroksil)
- -NH2 (Amino)
- -R (Alkil grupları)
- -NO2 (Nitro)
- -X (Halojenler)
- Aynı türde birden fazla grup varsa, alfabetik önceliğe bakılır.
- Bileşikler adlandırılırken şu şablon kullanılır:
- Grupların numarası – adı + benzen
Öğretici Örnek:
Aromatik bileşiklerin adlandırılmasına ait örnekleri inceleyelim:
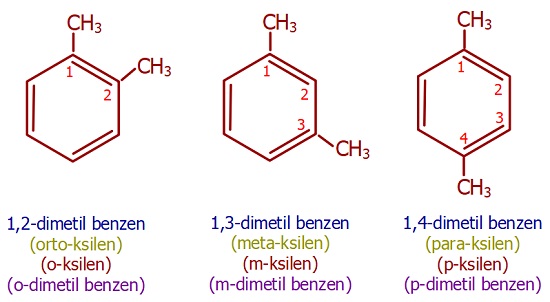
- İki dalın ikisi de metil grubu ise, bu aromatik bileşik “ksilen” olarak da okunabilir.
Öğretici Örnek:
- Anilin, toluen ya da fenol gibi bir bileşiğe ikinci bir dal bağlanırsa, dalın numarası ve bileşiğin adı söylenir:
Öğretici Örnek:






tuğba aksoy says:
harika bir iş anlatımlarınız sade anlaşılır çok teşekkürler