İçindekiler
Karbon Elementi ve Organik Kimya
Organik bileşikler, canlı organizmaları oluşturan maddelerdir. Mesela; biyoloji dersinde sıkça duyduğumuz karbonhidratlar, proteinler, yağlar birer organik bileşiktir. Organik olmayan bileşiklere de “anorganik bileşikler” veya “inorganik bileşikler” denir.
- “Karbon Kimyası” ve “Organik Kimya” aynı anlama gelen kavramlardır.
- Karbon Kimyası; organik bileşiklerin yapısını, özelliklerini ve üretim yollarını inceleyen kimya disiplinidir.
Organik Bileşikler
- Karbon (C) temelli yani C elementinin oluşturduğu bileşiklere “organik bileşikler” denir.
- Bütün organik bileşiklerde C atomu vardır.
- Örnek: CH4, CCl4, CH3OH, HCOOH, C6H6, C10H22, …
- Fakat şu bileşikler karbon içerdiği halde organik bileşik değildir:
- Karbonat bileşikleri: CO32-
- Örnek: CaCO3, Na2CO3, …
- Siyanür bileşikleri: CN–
- Örnek: NaCN, Fe(CN)3, …
- Karbür bileşikleri: C4-
- Örnek: CaC2, Al4C3, …
- CO2 ve CO bileşikleri
- Karbonat bileşikleri: CO32-
- Bütün organik bileşiklerde C atomu vardır.
Örnek:
Organik bileşiklerin temeli olan ve bütün organik bileşiklerde bulunan element aşağıdakilerden hangisidir?
A) H
B) H
C) C
D) O
E) F
Cevap
Örneğin çözümü:
Anorganik Bileşikler
- Organik olmayan bileşiklere “anorganik bileşikler” veya “inorganik bileşikler” denir.
- Anroganik bileşikler genellikle şu şekilde sınıflandırılır:
- Asitler: HCl, H2SO4, …
- Bazlar: NaOH, Ca(OH)2, NH3, …
- Tuzlar: NaCl, CaCO3, FeBr2, …
- Oksitler: CO2, CO, NO, N2O5, H2O, …
- Anroganik bileşikler genellikle şu şekilde sınıflandırılır:
- Organik olmayan bileşikleri inceleyen kimya disiplinine “anorganik kimya” veya “inorganik kimya” denir.
- Anorganik bileşiklerin doğadaki ana kaynağı minerallerdir.
Bu bir reklamdır:
Vitalizm İnancı

- 19. yüzyıla kadar, organik bileşiklerin sadece canlı organizmalar tarafından sentezlenebildiğini ileri süren ve “vitalizm (yaşam gücü)” olarak bilinen bir inanış hâkimdir.
- Bu görüş, organik bileşiklerin kimya laboratuvarında sentezlenemeyeceğini ileri sürmüştür.
- Friedrich Wöhler (Firedrik Völer) 1828 yılında anorganik bileşiklerden yola çıkarak laboratuvar koşullarında ilk organik bileşiği sentezlemeyi başarmıştır.
- Wöhler, bir organik bileşik olan üreyi, tesadüfen de olsa; anorganik bir bileşik olan amonyum siyanatın sulu çözeltisini ısıtarak elde etmiştir.
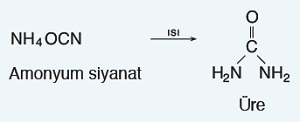
- Wöhler’in bu sentezinden sonra; bilim dünyası, organik bileşiklerin de laboratuvarlarda sentezlenebileceğini anlamıştır ve “vitalizm” yavaş yavaş yerini organik kimya bilimine bırakmaya başlamıştır.
- 1850’li yıllardan itibaren “vitalizm” tamamen yok olmuştur.
- Canlılardan elde edilen bileşiklerine “Organik” bileşik adını koyan bu ismin bütün C bileşiklerinde kullanılmasına sebep olan bilim adamı Johann Jakob Berzelius’tur.
Organik ve Anorganik Bileşiklerin Özellikleri
- Organik ve anorganik benzerlik ve farklılıklar şunlardır:
Organik Bileşikler
- Bütün organik bileşiklerde C elementi mutlaka vardır.
- Aşağıdaki bileşikler, bu durumun istisnasıdır ve anorganik bileşiklerdir:
CO2, CO, CaC2, KCN, Na2CO3, H2CO3, CaCO3
- Aşağıdaki bileşikler, bu durumun istisnasıdır ve anorganik bileşiklerdir:
- Organik bileşik sınıflarından bazıları şunlardır:
- Hidrokarbonlar
- Alkoller
- Eterler
- Aldehitler
- Ketonlar
- Karboksilli asitler
- Esterler
- Korbonhidratlar
- Aminler
- Amidler
- Doğadaki bileşiklerin yaklaşık %98’i organik bileşiktir.
- Organik bileşiklerin hemen hemen tamamında, C ile birlikte H elementi de vardır.
- Bir çok organik bileşikte, C ve H elementlerinin yanı sıra; O, S, N, P, F, Cl, Br gibi ametaller de bulunur.
- Organik bileşikler kovalent yapılıdır.
- Organik bileşiklerin tepkimeleri genellikle yavaştır ve çoğunlukla katalizör gerektirir.
- Bu nedenle mekanizmalar üzerinden yürür.
- Organik bileşikler genellikle suda çözünmez, organik çözücülerde çözünür.
- Organik bileşiklerin erime ve kaynama noktaları genellikle düşüktür ve çoğu kolaylıkla yanar.
Anorganik Bileşikler
- Anorganik bileşikler genellikle şunlardır:
- Asitler
- Bazlar
- Tuzlar
- Oksitler
- Anorganik bileşiklerin, organik bileşiklere göre sayıları daha azdır.
- Anorganik bileşiklerde, bütün elementler bulunabilir.
- Anorganik bileşikler kovalent ya da iyonik yapılı olabilmektedir.
- Anorganik bileşiklerin tepkimeleri ise; genellikle daha hızlıdır.
- Anorganik bileşiklerin çoğu suda çözünür.
- Anorganik bileşiklerin erime ve kaynama noktaları genellikle daha yüksektir ve çoğu yanmaz.
Örnek:
Berna, arkadaşına ismini unuttuğu bir bileşiği tarif ederken şu bilgileri veriyor:
I) Yanıcıdır.
II) Formülünde C ve H elementleri olduğunu biliyorum.
III) Uzun süren bir tepkime ile elde etmiştim.
Buna göre, Berna’nın tarif ettiği bileşiğin aşağıdaki sınıflardan hangisine ait olduğu kesindir?
A) Anorganik bileşik
B) Organik bileşik
C) Bazlar
D) Tuzlar
E) Oksitler
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Organik Bileşik Örnekleri
- Organik bileşiklerin formüllerine baktığımızda C ve H elementi görürüz.
- Yani; bir bileşiğin formülünde hem C hem de H elementi varsa o bileşik için organik bileşiktir diyebiliriz.
Aşağıda, bazı organik bileşikler verilmiştir:
- CH4
- C2H6
- C2H5OH
- C2H4
- CH3OCH3
- CH2O
- C6H12O6
- C2H5COOH
- HCOOH
- CH3COOH
- CH3SH
- CHCl2F
İSTİSNA:
Şu bileşikler, C elementi içerdikleri halde organik bileşik değillerdir:
- CO32- (Karbonat kök iyonu) içerene bileşikler:
- Na2CO3
- H2CO3
- CaCO3
- …
- CN– (Siyanür kök iyonu) içeren bileşikler:
- KCN
- NaCN
- Ca(CN)2
- …
- Karbon elementinin oksitleri:
- CO2
- CO
- C4- (Karbür) bileşikleri:
- CaC2
Anorganik Bileşik Örnekleri
- Bugüne kadar öğrendiğimiz bileşiklerin hemen hemen hepsi anorganik (inorganik) bileşiklerdi.
- Organik bileşikler, C elementinin bileşikleridir fakat; anorganik bileşiklerde böyle bir sınırlama yoktur. Bütün elementler, anorganik bir bileşik yapabilir.
- Anorganik bileşikler; asitler, bazlar, tuzlar ve oksitler olarak sınıflandırılır. Aşağıda bu bileşiklere örnekler verilmiştir:
- Baz: NaOH (Sodyum hidroksit)
- Asit: H2SO4 (Sülfürik asit veya zaç yağı veya akü asidi)
- Tuz: NaCl (Sodyum klorür veya yemek tuzu)
- Oksit: Al2O3 (Alüminyum oksit)
- Oksit: FeO (Demir (II) oksit)
- Oksit: SO2 (Kükürt dioksit)
Asitleri, bazları, tuzları ve oksitleri hatırlamak için aşağıdaki derslere göz atabilirsiniz:
Bu bir reklamdır:

