İçindekiler
Periyodik sistem ve elektron dizilimleri arasında sıkı bir ilişki vardır. Mesela; bir atomun temel haldeki orbital dizilimine bakarak, atomun grup ve periyot numarasını kolayca bulabiliriz.
Elektron Diziliminde Enerji
- Orbitalin enerjisi demek aslında, orbitaldeki elektronların enerjisi demektir.
- Orbitalin enerjisi yüksekse, o orbitaldeki elektronların de enerjisi yüksek demektir.
- Elektronların da Potansiyel ve Kinetik Enerjileri vardır.
- “Elektronun Enerjisi” diyorsak, Potansiyel mi Kinetik mi olduğunu belirtmiyorsak, kastettiğimiz enerji Potansiyel Enerjidir.
- Atomlarda orbitaller, en düşük potansiyel enerjiliden başlayarak yüksek enerjiliye doğru dizilmişlerdir:

- Potansiyel Enerji: 1s orbitalinden itibaren artarak gider.
- Kinetik Enerji: 1s orbitalinden itibaren azalarak gider.
- Aynı orbitalin iki elektronunun kinetik ve potansiyel enerjileri eşittir.
- p, d ve f orbitallerindeki kardeş orbitallerin, kinetik enerjileri eşittir.
- p, d ve f orbitallerindeki kardeş orbitallerin, potansiyel enerjileri eşittir.
Örnek:
4p1, 3p1 ve 4d1 elektronlarının kinetik ve potansiyel enerjilerini kıyaslayınız.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:

Yukarda siyah çizgiler ile gösterilen 3 elektrondan biri x, diğeri y ve üçüncüsü de z olarak adlandırılmıştır.
Buna göre, bu üç elektronun, kinetik ve potansiyel enerjilerine göre karşılaştırmasını yapınız.
Cevap
Örneğin çözümü:
Küresel Simetrik Atomlar ve İyonlar
- Dizilimindeki son orbitali, tam dolu ya da yarı dolu olan atom ya da iyonlar, küresel simetri gösterir.
- Yani; şu orbitallerden herhangi biri ile biten herkes küresel simetriktir:
- s1 – s2
- p3 – p6
- d5 – d10
- f7 – f14
- Yani; şu orbitallerden herhangi biri ile biten herkes küresel simetriktir:
- Son orbitali, tam dolu olan atom veya iyonlar, tam küresel simetriktir.
- Tam küresel simetrik atomlar şu orbitaller ile biter:
- s2
- p6
- d10
- f14
- Tam küresel simetrik atomlar şu orbitaller ile biter:
- Son orbitali, yarı dolu olan atom veya iyonlar, yarı küresel simetriktir.
- Yarı küresel simetrik atomlar şu orbitaller ile biter:
- s1
- p3
- d5
- f7
- Yarı küresel simetrik atomlar şu orbitaller ile biter:
- Küresel simetrik atomlar, şekil olarak tam bir küreye benzeyen atomlardır.
- Küresel simetri özelliği, atomlara, kararlılık kazandırır.
- Mesela; bütün soy gaz atomları küresel simetriktir. Bu yüzden hiç bir kimyasal tepkimeye katılmazlar.
Örnek:
I) Cl1-18 : 1s2 2s2 2p6 3s2 3p6
II) S16 : 1s2 2s2 2p6 3s2 3p4
III) Mn25 : 1s2 2s2 2p6 3s2 3p6 4s2 3d5
IV) Br35 : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Yukarıda orbital dizilimleri verilen atom ve iyonlardan hangileri küresel simetriktir?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
d4 – d9 Kuralı
- Bu kural, 24Cr ve 29Cu atomlarına özel bir kuraldır.
- Bu iki atomun temel hallerine ait orbital dizilimine baktığımızda birinin d4 diğerinin d9 orbitalleri ile bitmesi gerektiğini görürüz:
- Cr24 : 1s2 2s2 2p6 3s2 3p6 4s2 3d4
- Cu29 : 1s2 2s2 2p6 3s2 3p6 4s2 3d9
- Ama yapılan ölçümler, ortaya çıkarmıştır ki bu iki atom asla 3d4 ve 3d9 ile sonlanmamaktadır. Doğrusu şöyledir:
- Cr24 : 1s2 2s2 2p6 3s2 3p6 4s1 3d5
- Cu29 : 1s2 2s2 2p6 3s2 3p6 4s1 3d10
- Yani, temel haldeki atomlarda, son orbital, d4 veya d9 olduğunda; bir önceki s2 orbitali, bir elektronunu bu orbitallere göndermektedir. s2 orbitalinden bir elektron gelince;
- d4 dizilimi d5
- d9 dizilimi de d10 olmaktadır.
- Bu olay kendiliğinden, doğal yollarla gerçekleştiği için, yukarıdaki dizilimler atomların aynı zamanda temel hali olarak kabul edilir.
- Sonuç olarak; 24Cr ve 29Cu atomları, temel halde küresel simetriktir.
Örnek:
29X+ iyonunun orbital dizilimini yapınız.
Cevap
Örneğin çözümü:
Orbital Dizilimi ile Grup-Periyot Bulma
Proton sayısı 20 ve daha küçük olan atomlarda grup ve periyot bulurken, orbital dizilini yapmak şart değildir; Kimya 9 dersinde gördüğümüz yöntemlerle de bulunabilir.
- Orbital dizilimi ile bütün atomların, periyodik sistemdeki grubu ve periyodu bulunabilir.
- Bunun için, mutlaka, atomun, temel halinin orbital dizilimini yapmamız gerekmektedir.
- Temel halde iken atomlar, nötür olurlar ve elektron dizilimleri olması gerektiği gibi, kurallara uygun olur.
Orbital Diziliminden Periyot Bulma
- Atomların orbital dizilimine baktığımızda, orbitallerin önündeki en büyük katsayı, atomun periyot numarasıdır.
- Atomların periyot numarası demek, yörünge sayısı demektir.
- Mesela; bir atomun 4 tane yörüngesi varsa, o atom 4. periyot atomudur.
Öğretici Örnek:
Aşağıda bazı atomların temel (nötür) hallerinin orbital dizilimi ve periyot numaraları verilmiştir:
18Ar : 1s2 2s2 2p6 3s2 3p6 (3. periyot)
8O : 1s2 2s2 2p4 (2. periyot)
25Mn : 1s2 2s2 2p6 3s2 3p6 4s2 3d5 (4. periyot)
35Br : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 (4. periyot)
29X : 1s2 2s2 2p6 3s2 3p6 4s1 3d10 (4. periyot)
Orbital Diziliminden Grup Bulma
- Periyodik tablo, atomların son orbitallerine göre bloklara ayrılmıştır. Bu bloklar şunlardır:
- s bloğu: 1A ve 2A grupları
- p bloğu: 3A, 8A ve arasındaki gruplar
- d bloğu: Bütün B grupları
- f bloğu: Lantanitler ve Aktinitler
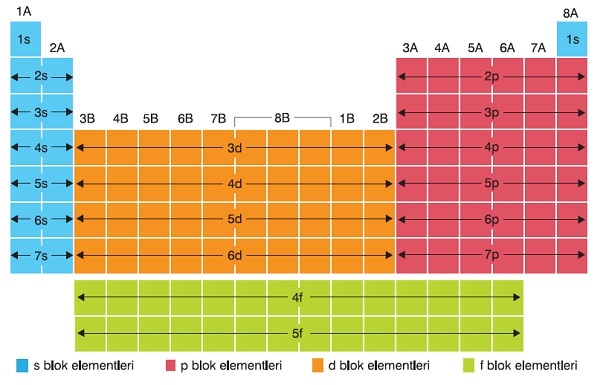
- Orbital diziliminden grup bulmak istediğimizde, atomun son orbitaline bakmalıyız. Atomun grup numarası ile ilgili bütün bilgi bu orbitaldedir.
- Son orbitali s olan bir atomun grup numarası ya 1A ya da 2A’dır:
- s1 : 1A grubu
- s2 : 2A grubu
- Son orbitali p olan bir atomun grup numarası, 3A-8A arasındadır. p orbitalinin elektron sayısına 2 eklersek, atomun kaç A grubunda olduğu ortaya çıkar:
- p1 : 3A grubu
- p2 : 4A grubu
- p3 : 5A grubu
- p4 : 6A grubu
- p5 : 7A grubu
- p6 : 8A grubu
- Son orbitali d olan bir atom, 1B – 8B gruplarından birinde yaşıyordur, yani bir geçiş metalidir. Genel olarak d orbitalinin elektron sayısına 2 eklersek atomun kaç B grubunda yaşadığını buluruz.
- d1 : 3B grubu
- d2 : 4B grubu
- d3 : 5B grubu
- d4 : 6B grubu (4s13d5 ile biter)
- d5 : 7B grubu
- d6 : 8B grubu (birincisi)
- d7 : 8B grubu (ikincisi)
- d8 : 8B grubu (üçüncüsü)
- d9 : 1B grubu (4s13d10 ile biter)
- d10 : 2B grubu
- Son orbitali s olan bir atomun grup numarası ya 1A ya da 2A’dır:
- Son orbitali f olan bir atom ya Lantanittir ya da Aktinit. Hangisi olduğunu, atomun periyot numarasına bakarak analarız.
- Lantanitler 6 periyotta
- Aktinitler ise 7. periyotta bulunurlar.
Bu bir reklamdır:
Örnek:
Aşağıdaki elementlerin periyodik sistemdeki grup ve periyotlarını bulunuz.
a) 13Al
b) 20Ca
c) 25Mn
d) 30Zn

Elif says:
Konu anlatımınız çok iyi hocam. Teşekkür ederiz. 😊