Modern Atom Teorisi → 2. Bölüm
İçindekiler
- 2. Periyodik Sistem ve Elektron Dizilimleri
- Periyodik Sistem ve Elektron Dizilimleri
- Periyodik Sistem ve Elektron Dizilimleri
- Periyodik Sistem ve Elektron Dizilimleri
- Periyodik Sistem ve Elektron Dizilimleri
- Periyodik Sistem ve Elektron Dizilimleri
- Periyodik Sistem ve Elektron Dizilimleri
- Periyodik Sistem ve Elektron Dizilimleri
- Periyodik Sistem ve Elektron Dizilimleri
- Periyodik Sistem ve Elektron Dizilimleri
DERS
AYT Kimya
Kimya 11
KONU
ÜNİTE I
MODERN
ATOM
TEORİSİ
II. Bölüm
2. Periyodik Sistem ve Elektron Dizilimleri
Dersin Özellikleri:
- Seviye: Hiç Bilmeyenler İçin
- Süre: 40 dakika
- Gerekli Bilgiler:
- Atom ve Periyodik Sistem
- Öğretmen:
- Gökalp AY
Anlatılacak Başlıklar*:
- Periyodik Sistem ve Elektron Dizilimleri
- Elektron Dizilimleri
- Elektron Dizilimleri ile Periyodik Tablodaki Blokların İlişkisi
* Konu anlatımı, örneklerle zenginleştirilmiştir.
Periyodik Sistem ve Elektron Dizilimleri
Elektron Dizilimleri
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14…
- Atomların elektron dağılımları yapılırken, orbital sırasına göre doldura doldura gidilir.
- Yukarıda verilen orbital dizilimi bütün atomlarda aynıdır ve şu kurallar ile elde edilmiştir:
- Hund Kuralı
- Pauli İlkesi
- Aufbau Prensibi
Örnek:
X27 atomunun orbital dizilimini yaparak, tam ve yarı dolu orbital sayısını bulunuz?
Örneğin çözümü:
X27: 1s2 2s2 2p6 3s2 3p6 4s2 3d7
Tam ve yarı dolu orbital sayısını bulmak için, farklı yollara baş vurabiliriz:
Birinci yol: Üşenmeden, X27 atomunun bütün orbital gruplarındaki kardeş orbitalleri gösteririz:
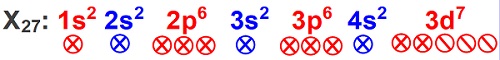
Sayarsak, toplam 12 tane orbitalin tam dolu, 3 tanesinin yarı dolu olduğunu görürüz.
İkinci yol: Basit bir hesap yaparız.
Orbital dağılımına baktığımızda, X27 atomunun 3d7 orbitaline kadar bütün orbitalleri tam doludur. 3d7 orbitaline gelene kadar 20 elektron bulunur. Yani bu atomun 20 elektronu tam dolu orbitallere yerleşmiş, 7 elektronu 3d orbitallerine yerleşmiştir.
Tam dolu orbitallerde 2’şer elektron bulunur. Yani 20 elektron, 10 tane tam dolu orbital demektir.
d7 demek, 5 tane kardeş d orbitaline 7 tane elektron yerleştirmek demektir. Hund Kuralına göre bu orbitallerin 3 tanesi yarı dolu 2 tanesi tam dolu olmalıdır.

Toplamda, X27 atomunda, 12 tane tam, 3 tane yarı dolu orbital vardır.
Bu cevabın sağlaması da şudur: (12 x 2) + 3 = 27 elektron
Periyodik Sistem ve Elektron Dizilimleri
İyonlarda Orbital Dizilimi
- Anyonlarda (eksi iyonlarda):
- Elektron sayısı bulunur ve elektronlar orbitallere dağıtılır.
Örnek:
17 Cl 1- 18 1s2 2s2 2p6 3s2 3p6
8 O 2- 10 1s2 2s2 2p6
- Katyonlarda (artı iyonlarda):
- Kopan elektronlar, son yörüngenin son orbitalinden başlayarak kopar.
- Proton sayısı 21-30 arası olan katyonlara dikkat: Elektron önce 4s2 den kopar.
- Bu katyonların önce nötr hallerini yazıp elektronları oradan kopartırız.
- Proton sayısı 21-30 arası olan katyonlara dikkat: Elektron önce 4s2 den kopar.
- Kopan elektronlar, son yörüngenin son orbitalinden başlayarak kopar.
Örnek:
17 Cl 3+ 14 1s2 2s2 2p6 3s2 3p2
26 Fe 2+ 24 1s2 2s2 2p6 3s2 3p6 3d6
26 Fe 3+ 23 1s2 2s2 2p6 3s2 3p6 3d5
Periyodik Sistem ve Elektron Dizilimleri
Soygazlar Yardımı İle Orbital Dizilimi
- Bir atomun orbital dağılımı, o atomdan önceki ilk soygaz yardımı ile de yapılabilir.
- Soygazların elektron dağılımları:
- 2He: 1s2
- 10Ne: 1s2 2s2 2p6
- 18Ar: 1s2 2s2 2p6 3s2 3p6
- 36Kr: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
Örnek:
6C: 1s2 2s2 2p2
6C: [He] 2s2 2p2
Örnek:
16S: 1s2 2s2 2p6 3s2 3p4
16S: [Ne] 3s2 3p4
Periyodik Sistem ve Elektron Dizilimleri
Küresel Simetri
- En son orbitali tam dolu veya yarı dolu olan atom ya da iyonlar küresel simetriktir.
- Küresel simetrik atom ya da iyonlar kararlıdır.
- Soygazların hepsi tam küresel simetriktir.
- Son orbital yarı doluysa yarı küresel simetri vardır:
- s1
- p3
- d5
- f7
Örnek:
1H: 1s1
7N: 1s2 2s2 2p3
25Mn: 1s2 2s2 2p6 3s2 3p6 4s2 3d5
- Son orbital tam doluysa tam küresel simetri vardır:
- s2
- p6
- d10
- f14
Örnek:
2He: 1s2
10Ne: 1s2 2s2 2p6
30Zn: 1s2 2s2 2p6 3s2 3p6 4s2 3d10
Periyodik Sistem ve Elektron Dizilimleri
1B ve 6B Gruplarında Özel Durum (d4-d9 Kuralı)
- 1B grubu:
- Bu gruptaki atomların, temel halde iken d9 ile bitmesi gerekirken d10 ile biterler.
Örnek:
29Cu: 1s2 2s2 2p6 3s2 3p6 4s2 3d9 – YANLIŞ
29Cu: 1s2 2s2 2p6 3s2 3p6 4s1 3d10 – DOĞRU
- 6B grubu:
- Bu gruptaki atomların, temel halde iken d4 ile bitmesi gerekirken d5 ile biterler.
Örnek:
24Cr: 1s2 2s2 2p6 3s2 3p6 4s2 3d4 – YANLIŞ
24Cr: 1s2 2s2 2p6 3s2 3p6 4s1 3d5 – DOĞRU
Periyodik Sistem ve Elektron Dizilimleri
İzoelektronik Atomlar
İzoelektronik Atomlar
- Hem elektron sayıları ve orbital düzenleri aynı olan atomlara izoelektronik atomlar denir.
- Proton sayıları farklıdır.
Örnek:
Aşağıda verilen atomlar izoelektronik atomlardır.
11Na+: 1s2 2s2 2p6
10Ne: 1s2 2s2 2p6
Periyodik Sistem ve Elektron Dizilimleri
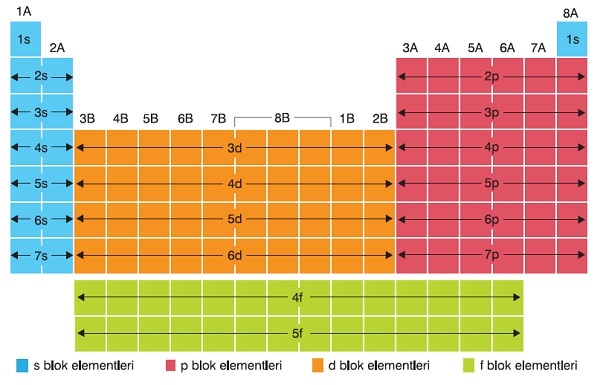
Elektron Dizilimleri ile Periyodik Tablodaki Blok İlişkisi
- Periyodik sistem 4 tane bloktan oluşur. Bunlar:
- s bloğu
- p bloğu
- d bloğu
- f bloğu
- Bir atomun temel haline ait elektron diziliminde, son orbitali bloğunu gösterir.
Periyodik Sistem ve Elektron Dizilimleri
Orbital Dizilimi ile Grup ve Periyot Bulma
Periyot Bulma
- En son yörüngenin numarası, periyot numarasıdır.
Örnek:
18Ar : 1s2 2s2 2p6 3s2 3p6 (3. periyot)
8O : 1s2 2s2 2p4 (2. periyot)
25Mn : 1s2 2s2 2p6 3s2 3p6 4s2 3d5 (4. periyot)
35Br : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 (4. periyot)
Grup Bulma
- Grup numarasını atomun son orbitali belirler. Son orbitale göre grup şöyle bulunur:
- sn ise : nA grubu
- pn ise: sondaki p ve bir önceki s elektronlarının toplamı kadar A grubu
- dn ise: sondaki d ve bir önceki s elektronlarının toplamı kadar B grubu
- Toplam 8, 9, 10 ise 8B
- Toplam 11 ise 1B
- Toplam 12 ise 2B grubudur.
Örnek:
11Na : 1s2 2s2 2p6 3s1 (3. periyot 1A)
25Mn : 1s2 2s2 2p6 3s2 3p6 4s2 3d5 (4. periyot, 7B)
13Al : 1s2 2s2 2p6 3s2 3p1 (3. periyot 3A)
Periyodik Sistem ve Elektron Dizilimleri
Değerlik Orbitalleri ve Değerlik Elektron Sayısı
- Son yörüngedeki orbitallere atomun değerlik orbitalleri denir.
- En sondaki d orbitalleri her zaman değerlik orbitallerine dahil edilir.
- Değerlik orbitallerindeki elektron sayısına, değerlik elektron sayısı denir.
- Genellikle grup numarasına eşittir.
- Değerlik elektron sayısı eşit olan atomların kimyasal özellikleri benzerdir.
Örnek:
17Cl, 8O, 6C, 26Fe, 22Ti, 29Cu atomlarının;
I) Grup ve periyotlarını bulunuz.
II) Değerlik orbitallerini ve değerlik elektron sayılarını belirtiniz.

Modern Atom Teorisi
II. Bölüm
(Periyodik Sistem ve Elektron Dizilimleri)
Bitti 🙁