İçindekiler
- Periyodik özellikler, periyodik sistemde, belli bir yöne doğru giderken, artma ya da azalma eğiliminde olan özelliklerdir.
- Periyodik özellikler olarak inceleyeceğimiz özellikler şunlardır:
- Atom yarıçapı eğilimi
- İyonlaşma enerjisi (İ.E.) eğilimi
- Elektron ilgisi (E.İ.) eğilimi
- Elektronegatiflik eğilimi
- Oksit/hidroksit bileşiklerinin asitlik/bazlık eğilimleri
Gelin bu özellikleri yakından tanıyalım.
1. Atom Yarıçapı Eğilimi
- Modern Atom Teorisi bize, elektronların orbitallerde yaşadığını söyler. Orbitaller ise elektronların bulunma olasılığının yüksek olduğu bölgelerdir ve kesin olarak sınırları belli değildir. Bu yüzden, atomun, da sınırları kesin olarak belli değildir.
- Sınırları belli olmayan bir atomun yarıçapını hesaplamak da mümkün değildir. Bu yüzden, atomların yarıçapını hesaplamak için, birbirine bağlanmış iki atomun çekirdekleri arasındaki mesafe ölçülür.
- Çekirdekleri arasındaki mesafe yardımı ile 3 farklı yarıçap ölçülür. Bunlar şunlardır:
- Atom yarıçapı
- Kovalent yarıçap
- Van der Waals yarıçapı
1. Atom Yarıçapı Nedir?
- Atom yarıçapı, katı haldeki metal atomlarının çekirdekleri arasındaki mesafenin yarısıdır.
- Metal atomları katı halde iken, metalik bağlar ile bağlıdır.

Yukarıda, metalik bağ ile bağlanmış 2 adet Cu (Bakır) atomunun çekirdekleri arasındaki mesafenin 256 pm (pikometre) olduğunu görüyoruz. Bu uzunluğun yarısı, 128 pm yapar ve bu değer bir Cu atomunun atom yarıçapı olarak kabul edilir.
2. Kovalent Yarıçap
- Kovalent yarıçap, kovalent bağ kurmuş, iki ametal atomunun çekirdekleri arasındaki mesafenin yarısıdır.
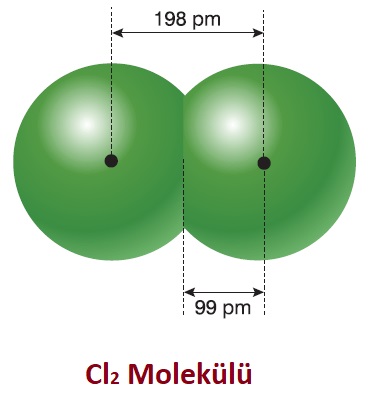
Yukarıda, kovalent bağ ile bağlanmış 2 adet Cl (Klor) atomunun çekirdekleri arasındaki mesafenin 198 pm (pikometre) olduğunu görüyoruz. Bu uzunluğun yarısı, 99 pm yapar ve bu değer bir Cl atomunun kovalent yarıçapı olarak kabul edilir.
3. Van der Waals Yarıçapı
- Van der Waals yarıçapı, London Kuvvetleri ile bağlanmış ve katı haldeki iki atomunun çekirdekleri arasındaki mesafenin yarısıdır.
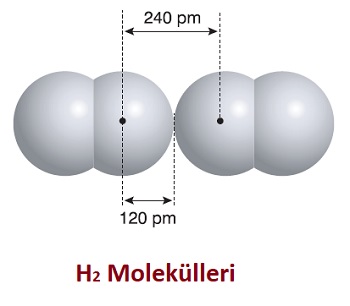
Yukarıdaki resimde, katı halde olan yani birbirine çok yaklaşmış iki tane H2 molekülü verilmiştir. Bu iki molekülde, London Kuvvetleri ile bağlanmış, iki Hidrojen atomunun çekirdekleri arasındaki mesafe 240 pm (pikometre) olarak ölçülmüştür. Bu uzunluğun yarısı, 120 pm yapar ve bu değer bir H atomunun van der Waals yarıçapı olarak kabul edilir.
Farklı Atomların Yarıçaplarına Göre Sıralanması
- Atomları yarıçaplarına göre sıralarken uymamız gereken üç temel kural vardır. Bu kurallar şunlardır:
- Atomlardan, yörünge sayısı daha fazla olan atom her zaman daha şişmandır, yani yarıçapı daha büyüktür.
- Atomların yörünge sayıları aynı ise, proton sayısı küçük olan atom her zaman daha şişmandır.
- Proton sayıları da eşitse, elektron sayısı çok olanın atom yarıçapı daha büyüktür.
- Kurallardan da anlaşılacağı üzere; çap sorularında önce, atomların elektron dağılımını yapmamız gerekiyor.
- Yarıçapı daha büyük olan atomların, atom çapı ve atom hacmi de daha büyüktür.
Örnek:
16S, 10Ne ve 5B atomlarının hacimlerini, büyükten küçüğe doğru sıralayınız.
Cevap
Örneğin çözümü:
Periyodik Sistemde Atom Yarıçapı
Aynı gruptaki atomların yarıçapları:

- Periyodik sistemin aynı grubunda, daha aşağıda bulunan atomlar her zaman daha şişmandır.
- Çünkü; aşağıya doğru inildikçe atomların yörünge sayısı artar.
Aynı periyottaki atomların çapları:

- Aynı periyotta, grup numarası arttıkça (sağa doğru) atom çapı küçülür.
- Çünkü; sağa doğru gidildikçe proton sayısı artar.
- Periyodik sistemde, sola ve aşağı doğru gidildikçe, atom çapı artacaktır.
- Fr (Fransiyum) atomu; en solda ve en aşağıdaki atomdur. Bu yüzden en şişman atom budur.

Aynı periyotta bulunan atomların yörünge sayıları aynıdır. Bu yüzden aynı periyottaki atomların çaplarını proton sayılarına göre kıyaslarız. Proton sayısı da, sola doğru (grup numarası küçüldükçe) azalır. Bu yüzden bir periyotta, grup numarası azaldıkça atom çapı büyür.
İyon Çapı
- Elektron alan bir atom, kilo almış gibi şişmanlar ve çapı artar.
- Elektron veren atom da kilo vermiş gibi zayıflar ve çapı azalır.
Örnek:
X, X+3, X-1 atom ve iyonlarının çaplarını kıyaslayınız.
Cevap
Örneğin çözümü:
2. İyonlaşma Enerjisi (İ.E.) Eğilimi
- Yeterli paranız pardon enerjiniz varsa, bir atomdan bütün elektronlarını satın alabilirsiniz pardon kopartabilirsiniz.
- Yapmanız gereken tek şey, her elektronu için atomun istediği enerjiyi atoma vermektir.
- İyonlaşma enerjisinin tanımı şudur:
- Gaz hâlinde ve nötür bir atomdan bir elektron koparmak için atoma verilmesi gereken enerjiye 1. iyonlaşma enerjisi denir.
- 1. iyonlaşma enerjisi (1.İ.E.) şu tepkime ile de verilebilir:
X(g) + 130 kj/mol → X(g)+1 + 1e– - 2. iyonlaşma enerjisi (2.İ.E.) şu tepkime ile de verilebilir:
X(g)+1 + 296 kj/mol → X(g)+2 + 1e– - 3. iyonlaşma enerjisi (3.İ.E) şu tepkime ile de verilebilir:
X(g)+2 + 517 kj/mol → X(g)+3 + 1e– - …
- Elektronlar atomun yörüngelerine, birinci yörüngeden itibaren yerleştirilirken, sonuncu yörüngeden itibaren kopartılır.
- Yani nötür bir atomdan elektronlarını istediğinizde, size son yörüngesindeki elektronlardan başlayarak verecektir.
- Bir atomun kaç tane elektronu varsa o kadar iyonlaşma enerjisi vardır.
- Yeterli enerjiyi verirsek atomdan bütün elektronlarını koparabiliriz.
- Bütün elektronlarını koparırsak atom, plazma haline geçer.
Örnek:
X(g)+1 + 2670 kj/mol → X(g)+4 + 3e–
Yukarıdaki tepkimede görülen 2670 kj/mol değerindeki enerji, atomun kaçıncı iyonlaşma enerjisidir?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Bir Atomun İyonlaşma Enerjileri Arasındaki İlişki
- Bir atomdan elektron koparırken, her zaman bir sonraki elektronu daha zor kopartırız.
- Yani her zaman 2. iyonlaşma enerjisi, 1. iyonlaşma enerjisinden daha büyüktür; 3. iyonlaşma enerjisi de 2.’den daha büyüktür…
- Mesela; Bor (B) atomunun 5 tane elektronu olduğundan, 5 tane iyonlaşma enerjisi vardır ve en büyükleri 5. iyonlaşma enerjisidir.
1.İ.E. < 2. İ.E. < 3. İ.E. < 4. İ.E. < 5. İ.E.
- Bir atomlardan, elektron kopardıkça atomda şunlar değişir:
- Atomun elektron sayısı azalır.
- Atomun çapı küçülür.
- Geriye kalan elektronlar çekirdeğe yaklaşır.
- Geriye kalan elektronlar çekirdeğin çekim gücünü daha çok hissederler.
- Bu yüzden, sonraki elektron daha zor kopar ve iyonlaşma enerjisi daha yüksek bir değer alır.
Üç Buçuk (3.5) Kat Kuralı
- Bir sonraki iyonlaşma enerjisi, en az 3.5 kat daha yüksek ise, atomun son yörüngesindeki son elektronu kopartıyoruz demektir.
- Yani; 3.5 katlık artıştan önce, kaç tane iyonlaşma enerjisi varsa, atomun son yörüngesinde o kadar tane elektron var demektir.
Örnek:
Aşağıdaki tabloda, bazı atomların iyonlaşma enerjileri verilmiştir.
| Atom | 1. İ.E. (kj/mol) | 2. İ.E. (kj/mol) | 3. İ.E. (kj/mol) | 4. İ.E. (kj/mol) |
|---|---|---|---|---|
| X | 1312 | – | – | – |
| Y | 2372 | 5298 | 11850 | – |
| Z | 577 | 1816 | 2744 | 11577 |
| T | 520 | 7298 | 11815 | 15577 |
| Q | 453 | 798 | 915 | 1577 |
Buna göre, bu atomların grup numaraları için neler söylenebilir?
Cevap
Örneğin çözümü:
Atomların İyonlaşma Enerjilerine Göre Sıralanması
- Elektron dağılımına bakarak, iyonlaşma enerjilerini, sırasıyla şu kurallara göre sıralarız:
- Değerlik elektron sayısı (yani son yörüngedeki elektron sayısı) daha fazla olan atom ya da iyonun iyonlaşma enerjisi daha büyüktür, elektronu daha zor kopar.
- Değerlik elektron sayıları eşit olan atom ya da iyonlardan çapı küçük olanın iyonlaşma enerjisi daha büyüktür.
Örnek:
12Mg, 20Ca ve 10Ne atomlarının 1. ve 3. iyonlaşma enerjilerini kıyaslayınız.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Aynı Periyotta Birinci İyonlaşma Enerjisi
- İyonlaşma enerjisi kurallarına göre, aynı periyotta, 1A grubundan 8A grubuna doğru gidildikçe 1. iyonlaşma enerjisinin artması gerekir:
1A < 2A < 3A < 4A < 5A < 6A < 7A < 8A
- Fakat; gerçek sıralamada 3A grubu bir aşağı inmiş, 5A grubu bir yukarı çıkmıştır (3 aşağı 5 yukarı kuralı). Yani gerçekte, aynı periyotta, 1. iyonlaşma enerjisi sıralaması şöyledir:
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A
- Bu kuralı, grafik üzerinde de görmek için periyodik sistemdeki ilk 20 atomun Proton sayısına karşılık 1. İyonlaşma enerjisi grafiğine bakalım. Grafik şöyledir:

Periyodik Sistemde İyonlaşma Enerjisi

- Periyodik sistemde, iyonlaşma enerjisi, sağa ve yukarı doğru artar.
- İyonlaşma enerjisi en yüksek olan atom Helyum (He) atomudur (1. periyot, 8A grubu).
3. Elektron İlgisi (Eİ) Eğilimi
- Elektron ilgisinde mantık, iyonlaşma enerjisinin tam tersidir.
- İyonlaşma enerjisinde atoma enerji verip elektronunu koparıyorduk, Elektron ilgisinde ise atoma elektron verip karşılığında enerji alacağız.
- Tanım: Gaz hâlindeki nötr bir atomun elektron alarak negatif yüklü iyon oluşturması sırasındaki enerji değişimine elektron ilgisi denir ve E.İ. ile gösterilir.
- Elektron alırken, dışarıya daha çok enerji veren atomların elektron ilgisi daha büyüktür.
- Aşağıdaki tepkimelerden anlıyoruz ki, X atomunun elektron ilgisi daha büyüktür:
X(g) + e– → X(g)-1 + 235 kj/mol
Y(g) + e– → Y(g)-1 + 75 kj/mol
- Soy gazların elektron ilgileri çok düşük hatta sıfıra yakındır.
- Ametallerin elektron ilgileri çok yüksektir.
- Metaller elektron almaya değil de vermeye ilgi duydukları için, metallerin de elektron ilgisi düşüktür.
Bu bir reklamdır:
Periyodik Sistemde Elektron İlgisi
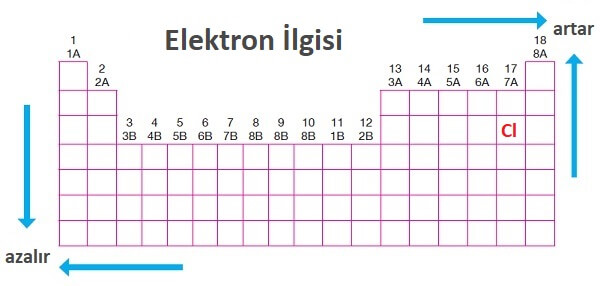
- Periyodik sistemde, sağa ve yukarıya doğru gidildikçe elektron ilgisi artar.
- Elektron ilgisi ametalik bir özelliktir.
- Periyodik sistemde, aynı periyotta soldan sağa doğru gidildikçe elektron ilgisi genellikle artar.
- Aynı grupta yukarıdan aşağıya inildikçe elektron ilgisi genellikle azalır.
- Elektron ilgisi en büyük olan atom Klorun (Cl) atomudur.
4. Elektronegatiflik (En) Eğilimi
- “Elektronegatiflik” kavramı bazen karşımıza “elektronegetivite” veya “eksiçekerlik” olarak da çıkabilir.
- Elektronegatiflik, tıpkı elektron ilgisi gibi ametallerin daha üstün olduğu bir özelliktir.
- Tanım: Bir atomun, kovalent bağ elektronlarını kendine doğru çekme gücüne elektronegatiflik denir.
- Periyodik sistemde, elektronegativitesi en yüksek olan atom Flor (F) atomudur.
- Flor atomunun elektornegatiflik değeri keyfi olarak 4.0 kabul edilmiştir.
- Diğer atomların gücü hep Flor ile kıyaslanmış ve ona göre birer elektronegatiflik değeri verilmiştir.
- Mesela; bir atomun elektronegatiflik gücü Flor atomunun yarısı kadar ise bu atomun elektronegatifliği 2.0 olmuştur.
- Periyodik sistemde elektronegatifliği en büyük üç element sırası ile flor (F), oksijen (O) ve azottur (N).
- Elektronegatiflik değerlerinin bir birimi yoktur.
- Soygazların bağ kurma yetenekleri olmadığı için elektronegatiflik değerleri de çok düşüktür.
Bu bir reklamdır:
Periyodik Sistemde Elektronegatiflik

- Periyodik sistemde 2. periyot, 7A grubu atomu olan Flor atomunun elektronegatiflik değeri en büyüktür. Bu yüzden periyodik sistemde, sağa ve yukarı doğru gidildikçe atomların elektronegatiflik değerleri artar.
5. Metalik – Ametalik Aktiflik
- Bir elementin atomları ne kadar kolay elektron veriyorsa o element o kadar güzel bir metaldir. Bu yüzden, metal atomlarının, iyonlaşma enerjileri ve elektron ilgileri düşüktür.
- Ametallerde durum tam tersidir. Yani ametaller, elektron ilgisi, elektronegatifliği, iyonlaşma enerjisi yüksek olan elementlerdir.
Periyodik Sistemde Metalik-Ametalik Özellik
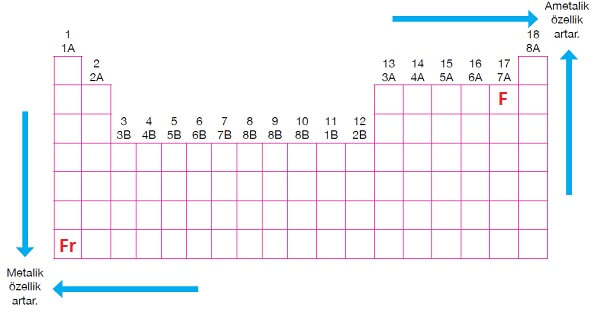
- Fr (Fransiyum) metali, metallere özgü özellikleri en yüksek seviyede gösteren elementtir. Yani en iyi metaldir.
- Periyodik sistemde Fransiyuma daha yakın olan elementlerin metalik karakterleri daha iyi olacaktır.
- F (Flor) ametali de, ametallere özgü özellikleri en yüksek seviyede gösteren elementtir. Yani en iyi ametaldir.
- Periyodik sistemde Flora daha yakın olan elementlerin ametalik karakterleri daha iyi olacaktır.
6. Oksit/Hidroksit Bileşiklerinin Asitlik ve Bazlık Özellikleri
Oksit Bileşikleri
- Herhangi bir elementin oksijen ile yaptığı bileşiğe oksit bileşiği denir.
- Oksit bileşiklerinde yalnız iki çeşit element olur; bu iki elementten biri her zaman oksijendir.
Aşağıda bazı oksit bileşikleri verimiştir:
- CaO (Kalsiyum oksit)
- Na2O (Sodyum oksit)
- CO2 (Karbon dioksit)
- SO2 (Kükürt dioksit)
- N2O5 (Diazot pentaoksit)
Örnek:
I) Fe2O3
II) HNO3
III) H2O
Yukarıda verilenlerden hangileri bir oksit bileşiğidir?
A) Yalnız I
B) Yalnız II
C) Yalnız III
D) I ve III
E) I, II ve III
Cevap
Örneğin çözümü:
Bazik Oksitler
- Metallerin oksitleri bazik oksitlerdir.
- Bazik oksitlere “susuz bazlar” da denir.
- Suyla tepkimeye girerek bazları oluştururlar.
- Bazik oksitler, bazlar gibi, suya OH– iyonu verirler.
- Ca ve Na elementleri metal oldukları için; CaO ve Na2O oksitleri baziktir ve suya hidroksil iyonu verirler. Suda çözünme tepkimeleri şöyledir:
CaO(k) + H2O(s) → Ca2+(suda) + 2OH–(suda)
Na2O(k) + H2O(s) → 2Na+(suda) + 2OH–(suda)
- Bazik oksitler, bazlar gibi davranırlar.
- Bazik oksitler, asitlerle tepkimeye girerek tuz ve su oluştururlar.
Asidik Oksitler
- Ametallerin, oksijeni daha fazla olan oksitleri asidiktir. Yani asidik oksitlerin molekül formüllerinde, oksijen sayısı ametal sayısından fazla olmalıdır.
- “Susuz asitler” olarak da bilinirler.
- Suyla tepkimeye girerek, asitleri oluştururlar.
- Asitler gibi suya H+ iyonu verirler.
Aşağıda, asidik oksitlere örnekler verilmiştir:
- CO2 (Karbon dioksit)
- SO2 (Kükürt dioksit)
- N2O5 (Diazot pentaoksit)
(Oksijen sayısı, ametalin sayısından fazla olduğu için, bu oksitlerin hepsi asidik özellik gösterir.)
Suda çözünme tepkimeleri şöyledir:
CO2(g) + H2O(s) → 2H+(suda) + CO32-(suda)
SO2(g) + H2O(s) → 2H+(suda) + SO32-(suda)
N2O5(g) + H2O(s) → 2H+(suda) + 2NO3–(suda)
- Asidik oksitler, asitler gibi davranırlar.
- Asidik oksitler, bazlarla tepkimeye girerek tuz ve su oluştururlar.
Nötür Oksitler
- Nötür oksitler de tıpkı asidik oksitler gibi ametallerin oksitleridir.
- Fakat; nötür oksitlerde, oksijen sayısı ametal sayısından fazla değildir. Oksijen sayısı ya ametal sayısına eşit ya da daha azdır.
Aşağıda nötür oksitlere örnekler verilmiştir:
- CO (Karbon monoksit)
- NO (Azot monoksit)
- N2O (Diazot monoksit)
- Nötür oksitler, asit ya da baz özelliği göstermezler.
- Asit ya da bazlarla ya da suyla tepkimeye girmezler.
Amfoter Oksitler
- Bir madde amfoter ise, o madde hem asidik hem de bazik özellik gösteriyor demektir.
- Amfoter oksitler de, hem asidik hem bazik özellik gösteren oksitlerdir.
- Su bir amfoter oksittir.
- Amfoter metallerin oksitleri, amfoter oksittir.
- Amfoter metaller şunlardır:
- Al (Alüminyum)
- Cr (Krom)
- Pb (Kurşun)
- Sn (Kalay)
- Zn (Çinko)
- Be (Berilyum)
- Amfoter oksitleri şöyle ezberleyebilirsiniz: Ali Cerenin Pabucunu Seninki Zannetti Betül
- Amfoter oksitler şunlardır:
- Al2O3 (Alüminyum oksit)
- Cr2O3 (Krom -III- oksit)
- PbO2 (Kurşun -IV- oksit)
- SnO2 (Kalay -IV- oksit)
- ZnO (Çinko oksit)
- BeO (Berilyum oksit)
- Amfoter oksitler; asitlerle ve bazlarla tepkimeye girerler.
- Amfoter oksitler; suyla tepkimeye girmezler.
Hidroksit Bileşikleri
OH– : Hidroksit (Hidroksil de denir.)
- Hidroksit iyonu içeren bileşiklere, “hidroksit bileşikleri” denir.
- Hidroksit bileşiklerinde genellikle, OH– iyonu bir metalle bileşik oluşturmuştur.
- Hidroksit bileşiklerinden bazı örnekler şunlardır:
- NaOH : Sodyum hidroksit
- KOH : Potasyum hidroksit
- Mg(OH)2 : Magnezyum hidroksit
- Be(OH)2 : Berilyum hidroksit
- Al(OH)3 : Alüminyum hidroksit
Hidroksit Bileşiklerinin Özellikleri
- 1A ve 2A grubu metallerinin hidroksit bileşikleri kuvvetli bazlardır.
- 1A : H, Li, Na, K, Rb, Cs, Fr
- 2A : Be, Mg, Ca, Sr, Ba, Ra
- Hidroksit bileşiklerindeki metal ne kadar aktif ise, bileşik o kadar kuvvetli bir bazdır.
- Fe(OH)2, Cu(OH)2 gibi B grubu metallerinin hidroksit bileşikleri, genellikle zayıf bazlardır.

1 yorum: “3. Periyodik Özellikler”