İçindekiler
- Basit Formül ve Molekül Formülü, aynı bileşiğin iki farklı formülüdür. Çünkü; molekül formüllerini göstermek için geliştirilmiş farklı modeller vardır.
Organik Bileşiklerin Formülleri
- Bileşiklerin formüllerini yazmanın sadece bir tane yolu yoktur.
- Aynı bileşiğin formülünü, farklı şekillerde göstermek mümkündür.
- Özellikle organik bileşiklerde, molekülleri daha detaylı olarak görmek isteriz. Bunun için de farklı formüllerden yararlanırız.
- Molekül formüllerini göstermek için kullanılan başlıca formül türleri şunlardır:
- Molekül Formülü
- Basit Formül ( Kaba veya Ampirik formül de denir.)
- Açık Formül
- Yarı Açık Formül
- Çizgi-Bağ (İskelet) Formülü
Gelin bu formülleri, daha yakından tanıyalım.
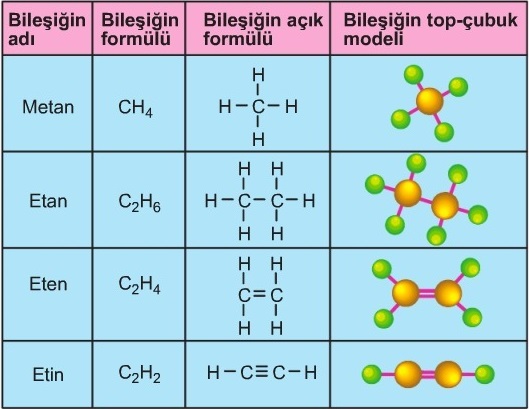
1. Molekül Formülü
- Molekül formülü; kovalent bağlı bileşikler için, bu güne kadar kullandığımız formüllerdir.
- Kovalent bağlar ile birbirine bağlanmış atomlara molekül diyoruz. Kovalent bağlı bileşikler, moleküllerden oluşan bileşiklerdir, yani; moleküler bileşiklerdir.
- Bir bileşiğin molekülünün formülü aynı zamanda o bileşiğin de formülüdür.
- Molekül formüllerinde, şunlar vardır:
- Bir tane molekülde bulunan atomların sembolleri yer alır.
- Moleküldeki her bir atomun sayısı, sembolünün sağ-alt köşesine yazılır.
- Aşağıda bazı bileşiklerin molekül formülleri verilmiştir:
- H2O (Su)
- CH4 (Metan)
- C2H2 (Asetilen)
- C2H6 (Etan)
- C4H10 (Bütan)
- C2H5OH (Etil alkol)
Bu bir reklamdır:
2. Basit Formül
- Basit formüle; “Ampirik formül” veya “Kaba formül” de denir.
- Basit formül; kovalent bağlı bileşiklerin molekül formüllerinin sadeleştirilmesi ile elde edilir.
- Bileşiklerin basit formüllerinin özellikleri şunlardır:
- Moleküldeki atomların sembollerinden oluşur.
- Moleküldeki atomların sayıları sadeleştirilmiş olarak yer alır.
- Molekül formülünün kaç ile sadeleştiği bilinmiyorsa, basit formülden, molekül formülüne ulaşılamaz.
- Basit formüldeki bütün oranlar, molekül formülündeki oranlar ile aynıdır. (Sadeleşen sayıların oranı değişmez.)
- Farklı bileşiklerin basit formülleri aynı da olabilir.
- Bir bileşiğin; molekül formülü ile basit formülü aynı olabilir.
Aşağıda, bazı bileşiklerin molekül formülleri ve basit formülleri verilmiştir:

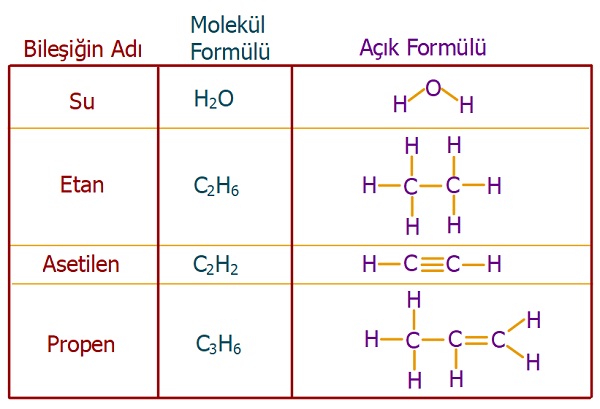
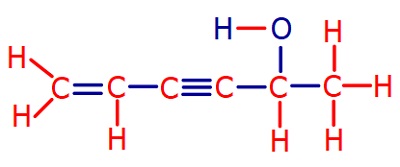
3. Açık Formül (Yapı Formülü)
- Açık formülde, moleküldeki atomların yaptıkları kovalent bağlar da gösterilir.
- Kovalent bağ; atomların arasına çizilen kısa bir çizgi ile (“―“) gösterilir.
- Aşağıda, bazı bileşikler ve açık formülleri verilmiştir.
Bu bir reklamdır:
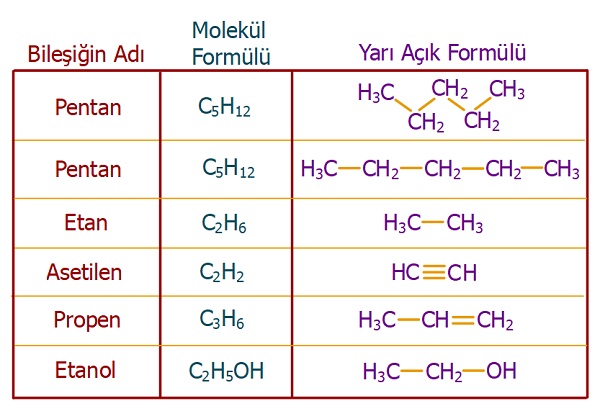
4. Yarı Açık Formül
- Organik bileşiklerde bol bol karbon ve hidrojen atomu vardır.
- Hidrojenler, bütün organik bileşiklerde, karbon atomu ile tek bir kovalent bağ yapar:
C―H- Bu yüzden, organik bileşiklerin açık formüllerinde, C―H bağını göstermek biraz vakit ve yer kaybı gibi olur.
- Bu yüzden, yarı açık formüller geliştirilmiştir.
- Yarı açık formüllerde, C―H bağı veya O―H bağı, gibi H atomunun bağları açık olarak gösterilmez, buna gerek duyulmaz.
Aşağıda, bazı bileşikler ve yarı açık formülleri verilmiştir:
- Yarı açık formül, bazen molekül formülü ile birleştirilir ve tekli bağ yapmış ve ardışık C atomları arasındaki bağlar gösterilmez.
- Aşağıda bu durumun örnekleri verilmiştir.

Bu bir reklamdır:
5. Çizgi-Bağ (İskelet) Formülü
- Çizgi-bağ formülleri, organik moleküllerdeki atomların bağ yapısını basit bir şekilde gösteren formüllerdir.
- Bir nevi, organik moleküllerin röntgeninin çekilmiş ve iskeletinin göründüğü haldir.
- Çizgi-bağ formüllerinde, organik moleküllerin genel kısımları gösterilmez.
- Organik moleküllerin çizgi-bağ formüllerinde aşağıdaki parçalar görünmez:
- C atomları
- C atomlarına bağlı H atomları
- C ile H arasındaki bağlar
- Diğer ametaller ile H arasındaki bağlar
- Çizgi-bağ formüllerinde sadece aşağıdaki unsurlar görünür:
- C atomları arasındaki bağlar
- C ile H dışındaki ametaller arasındaki bağlar.
- C dışındaki ametallere bağlı olan H atomları
- Çizgi-bağ formüllerinde, peş peşe gelen bağlar birer çizgi ile ve zikzaklı çizilir.
- Zikzaktaki her bir düz çizgi bir kovalent bağdır ve bu çizgilerin başında ve sonunda görünmeyen birer C atomu vardır.
Öğretici Örnek:
- Örnek olarak C3H8 bileşiği üzerinden çizgi-bağ formülünü anlamaya çalışalım.
- C3H8 bileşiğinin yapı formülü şöyledir:

- Bu bileşiğin çizgi-bağ formülünü yazmak için, yapı formülünden silmemiz gereken kısımları kırmızı renk ile gösterelim:

- Yukarıda, kırmızı ile gösterilen kısımları silinince geriye kalan kısım, şöyle olur:

- Bu bağları, zikzaklı bir şekilde çizersek, çizgi-bağ formülü tamamlanmış olur:

- C3H8 bileşiğinin yapı formülü şöyledir:
Örnek:

Yukarıda, C6H7OH bileşiğinin yapı formülü verilmiştir.
Buna göre bu bileşiğin, çizgi-bağ formülünü bulunuz.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Öğretici Örnek:
Aşağıdaki örnekleri inceleyiniz:

Formül Bulma Problemleri
Bir organik bileşiğin formülünü bulmanın iki yolu vardır. Bu yollar şunlardır:
- Elementlerin miktarları belli ise:
- Bileşikteki her bir elementin teker teker mol sayısı hesaplanır.
- Hesaplanan mol sayıları genişletilerek/sadeleştirilerek tam sayıya çevrilir.
- Bulunan tam sayılar formülde, elementlerinin altına yazılır.
- Kimyasal tepkime denklemi verilir ya da tarif edilir ise:
- Tepkime denklemi yazılır.
- Tepkimedeki katsayılar tespit edilir.
- Denkleştirme kurallarına göre bileşiğin formülünü bulunur.
Mol kavramı ve denklem denkleştirme ile ilgili sorunlar yaşıyorsanız, aşağıdaki derslere gidebilirsiniz:
Gelin, her iki yöntemi de, örnekler ile anlamaya çalışalım.
Örnek:
Sadece karbon ve hidrojenden oluşan bir bileşiğin 3,2 gramında 2,4 gram C elementi tespit edilmiştir.
Buna göre bu bileşiğin kaba formülü nedir? (C: 12 g/mol, H: 1 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
X + 3O2 → 2CO2 + 3H2O
Yukarıda verilen tepkimeye göre X bileşiğinin formülü nedir?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Karbon ve hidrojenden oluşan bir organik bileşik analiz edildiğinde, kütlece %10 hidrojen elementinden oluştuğu anlaşılıyor.
Bu bileşiğin mol ağırlığının 80 olduğu bilindiğine göre, molekül formülü nedir? (C: 12 g/mol, H: 1 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:

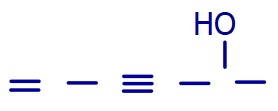
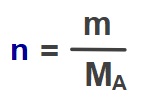
1 yorum: “2. Basit Formül ve Molekül Formülü”