İçindekiler
İdeal Gaz Ne Demektir?
- İdeal gazlar, ideal olan her şey gibi, aslında var olmayan, hayali gazlardır.
- Gerçek Dünya’da veya uzayda ideal bir gaz yoktur.
- Yani; çevremizde gördüğümüz bütün gazlar, “Gerçek Gazlar“dır.
- İdeal gazların özelliklerini şu şekilde sıralayabiliriz:
- Kimyasal türleri esnek çarpışmalar yapar. (Enerji kaybı olmadan çarpışırlar.)
- İdeal gazlar, gaz yasalarına uygun hareket eden gazlardır.
- Kimyasal türleri (atom veya molekülleri) arasında herhangi bir etkileşim yoktur.
- Yani, kimyasal türler birbirinden tamamen bağımsızdır.
- İdeal gazların kimyasal türlerinin hacim kaplamadığı kabul edilir.
- Gerçek dünyada, gazların kimyasal türleri arasında çok az da olsa, bir etkileşim vardır ve gerçek gazlarınkimyasal türleri, az da olsa bir hacim kaplar.
- Gerçek gazlar, aşağıdaki şartlarda, ideale daha yakın davranırlar:
- Yüksek sıcaklık
- Düşük basınç
- Düşük Mol Ağırlığı (MA)
- Gerçek gazlar, aşağıdaki şartlarda, ideale daha yakın davranırlar:
Örnek:
Aşağıdaki gazlardan hangisi ideale daha yakın davranır?
A) 100 oC’de ve 4 atm basınç yapan He gazı
B) 200 oC’de ve 4 atm basınç yapan He gazı
C) 300 oC’de ve 4 atm basınç yapan He gazı
D) 400 oC’de ve 2 atm basınç yapan He gazı
E) 400 oC’de ve 4 atm basınç yapan He gazı
Cevap
Sorunun Çözümü
İdeal Gaz Yasası
İdeal Gaz Yasası şöyledir:
P.V = n.R.T
İdeal Gaz Yasası: “İdeal Gaz Denklemi” olarak da bilinir.
- P: Gaz basıncıdır.
- Birimi atm olmalıdır.
- V: Gaz hacmidir.
- Birimi Litre (L) olmalıdır.
- n: Gazın mol sayısıdır.
- Birimi mol olmalıdır.
- T: Gazın sıcaklığıdır.
- Birimi Kelvin (K) olmalıdır.
- R: İdeal Gaz Sabiti

Matematikteki pi sayısı gibi sabit bir sayıdır.
İdeal Gaz Denkleminin Türetilmesi
Örnek:
İdeal gaz sabitinin (R) birimini bulunuz?
Sorunun Çözümü
Bu bir reklamdır:
Örnek:
0 oC sıcaklıkta, 11,2 Litrelik bir kapta bulunan 2 mol He gazının, kaba uyguladığı basıncı hesaplayınız.
Sorunun Çözümü
İdeal Gazların Yoğunluğu (d)
- İdeal gazların yoğunluğunu iki şekilde hesaplayabiliriz.
- Yoğunluğun genel formülü ile:
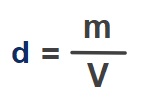
- d: Gazın özkütlesi veya yoğunluğudur. Birimi g/L olmalıdır.
- m: Gazın kütlesidir. Birimi g (gram) olmalıdır.
- V: Gazın hacmidir. Birimi L (Litre) olmalıdır.
- İdeal gaz denklemi yardımı ile:

- P: Gazın basıncıdır. (atm)
- MA: Gazın mol ağırlıdığıdır. (gram/mol)
- d: Gazın özkütlesi veya yoğunluğudur. Birimi g/L olmalıdır.
- R: İdeal gaz sabitidir.
- T: Gazın sıcaklığıdır. (K)
- İdeal gaz denkleminden yoğunluk formülü şöyle türetilir:
- İdeal gaz denklemini yazalım:

- Mol sayısının formülünü hatırlayalım:
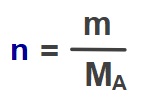
- Mol sayısı formülünü yerine yazdığımızda:

- V ile MA ifadelerinin yerini değiştirirsek:

- Yoğunluk formülü:
m/V değeri, yoğunluğun (d) formülüdür.
m/V ifadesinin yerine, d yazdığımızda, eşitlik şöyle görünecektir:

Bu formüldeki yoğunluk değerinin birimi gram / Litre olacaktır.
Bu bir reklamdır:
Örnek:
2,73 atm basınç altındaki X gazının, sıcaklığı 0 oC olarak hesaplanıyor.
Buna göre, bu gazın yoğunluğunu hesaplayınız. (X: 82 g/mol)
Sorunun Çözümü
Bu bir reklamdır:
Örnek:
27 oC sıcaklıkta, 4 gram CH4 gazının kabına uyguladığı basınç 0,25 atm’dir.
Buna göre, kabın hacmini Litre olarak hesaplayınız. (C: 12 g/mol, H: 1 g/mol)
Sorunun Çözümü
Bu bir reklamdır:
Örnek:
Bir depolama tankında, 380 Torr basınç yapan ve 0 oC sıcaklıkta He gazı bulunmaktadır.
Tankın hacmi 4,48 L olduğuna göre, gazın kütlesi kaç gramdır? (He: 4 g/mol)
Sorunun Çözümü
Bu bir reklamdır:
Örnek:
0,25 mol CO2 gazı, normal şartlar altında kaç gram gelir? (C: 12 g/mol, O: 16 g/mol)
Sorunun Çözümü
Bu bir reklamdır:
Örnek:
6 gram C2H6 gazı, normal koşullarda kaç litre hacim kaplar? (C: 12 g/mol, H: 1 g/mol)
Sorunun Çözümü
Bu bir reklamdır:
Örnek:
0,02 mol Al metali aşağıdaki tepkimeye göre tamamen harcanıyor:
Al(k) + 3HCl(suda) → AlCl3 + 3/2H2(g)
Buna göre bu tepkimede oluşan hidrojen gazının, 1,12 litrelik bir kapta, 0oC’deki basıncı kaç atm’dir?
A) 0,20
B) 0,30
C) 0,40
D) 0,50
E) 0,60
Cevap
Sorunun Çözümü
Bu bir reklamdır:


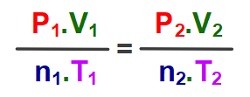




1 yorum: “2. İdeal Gaz Yasası”