İçindekiler
Gazlar; katı ve sıvı hal ile birlikte, maddenin 3 temel halinden biridir. Gaz halindeki maddeleri tanımaya, Gazların Özellikleri ve Gaz Yasaları ile başlıyoruz.
Gazların Genel Özellikleri
- Gazların sabit bir hacmi yoktur; içinde bulundukları kabın hacmini kaplarlar.
- Gazların kimyasal türleri arasında büyük boşluklar vardır.
- Bu boşluklar nedeniyle, gazlar, basınç ile sıkıştırılarak hacmi küçültülebilen maddelerdir.
- Katı ve sıvılarda bu özellik yoktur.
- Gazlar, soğutularak ve sıkıştırılarak sıvılaştırılabilir.
- Sıvılaşabilme özelliği kritik sıcaklığın üzerinde geçerli değildir.
- Gazların karışımları her zaman homojendir.
- Bir maddenin en düşük öz kütleli hali, gaz halidir. (Maddenin en hafif hali gaz halidir.)
- Gazların kimyasal türleri arasında zayıf etkileşimler kurulmadığı kabul edilir.
- Gazların kimyasal türleri; titreşim, öteleme ve dönme hareketi yaparlar.
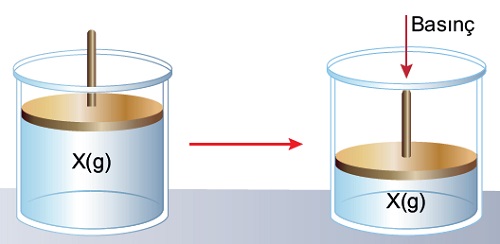
- Gazların kimyasal türleri, devamlı hareket halinde halinde oldukları için, kapların kenarlarına çarparak, gaz basıncını meydana getirirler.
- Gazlar, içinde bulundukları kapların her yerine eşit basınç yapar.
- Gazlar, maddenin en düzensiz hâlidir. Yani, kimyasal türlerinin yüksek enerjilerinden dolayı bulundukları ortamdan başka bir ortama kendiliğinden geçebilirler.
- Akışkandırlar. Bulundukları ortamın her yerine yayılırlar.
- Bir maddenin, enerjisinin en yüksek olduğu hali, gaz halidir. Çünkü madde, ısı enerjisi ala ala, katıdan gaza geçmiştir.
Gazları Tanımlayan Özellikler
- Bir gazın, ölçülebilen 4 temel özelliği vardır. Gazları tarif ederken, bu dört temel özelliği kullanırız. Bunlar şunlardır:
- Basınç (P)
- Miktar (n)
- Hacim (V)
- Sıcaklık (T)
Gelin bu özellikleri yakından inceleyelim.
I) Basınç (P)
- Birim yüzeye uygulanan kuvvete basınç denir.
- Basıncın sembolü P harfidir; birimi atm (atmosfer) veya mmHg (milimetre cıva)’dır.
- Kapalı bir kapta bulunan her gaz, kabına mutlaka bir basınç yapar.
- Gazların kimyasal türlerinin, birim yüzeye uyguladıkları kuvvete gaz basıncı denir.
Açık Hava Basıncı (P0 veya Pdış veya Phava)
- Hava da bir gaz karışımıdır ve her gazın olduğu gibi havanın da bir basıncı vardır.
- Kuru hava: %78 N2, %21 O2 ve %1 CO2 ve diğer gazlardan oluşur.
- Atmosferimizdeki havanın basıncına “açık hava basıncı” veya “atmosfer basıncı” denir.
- Açık hava basıncı, “P0” veya “Phava” veya “Pdış” sembolü ile ifade edilir.
- Açık hava basıncı, Barometre ile ölçülür.
Toricelli Deneyi
- İtalyan bilim insanı, E. Torricelli (E. Toriçelli) 1643 yılında yaptığı deneyle açık hava basıncını ölçmüştür.
- Yandaki/Aşağıdaki videoda, Toricelli’nin yaptığı deneyin canlandırılması verilmiştir:
- Torricelli, deneyini, Cıva (Hg) sıvısı ile, deniz seviyesinde ve 0 °C sıcaklıkta yapmıştır.
- Deney sonucunda, açık hava basıncını 76 cmHg (santimetre cıva) olarak hesaplamıştır.
- 76 cmHg değerindeki basınç daha sonra, 1 atm (atmosfer) olarak kabul edilmiştir.
- Yandaki/Aşağıdaki şekil, “Toricelli Deneyinin” şeklidir:

- Toriçelli bu deneyi Hg değil de başka bir sıvı ile yapsaydı, seviye farkı fizik dersinde “sıvıların basıncı” konusunda gördüğümüz şu formül ile hesaplanacaktı:
- hHg.dHg = hsıvı.dsıvı
- Formüldeki sembollerin anlamları şöyledir:
- hHg : Cıva yüksekliği
- dHg : Cıvanın öz kütlesi
- hsıvı : Diğer sıvının yüksekliği
- dsıvı : Diğer sıvının öz kütlesi
Örnek:
Toricelli, deneyinde Hg sıvısı yerine su kullansaydı, sıvı seviyeleri arasındaki fark kaç cm olurdu? (dHg = 13,6 g/cm3, dsu = 1 g/cm3)
Çözüm
Normal Koşullar (NK)
- Daha sonraki yıllarda, Toricelli’nin, bu deneyi yaptığı koşullar olan;
- 0 °C sıcaklık ve
- 1 atm basınca “Normal Koşullar (NK) veya Normal Şartlar (NŞ)” adı verilmiştir.
- Normal koşullardaki maddelere “Normal Şartlar Altında (NŞA)” denir.
- Bir gazın sıcaklığı; 0 °C ve basıncı 1 atm ise o gaz “normal koşullarda” veya “normal şartlar altında” kabul edilir.
1 Atmosfer
- Toricelli’nin ölçtüğü 1 atm basıncına, “standart atmosfer basıncı” denmiştir.
- Standart atmosfer basıncı = 1 atm
- 1 atm = 76 cmHg
- 1 atm = 760 mmHg
- 1 atm = 760 Torr
- 1 mmHg = 1 Torr
Standart Koşullar (Oda Koşulları)
- Standart koşullar:
- Basıncı 1 atm, sıcaklığı 25 oC olan gazlar standart koşullarda kabul edilir.
- Standart koşullara oda koşulları da denir.
- Standart koşullarda, 1 mol gaz, her zaman, 24,5 L hacim kaplar.
- Aynı koşullardaki gazların basınç ve sıcaklıkları aynı demektir.
Basıncın Birimleri
- Basıncın, Uluslararası Birim Sistemine (SI) göre birimi Pascal (Pa) dır.
- Fakat, gaz basıncı ölçülürken, bu birim pek tercih edilmez.
- Aşağıda, gazların basıncı ölçülürken, kullanılan birimler ve semboller verilmiştir:
- atm (Atmosfer)
- mmHg (Milimetre Cıva)
- cmHg (Santimetre Cıva)
- Torr (Torr)
- Bu birimleri birbirine dönüştürmek için, aşağıdaki eşitlikler kullanılır:
- 1 atm = 760 mmHg
- 760 mmHg = 76 cmHg
- 1 mmHg = 1 Torr
Örnek:
a) 0,5 atm = ? mmHg
b) 190 Torr = ? atm
c) 114 cmHg = ? atm
Yukarıda verilen birimleri, karşısındaki birime çeviriniz.
Cevap
Örneğin çözümü:
II) Hacim (V)
- Bir maddenin, boşlukta kapladığı yere hacim denir.
- Hacmin sembolü V harfidir.
- Birimi Litre (L) veya m3 tür.
- Gazların hacimleri, kaplarına bağlıdır.
- Kabının hacmi kaç litre geliyorsa, gazın da hacmi o kadardır.
- Aynı gazı 1 litrelik bir kaba koyarsak hacmi 1 L olur, 10 Litrelik bir kaba koyarsak hacmi 10 L olur.
- Standart koşullarda, 1 mol gaz, her zaman,24,5 L hacim kaplarken
- Normal koşullarda, 1 mol gaz, her zaman, 22,4 L hacim kaplar.
- Hacim, farklı birimlerde verilirse, şu eşitlikler ile Litreye (L) dönüştürülebilir:
- 1 L = 1 dm3 = 1000 cm3 = 1000 mL
III) Sıcaklık (T)
- Bir gazın davranışını etkileyen önemli özelliklerden biri de sıcaklıktır.
- Sıcaklık termometre ile ölçülür.
- Kelvin cinsinden sıcaklığa mutlak sıcaklık denir ve T harfi ile gösterilir.
- Celsius (oC) cinsinden sıcaklık, bizim, günlük hayatta kullandığımız sıcaklıktır ve t harfi ile gösterilir.
- Ülkemizde pek kullanılmasa da sıcaklık Fahrenhayt termometresi ile de ölçülebilir.
Termometreler
- Termometreler, suyun, normal donma ve normal kaynama sıcaklıklarına göre geliştirilmiştir.
- Aşağıda 3 farklı termometre verilmiştir.

Celcius (Selsiyus) Termometresi:
- Ülkemizde, sıcaklık ölçümü için, Celcius termometresi kullanılır.
- Celcius termometresi ile ölçülen sıcaklığın sembolü “t” harfi, birimi “Santigrat derece” veya “oC” ifadesidir.
- Celcius termometresinde, suyun donmak noktası 0 oC, kaynama noktası ise 100 oC olarak alınmıştır.
- Aşağıda, Kelvin cinsinden verilmiş bazı sıcaklık değerleri görüyorsunuz:
- t = 100 oC
- t = 273 oC
- t = 0 oC
- Celsius (oC) cinsinden verilen bir sıcaklığı, Kelvin’e çevirmek için aşağıdaki formül kullanılır:
T = t + 273
Kelvin Termometresi:
- Gazlar ile ilgili hesaplamalar yaparken, sıcaklığı Kelvin (K) cinsinden almamız gerekecektir.
- Kelvin cinsinden sıcaklık demek, Kelvin termometresi ile ölçülmüş sıcaklık demektir.
- Kelvin cinsinden sıcaklığa “mutlak sıcaklık” denir.
- Kelvin cinsinden sıcaklığın sembolü “T” harfi, birimi ise “Kelvin” veya “K” harfidir.
- Kelvin termometresinde, suyun donma noktası 273 K, kaynama noktası ise 373 K olarak alınmıştır.
- Kelvin termometresi, bilimsel termometredir.
- Kelvin termometresinin sıfır olarak ölçtüğü sıcaklık, yani sıfır Kelvin değeri, mutlak sıfır sıcaklığı olarak kabul edilir, yani 0 Kelvin sıcaklığında, sıcaklık biter.
- Aşağıda, Kelvin cinsinden verilmiş bazı sıcaklık değerleri görüyorsunuz:
- T = 500 K
- T = 273 K
- T = 546 K
Örnek:
I) 25 oC = ? K
II) 0 K = ? oC
III) 273 K = ? oC
IV) 273 oC = ? K
Yukarıdaki sıcaklık değerlerini, karşılarında verilen birime dönüştürünüz.
Cevap
Örneğin çözümü:
Sıcaklık – Ortalama Kinetik Enerji
- Sıcaklık, doğrudan, atom ve moleküllerin hızı ile ilgilidir.
- Bir gaz veya bir madde ne kadar sıcaksa, kimyasal türleri de o kadar hızlıdır.
- Hız arttıkça kinetik enerji artar.
- Bir madde ne kadar sıcaksa, maddedeki kimyasal türlerin ortalama kinetik enerjisi o kadar fazladır.
- Sıcaklıkları eşit olan maddelerin ortalama kinetik enerjileri de eşittir.
IV) Miktar
- Gazların miktarı genellikle mol sayısı olarak verilir ya da sorulur.
- Mol sayısı, gazların kimyasal türlerinin (atom ya da moleküllerinin) sayısıdır.
- Mol sayısının sembolü “n” harfidir, birimi de “mol” dür.
- Bir gazın, miktarının 1 mol olması için:
- Kimyasal türlerinin sayısının, Avogadro Sayısı kadar olması veya
- Kütlesinin mol ağırlığı (MA) kadar gram olması veya
- Normal koşullarda olması ve hacminin, 22,4 Litre gelmesi veya
- Oda koşularında olması ve hacminin, 24,5 Litre gelmesi gerekmektedir.
- Avogadro sayısı, pi sayısı gibi özel bir sayıdır ve değeri her zaman 6,02×1023‘tür.
- Avogadro Sayısı “NA” veya “N0” veya “N” ile gösterilir.
1 mol He (Helyum) gazında, 6,02×1023 tane He atomu vardır.
1 mol N2 (Azot) gazında, 6,02×1023 tane N2 molekülü vardır.
1 mol NH3 (Amonyak) gazında, 6,02×1023 tane NH3 molekülü vardır.
İdeal Pistonlu Kap ve İdeal Elastik Balon
- Gazlar iki çeşit kapta saklanabilirler. Bunlar:
- Sabit hacimli kaplar: Hacmi değişmeyen ve kapaklı kaplardır.
- Düdüklü tencere, mutfak tüpü, pet şişe…
- Sabit basınçlı kaplar: Hacmi değişebilen kaplardır.
- Bu kaplarda bulunan bir gazın basıncı sabittir ve dış basınca eşittir.
- İdeal pistonlu kaplar ve ideal elastik balonlar sabit basınçlı kaplardır.
- İdeal pistonlu kapta, pistonun sürtünmesiz ve ağırlıksız olduğu kabul edilir.
- İdeal elastik balonda, balonun sonsuza kadar ve direnç göstermeden esneyebildiği kabul edilir.
- Gerçek hayatta kullandığımız balonlar ve pistonlu kaplar ideal değildir.
- İdeal pistonlu kabın basıncı sabit tutabilmesi için pistonun serbest bırakılması gerekir.
- Pistona yapılacak her çeşit müdahale kabın özelliğini kaybetmesine sebep olacaktır. Bu müdahaleler şunlar olabilir:
- Pistonun üzerine ağırlık koymak,
- Pistonu çivi ile sabitlemek,
- Önüne engel koyarak hareket etmesini engellemek…
- Pistona yapılacak her çeşit müdahale kabın özelliğini kaybetmesine sebep olacaktır. Bu müdahaleler şunlar olabilir:
- Sabit hacimli kaplar: Hacmi değişmeyen ve kapaklı kaplardır.
Örnek:
Gazlar iki tür kap içinde saklanır. Bunlar; sabit hacimli ve sabit basınçlı kaplardır.
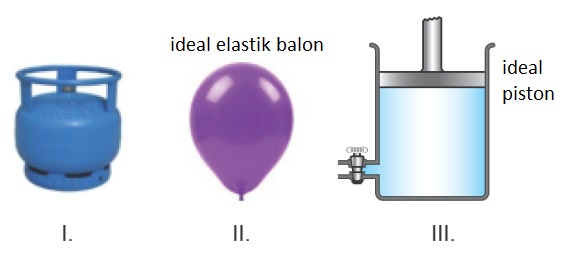
Buna göre şekilde verilen kaplardan hangileri sabit basınçlı kaplardır?
A) Yalnız I
B) Yalnız II
C) Yalnız III
D) II ve III
E) I, II ve III
Gaz Yasaları
- Bir gazın, sıcaklığını değiştirirsek, hacmi bundan nasıl etkilenir?
- Basıncı artarsa sıcaklığı nasıl değişir?
- …
Gaz yasaları bu soruların cevabını verir. Yani; gazları tanımlayan 4 özelliğin biri değişirse, ötekilerin bundan nasıl etkilendiğini açıklayan kurallara gaz yasası denir.
Gaz yasası sorularında, mutlaka;
- Basınç (P)
- Hacim (V)
- Sıcaklık (T)
- Miktar (n)
özelliklerinden en az biri değişir. Bu değişimden diğer özelliklerin nasıl etkilendiği sorulur.
Gaz yasaları şunlardır:
- Boyle Yasası (P-V ilişkisini açıklar)
- Charles Yasası (V-T ilişkisini açıklar)
- Gay-Lussac Yasası (P-T ilişkisini açıklar)
- Avogadro Yasası (n-V ilişkisini açıklar)
Matematik Molası
Gaz yasalarının detayına geçmeden önce, gaz kanunlarında kullanacağımız, şu basit matematik kurallarını hatırlamakta fayda var:
Doğru Orantı
- x sayısı ile y sayısı, doğru orantılı ise:
- x sayısının değeri arttıkça, y sayısının değeri de artar.
- x sayısının değeri azaldıkça, y sayısını değeri de azalır.
- x sayısı, 1/y sayısı ile ters orantılıdır.
- y sayısı, 1/x sayısı ile ters orantılıdır.
- x ve y sayıların bölümleri sabittir.
- x/y = sabit
- x1/y1 = x2/y2
- x1/y1 = x2/y2 = sabit
- x sayısının y sayısına karşı grafiği her zaman şöyledir:

- Grafik, x eksenine yaklaştıkça, x/y sabitinin değeri büyür.
Ters Orantı
- x sayısı ile y sayısı, ters orantılı ise:
- x sayısının değeri arttıkça, y sayısının değeri azalır.
- x sayısının değeri azaldıkça, y sayısını değeri artar.
- x sayısı, 1/y sayısı ile doğru orantılıdır (x α 1/y).
- y sayısı, 1/x sayısı ile doğru orantılıdır (y α 1/x).
- x ve y sayıların çarpımları sabittir.
- x.y = sabit
- x1.y1 = x2.y2
- x1.y1 = x2.y2 = sabit
- x sayısının y sayısına karşı grafiği her zaman şöyledir:
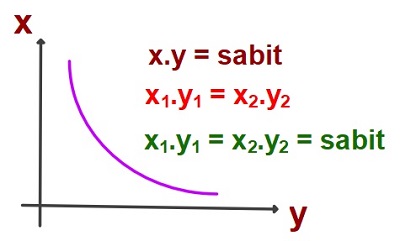
- Grafik, x ve ye eksenlerinden uzaklaştıkça, x.y sabitinin değeri artar.
Şimdi gelin, gaz yasalarını yakından görelim.
1. Boyle Yasası (P1.V1 = P2.V2)
- Gazların davranışlarını ilk defa bilimsel anlamada inceleyen bilim insanı, Robert Boyle tarafından, 1662 yılında ortaya atılmış bir yasadır.
- Boyle yasası, en basit tabiriyle; “sıkışan gazın basıncı artar” der.
- Sıkışan gazın, hacmi küçülür, hacmi küçüldükçe basıncı artar.
- Daha bilimsel ifade edersek;
- Miktarı (n) ve sıcaklığı (T) sabit olan bir gazın,
- Hacmi (V) ile basıncı (P) ters orantılıdır.

Boyle Yasasının Formülü
- Boyle yasası sorularında;
- mol sayısı ve sıcaklık değişmez,
- hacim ve basınç ters orantılı olarak değişir:
- P . V = sabit veya
- P1 . V1 = P2 . V2 veya
- P1 . V1 = P2 . V2 = sabit
- Boyle yasasının grafiği, bildiğimiz ters orantı grafiğidir:
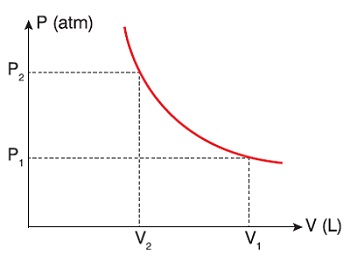
P1 . V1 = P2 . V2
Örnek:
Sabit sıcaklıkta ve ideal pistonlu bir kapta bulunan bir gazın hacmi 12 L, basıncı 0,5 atm’dir.
Bu gazın basıncının, 1,5 atm olması için, hacminin kaç Litreye getirilmesi gerekir?
Cevap
Örneğin çözümü:
2. Charles Yasası (V1/T1 = V2/T2)
- Charles Yasasında (1787), gazların hacmi (V) ile sıcaklığı (T) arasındaki ilişki incelenir
- Gazın miktarı (n) ve basıncı (P) sabit tutulur.
- Charles yasasına göre, belli bir miktar gazın, sabit basınç altında iken, mutlak sıcaklığı (T) ile hacmi (V) doğru orantılıdır.
- Yani, gazın sıcaklığı arttıkça, hacmi de artar; sıcaklığı azaldıkça hacmi de azalır.
- Kanunun deneyi, yandaki/aşağıdaki videoda verilmiştir.
- Videoda; yaklaşık -200 oC deki sıvı nitrojene, içi hava dolu balonlar batırılıyor:
Charles Kanunun Formülü
Charles yasası sorularında, mol sayısı ve basınç değişmez, sıcaklık ve hacim doğru orantılı olarak değişir:
- V / T = sabit veya
- V1 / T1 = V2 / T2 veya
- V1 / T1 = V2 / T2 = sabit
Charles yasasının grafiği, bildiğimiz doğru orantı grafiğidir:

Örnek:
Sabit basınçlı, sürtünmesiz pistonlu kapta bulunan bir gazın; sıcaklığı 400 K, hacmi 3 L’dir.
Gazın hacminin 4,5 Litre olması için, sıcaklığının kaç Kelvin’e getirilmesi gerekir?
Cevap
Örneğin çözümü:
3. Gay-Lussac Yasası (P1/T1 = P2/T2)
- Gay-Lussac Yasasında (1802), gazların basıncı (P) ile sıcaklığı (T) arasındaki ilişki incelenir
- Gazın miktarı (n) ve hacmi (V) sabit tutulur.
- Gay-Lussac Yasasına göre, belli bir miktar gazın, sabit hacimde (V) iken:
- Mutlak sıcaklığı (T) ile basıncı (P) doğru orantılıdır.
Kanunun deneyi, aşağıdaki vidyoda verilmiştir. Vidyoda, metal bir kürenin içindeki gaz, önce soğutulmuş, sonra da ısıtılmıştır. Bu esnada, basınç ölçerde (manometre), gazının basınç değimi gözlenmiştir:
Gay-Lussac Kanunun Formülü
- Gay-Lussac yasası sorularında, mol sayısı ve hacim değişmez, sıcaklık ve basınç doğru orantılı olarak değişir:
- Doğru orantı kurallarını hatırlarsak, Gay-Lussac Yasasının matematiksel olarak şöyle ifade edilmesi gerektiğini anlarız:
- P / T = sabit veya
- P1 / T1 = P2 / T2 veya
- P1 / T1 = P2 / T2 = sabit
- Gay-Lussac Yasasının grafiği, bildiğimiz doğru orantı grafiğidir:

Örnek:
Sabit hacimli bir kapta, belirli miktardaki bir gazın, basıncı 6 atm ve sıcaklığı 600 K’dir.
Gazın sıcaklığı 200 K’e düşürülürse, basıncı kaç atmosfer olur?
Cevap
Örneğin çözümü:
4. Avogadro Yasası (V1/n1 = P2/n2)
- Avogadro Yasasında (1811), gazların, miktarı (n) ve hacmi (V) arasındaki ilişki incelenir.
- Gazın basıncı (P) ile sıcaklığı (T) sabit tutulur.
- Avogadro Yasasına göre, sıcaklığı (T) ve basıncı (P) sabit bir gazın:
- Hacmi (V) ile miktarı (n) doğru orantılıdır.
Kanunun deneyi, aşağıdaki vidyoda verilmiştir. Vidyoda, ideal pistonlu bir kaba gaz gönderilmiştir:
Bir balona, üfleyerek gaz doldurma olayı da, aslında, bir Avogadro Yasası deneyidir.
Avogadro Kanunun Formülü
- Avogadro yasası sorularında, sıcaklık ve basınç değişmez, mol sayısı ve hacim doğru orantılı olarak değişir:
- V / n = sabit veya
- V1 / n1 = V2 / n2 veya
- V1 / n1 = V2 / n2 = sabit
- Avogadro Yasasının grafiği, bildiğimiz doğru orantı grafiğidir:

Örnek:
Sabit basınçlı, 12 L’lik bir kapta, 4 mol gaz vardır.
Sıcaklık sabitken, kaba 4 mol daha gaz konulursa, kabın son hacmi ne olur?
Cevap
Örneğin çözümü:
Örnek:
Sabit basınç ve sıcaklıkta, 4 g H2 gazı 60 L hacim kaplamaktadır.
Aynı şartlarda 32 gram SO2 gazı kaç Litre hacim kaplar? (H: 1 g/mol, S: 32 g/mol, O: 16 g/mol)
Cevap
Örneğin çözümü:
Bileşik Gaz Yasası
- Bir gaz yasası sorusunun, hangi gaz yasası sorusu olduğunu hatırlayamazsanız, bileşik gaz yasası ile çözebilirsiniz.
- Bileşik gaz yasası, şimdiye kadar gördüğümüz 4 gaz yasasının birleşmiş halidir. Formülü şudur:
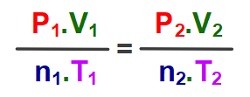
Formülün Kullanımı
- Bu formülü kullanırken, yapmamız gereken şey, değişmeden kalan özellikleri sadeleştirmek, diğer özelliklerden verilenleri yerine yazmak, sorulanı hesaplamaktır.
Örnek:
Belli bir miktar gazın, hacmi yarıya indirilip, mutlak sıcaklığı 4 katına çıkarılıyor.
Buna göre, bu gazın basıncı nasıl değişir?



Ömer says:
çok teşekkürler bilgiler aşırı yardımcı oldu artık favori sitelerimden birisi çok sevdim bilgiler ne çok çocuksu anlatılmış ne de çok mesleki terimler kullanılmış tam aradığım site
Ahmet buğra says:
ayt ye sadece bu siteden çalıştım ve 11d 2y yaptım gerçekten tam aradığım siteydi umarım burayı öğrenen kişi sayısı artar.