İçindekiler
- Atom Modeli Nedir?
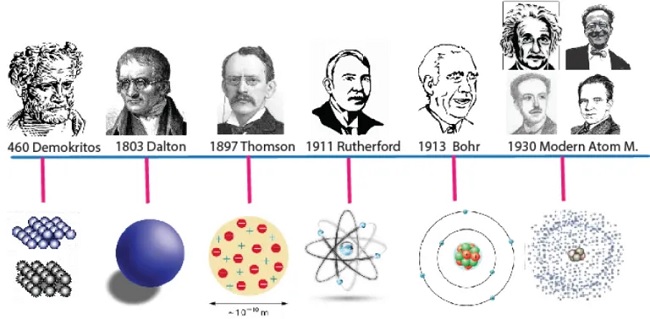
- Atom Modellerinin Kronolojik Sıralaması
- Dalton Atom Modeli (1803)
- Thomson Atom Modeli (1904)
- Rutherford Atom Modeli (1911)
- Bohr Atom Modeli (1913)
- Modern Atom Teorisi (Bulut Modeli)
- Atom Modelleri İle İlgili Testler – Tıkla Çöz
- Konu Özeti
- Atom Modelleri İle İlgili Testler – Tıkla Çöz
Atom o kadar küçük bir taneciktir ki, günümüzün teknolojisi ile dahi bir atom görebilmek mümkün değildir. Hiç göremediğimiz bir şeyin yapısını anlayabilmek de hiç kolay olmamış ve uzun yıllar sürmüştür. Atom modelleri, atomun keşfedilme veya anlaşılma sürecini anlatan bir konudur.
Atom Modeli Nedir?
- Deneysel gözlemlere dayanarak, atomun yapısını ve davranışını akılcı bir biçimde açıklayan şekillere ve özelliklere atom modeli denir.
- Daha basit bir ifade ile, atom modelleri; bilim adamlarının, atom için yaptıkları tariflerdir.
- Bilim insanları yaptıkları bilimsel çalışmalar ve deneylere dayanarak, atomun belli özelliklerini keşfetmişlerdir.
- Ortaya atılan her atom modeli aslında, o modeli tasarlayan bilim adamının kafasındaki atom şeklini gösterir.
- Tabi doğru deneyi yaparak, atom için doğru modeli bulmak hemen mümkün olmamıştır.
- Bu yüzden ilk atom modellerinde, yanlış veya eksik bilgiler vardır.
Atom Modellerinin Kronolojik Sıralaması
- Atom modelleri 5 tanedir ve kronolojik sıraya göre şunlardır:
- Dalton Atom Modeli
- Thomson Atom Modeli
- Rutherford Atom Modeli
- Bohr Atom Modoli
- Modern Atom Teorisi (Bulut Modeli)
Şimdi bu modelleri sıraysıyla görelim.
Bu bir reklamdır:
Dalton Atom Modeli (1803)

John Dalton (1766-1844) yaptığı çalışmalar sonucunda atomu şöyle tarif etmiştir:
- Maddeler atomlardan oluşur. (Doğru)
- Atomlar çok küçüktür. (Doğru)
- Atomlar küre şeklindedir. (Doğru)
- Atomların içi doldur, atomlar çok sağlamdır ve parçalanamazlar. (Yanlış)
- Atomlar kimyasal tepkimelerde parçalanamaz, bölünemez. (Doğru)
- Atomlar yoktan var edilemez, varken yok edilemez. (Doğru)
- Atomlar başka bir atoma dönüşemez. (Yanlış)
- Kimyasal tepkimelerde atom türü ve sayısı korunur. (Doğru)
- Bir elementin bütün atomları büyüklük, şekil ve kütle bakımından özdeştir. (Yanlış çünkü izotop atomlar var.)
- Farklı element atomları birbirinden farklıdır. (Doğru)
- Farklı element atomlarının belirli oranda birleşmesinden bileşikler oluşur. (Doğru)

Dalton Atom Modelinin Eksikleri – Yanlışları
- Atomun içinde daha küçük tanecikler (atom altı tanecikler) vardır.
- Radyoaktif tepkimeler sonucunda atom parçalanabilir.
- Atomun büyük kısmı boşluktur.
- Bir elementin bütün atomları aynı değildir, aynı elementin farklı ağırlıkta olan atomları vardır (izotop atomlar).
Bu bir reklamdır:
Örnek:
Atom ile ilgili olarak aşağıda verilen bilgilerden hangisi Dalton Atom Modeli’nde yoktur?
A) Atomlarda elektron ve protonlar vardır.
B) Bir elementin bütün atomları aynıdır.
C) Atom parçalanamaz.
D) Farklı element atomlarının belirli oranda birleşmesinden bileşikler oluşur.
E) Atomlar için dolu küreciklerdir.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Thomson Atom Modeli (1904)

J. J. Thomson, yaptığı çalışmalar sonucunda atomu şöyle tarif etmiştir:
- Atomlarda pozitif ve negatif yükler vardır. (Doğru)
- Elektron adı verilen negatif (-) yüklü tanecikler, pozitif yüklü atomun içinde homojen olarak dağılmıştır. (Yanlış)
- Atomdaki negatif (-) yük miktarı, pozitif (+) yük miktarına eşit olup atomlar yük bakımından nötrdür. (Doğru)
- Elektronların kütlesi atomun kütlesi yanında ihmal edilebilecek kadar küçük olduğu için atomun kütlesini pozitif yükler oluşturur. (Kısmen doğru)
- Atomlar çapları yaklaşık 10-8 cm olan kürelerdir. (Doğru)
Thomson’ın Hayalindeki Atom
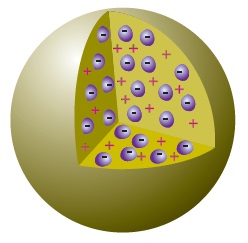
Thomson, negatif yükleri birer tanecik olarak düşünmüş fakat pozitif yükleri, sürekli bir tabaka olarak düşünmüştür.
Thomson’ın Üzümlü Kek Benzetmesi

Thomson, atomun yapısının üzümlü keke benzediğini söylemiştir. Kekteki üzümleri atomdaki negatif taneciklere, üzümün hamurunu da atomun pozitif yapısına benzetmiştir.
Thomson Atom Modelinin Eksikleri – Yanlışları
- Thomson atomdaki negatif (-) ve pozitif (+) yükleri keşfetmiştir. Biz bugün bu yüklerin atomda var olduklarını biliyoruz. Hatta, negatif yüklerin “elektron” pozitif yüklerin de “proton” denen atom altı taneciklerde bulunduğunu biliyoruz. Thomson da negatif yüklerin tanecikler halinde olduğunu yani “elektronları” keşfetmiş fakat; pozitif (+) yüklerin tanecikler halinde değil de atomun içini tamamen dolduran bir doku olarak bulunduğunu söylemiştir. Protonlar için düşündüğü bu durum yanlıştır.
- Aslında atomdaki pozitif ve negatif yükler, Thomson’un dediği gibi değildir yani atomda homojen olarak dağılmaz. Atomdaki pozitif yükler çok küçük hacme sıkışmışken negatif yükler çok büyük hacim kaplar.
- Thomson, pozitif yüklerin atomun kütlesinin tamamını oluşturduğunu söylemiştir ama; yaklaşık yarısını oluştururlar.
Bu bir reklamdır:
Müfredattan çıkarılan kısım:
Sevgili öğrencim, Thomson atom modeli ile ilgili olarak aşağıda vereceğim bilgiler TYT sınavında çıkmayacaktır fakat; testlerde karşına çıkarsa panik yapma diye burada veriyorum. Bu bilgiler 2017’ye kadar sorulmuş ve sonra müfredattan çıkarılmıştır.
- Thomson, atom modelini geliştirirken Crooks Tüpünü (Katot Tüpü de denir) kullanmıştır.
- Crooks Tüpü, William Crooks (Vilyım Kruks) tarafından geliştirilmiş bir vakumlu tüptür. Katot ışınları üretir ve katot ışınları elektronların ta kendisidir.
- Crooks tüpünün günümüzdeki örneği tüplü televizyon ya da bilgisayar ekranlarıdır.
- Elektronun adını, George Johnstone Stoney koymuştur.
- J. J. Thomson Crooks tüpü ile yaptığı çalışmalar sonucunda bir elektronun yük/kütle oranını hesaplamıştır.
Örnek:
Thomson Atom Modeli’ne göre, atom aşağıdakilerden hangisine benzemektedir?
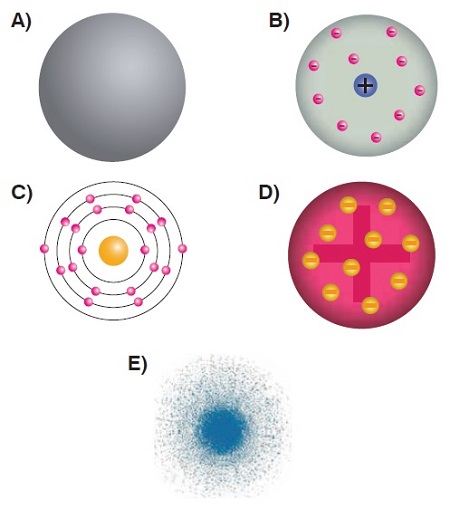
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Rutherford Atom Modeli (1911)

- Yanda/aşağıdaki verilen atom modeli, Rutherford’a aittir. Rutherford, bu modeli ortaya atmadan önce bir deney yapmıştır.

Rutherford’un Deneyi
- Rutherford, atomun yapısını araştırırken aşağıdaki deneyi yapmıştır.
Rutherford’un Yaptığı Deneyinin Canlandırması:
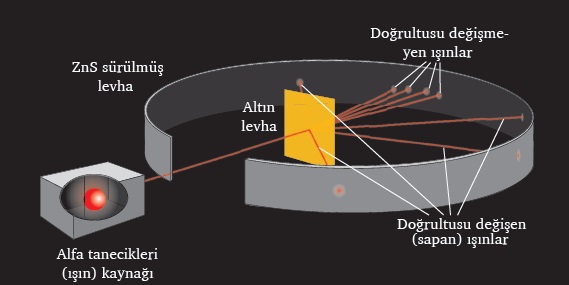
- Rutherford’un yaptığı deneyin düzeneği ve bu düzenekteki malzemeler yukarıda verilmiştir.
- Deneyin kahramanları; çok çok çok ince bir altın levha ve alfa (α) ışınlarıdır.
- Rutherford, alfa ışınlarını hızlı bir şekilde altın levha üzerine fırlatmıştır.
- Alfa ışınlarını fırlatmak için ise alfa ışını tabancası kullanmıştır. (Yukarıdaki şekilde alfa tabancası, Alfa tanecikleri (ışın) kaynağı olarak verilmiştir.)
- Fırlatılan alfa taneciklerinin, altın levhadan geçtikten sonra nereye çarptığını görmek için altın levhanın etrafı, bir metal ile sarılmıştır.
- Altın levhanın etrafını saran bu metalin yüzeyi ZnS (Çinko sülfür) ile boyanmıştır. Çünkü alfa ışını, ZnS boyaya çarptığında bu boyada iz bırakan bir ışındır.
Neden Alfa Işını?
- Aslında bir alfa ışını taneciği; birbirine yapışmış 2 proton ve 2 nötrondur.
- Alfa ışınının özelliği;
- protondan daha ağır,
- elektrondan ise çok çok çok daha ağır olması ve
- pozitif yüklü olmasıdır.
- Alfa taneciklerinin ne kadar ağır olduğunu anlamak için şöyle bir benzetme yapabiliriz:
- Bir tane elektron 1 fındık tanesi kadar ise gelseydi, bir alfa taneciği yaklaşık 7500 tane fındık tanesi kadar gelirdi.
- Bir tane proton 1 fındık tanesi kadar gelseydi bir alfa taneciği yaklaşık 4 tane fındık tanesi kadar gelirdi.
Deneyin Amacı:
- Sevgili öğrencim, Rutherford’un yaptığı bu deney (aslında bu deneyi öğrencileri yapmıştır) Thomson Atom Modelinin doğruluğunu ispatlamak için yapılmıştır.
- Thomson, elektronların ve protonların atomda bir araya toplanmış bir şekilde bulunmadığını tam aksine homojen olarak dağıldıklarını söylemiştir.
Deneyin Mantığı:
- Elektron ve protonlar gerçekten toplu değil de dağınık bir şekilde ise, çok hızlı giden bir alfa taneciği, altın atomundan geçerken en fazla bir elektrona ya da bir protona isabet edebilecektir.
- Ağır bir alfa taneciğinin bir elektrona ya da bir protona hızla çarpması, ağır bir futbol topunun çok hafif olan bir pinpon topuna hızla çarpmasına benzeyecektir.
- Yani alfa taneciği bu çarpmadan pek etkilenmeyecektir.
- Fakat deney yapıldığında, çok şaşırtıcı bir şey olmuş ve alfa taneciklerinden bazıları, neredeyse geriye dönecek kadar çok yansımışlardır.
- Bu şekilde yansıyan ışınların oranı çok az da olsa, bu beklenen bir durum değildir.
Deney Sonuçlarının Yorumlanması:
- Bazı Alfa ışınlarının böyle sert bir şekilde yansımasının tek bir açıklaması olabilir:
- Kendilerinden daha büyük ve yoğun bir kütleye isabet etmiş olmalılar, tıpkı futbol topunun duvara çarpması gibi.
- Evet gerçekten de böyle olmuştur; bu alfa ışınları atomun merkezinde bulunan çekirdeğe isabet etmiştir yani, Rutherford atomun çekirdeğini keşfetmiştir.
- Alfa ışınında toplam 4 tane olan proton ve nötron varken, altın atomunun çekirdeğinde bu ikisinden, toplam 197 tane vardır.
- Atomların çekirdekleri de tıpkı alfa parçacığı gibi pozitif yüklüdür.
- Yani ikisi de pozitif olduğu için alfa ile atom çekirdeği birbirini iter.
- Hem de çekirdek, çok yoğun bir yer olduğu için alfa çok sert bir duvara çarpmış gibi olur.
- Alfa ışınlarının çoğu atomların içinden doğrudan geçip giderken, çok az bir kısmı çekirdeğe isabet ettiğine göre, çekirdeğin atomda çok az bir yer kapladığı da belli olmuştur.
Rutherford Atom Modeli
Rutherford, deney sonuçlarını değerlendirerek gezegen modeli olarak da bilinen yeni bir atom modeli geliştirmiştir.
Rutherford atom modeline göre:
- Bir atomda pozitif yükün tümü, çekirdek denilen küçük bölgede toplanmıştır.
- Çekirdek çapı yaklaşık 10-12 ile 10-13 cm, atom çapı ise 10-8 cm olduğundan atom hacminin büyük bir kısmı boşluktur.
- Elektronlar, çekirdeğin etrafındaki boşlukta bulunur ve çekirdek etrafında döner.
- Çekirdekteki (+) yük miktarı bir elementin tüm atomlarında aynıdır, farklı elementin atomlarında farklıdır.
- Atomdaki elektron sayısı çekirdekteki proton sayısına eşittir.
- Pozitif yüklerin toplam kütlesi, atomun kütlesinin yaklaşık yarısı kadardır. O hâlde çekirdekte kütlesi protonun kütlesine eşit yüksüz tanecikler bulunur.
- Rutherford atom çekirdeğini Güneş’e, çekirdeğin etrafındaki elektronları da gezegenlere benzetmiştir.
- Yüksüz taneciklerin (nötron) varlığını öngörmesi bu modelin başarısıdır. Rutherford’un öngördüğü yüksüz taneciklerin varlığını ilerleyen yıllarda (1932) James Chadwick (Ceymis Çedvik) kanıtlamıştır.

Rutherford Atom Modelinin Eksikleri – Yanlışları
- Çekirdek etrafında dönen elektronların neden pozitif yüklü çekirdek üzerine düşmediğini açıklayamamıştır.
- Rutherford atom modeli, elektronun davranışını açıklamada yetersiz kalmıştır.
- Rutherford atom modelindeki eksiklikler yeni bir atom modelinin ortaya atılmasına neden olmuştur.
Bu bir reklamdır:
Örnek:
Aşağıdakilerden hangisi Rutherford Atom Modeli’nin bir eksikliğidir?
A) Atomun bir çekirdeğinin olduğunu söylemesi
B) Atomun büyük oranda boşluklardan oluştuğunu söylemesi
C) Atomun çekirdeğinde nötronların da bulunduğunu hissetmesi fakat kanıtlayamaması
D) Elektronların çekirdek dışında bulunduğunu söylemesi
E) Çekirdeğin kütlesinin atomun kütlesinin tamamına yakın olduğunu söylemesi
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Aşağıdakilerden hangisi, Rutherford Atom Modeli için doğru değildir?
A) Çok ince bir altın levha üzerine alfa ışınları gönderilerek yapılan bir deneye sonucu ortaya çıkmıştır.
B) Atomların pozitif yüklü bir çekirdeğinin olduğu anlaşılmıştır.
C) Atomun çekirdeğinin, atoma göre çok küçük bir hacimde olduğu anlaşılmıştır.
D) Atomun büyük boşluklardan oluştuğu anlaşılmıştır.
E) Atomlarda pozitif ve negatif yüklerin olduğu anlaşılmıştır.
Cevap
Örneğin çözümü:
Bohr Atom Modeli (1913)

- Bohr, elektronların hareketini incelmiş ve sonuçta; elektronların çekirdek etrafındaki yörüngelerde ve çok yüksek hızlarda döndüğünü söylemiştir.
- Bohr; elektronların hareketini çözebilmek için, atoma enerji vermiştir, bu enerjiden, elektronların nasıl etkilendiğini incelemiştir. Sonuçta şunu görmüştür:
- Elektronlar da enerji alır ve verirler. Hatta ışık, elektronların verdiği bir enerjidir.
Bohr Atom Modelini anlamak için, enerji kavramını ve ışığın doğasını anlamak gerekir. Şimdi gelin biraz bunlardan bahsedelim.
Absorbsiyon ve Emisyon
- Bu iki kavram maddelerin enerji alması ve vermesi olayları için kullanılır:
- Absorbsiyon (Soğurma): Bir maddenin ısı enerjisi alması demektir.
- Emisyon (Yayma): Bir maddenin enerjisini, ışıma olarak geri vermesi veya ortama yaymasıdır.
Işık İle İlgili Kavramlar
– Spektrum:
- Işığın bir ekrana ya da perdeye ya da bir kağıt üzerine bıraktığı görüntüdür.
- Başka bir tabirle, ışığın bir yüzeyde bıraktığı izdir.
- Mesela; bir el fenerini karanlıkta bir duvara tutarsak, duvarda oluşan ışık deseni bir spektrumdur.
- Çünkü, el fenerinden çıkan ışık, duvarda bir iz veya bir desen oluşturmuştur.
- Mesela; yağmur damlalarından güneş ışığının geçmesi ile oluşan gökkuşağı da bir spektrumdur.
- Mesela; bir el fenerini karanlıkta bir duvara tutarsak, duvarda oluşan ışık deseni bir spektrumdur.
- Spektrum 2 çeşittir:
- Sürekli Spektrum
- Çizgili Spektrum
1- Sürekli Spektrum:
- Bir spektrum, başladığı yerden bittiği yere kadar sürekli devam ediyorsa, böyle spektrumlara sürekli spektrum denir.
- Yani ışık, perde ya da duvarda, bir aydınlık bölge bir karanlık bölge şeklinde bir desen oluşturmayacak; tıpkı fener ışığının duvarda yaptığı desen gibi bir yerde başlayacak ve bir yerde de bitecek.
- Arada bitip bitip tekrar başlamayacak.
- Mesela, beyaz ışığı bir üçgen prizmadan geçirerek, bir perde ya da duvar üzerine düşürürsek, gökkuşağının renklerinden oluşan bir spektrum ortaya çıkar.
- Aşağıdaki şekilde bu spektrum görülmektedir:

Yanda (yukarıda) verilen ve gökkuşağı şeklinde oluşan spektrum, kırmızı ışık ile başlamış mor ışık ile bitmiştir. Arada da değişerek farklı renkler sürekli oluşmuştur. Yani; spektrumun başlangıç ile bitiş noktaları arasında hiç karanlık bir bölge yoktur. Bu yüzden, beyaz ışığın üçgen prizmadan geçerek oluşturduğu spektrum sürekli bir spektrumdur.
2- Çizgi Spektrumu:
- Çizgi spektrumuna baktığımızda, bir süreklilik göremeyiz, renkli ve siyah bölümler vardır.
- Siyah bölümler, spektrumun bittiği bölümlerdir. Yani çizgi spekturumunda:
- Spektrum bir başlar bir biter, sonra yine başlar yine biter.
- Spektrum deseninde aydınlık ve karanlık bölgeler birbirini takip eder.
- Aşağıda verilen spektrum bir çizgi spektrumu örneğidir:

- Yukarıdaki resimde verilen çizgi spektrumu örneğine bakarsanız, uzun uzun karanlık bölgeler ve kısa kısa aydınlık bölgeler olduğunu görürsünüz. Yani oluşan spektrumda bir süreklilik yoktur.
- Çizgi spektrumu 2 çeşittir:
- Absorbsiyon Çizgi Spektrumları
- Emisyon Çizgi Spektrumları
1. Absorbsiyon Çizgi Spektrumları
- Gaz halindeki bir element cam bir kapta iken, içinden geçen beyaz ışığın büyük bir bölümünü absorbe eder (emer), az bir kısmının geçmesine izin verirler.
- Güneş ışığı önde bir elementin gazından sonra da bir prizmadan geçirilirse, aşağıdaki gördüğünüz gibi, karanlık bölgeler arasında kısa çizgiler halinde spektrumlar oluşturur.
- Karanlık bölgeler, beyaz ışığın element atomları tarafından absorbe edilen (emilen) kısmıdır.
- Bu şekilde, bir elementten beyaz ışık geçirilerek oluşan çizgi spektrumlarına soğurma (absorbsiyon) çizgi spektrumu denir.
- Soğurma çizgi spektrumlarında karanlık bölgeler daha çok, aydınlık bölgeler daha azdır.
Aşağıda verilen spektrum, soğurma çizgi spektrumudur.

2. Emisyon Çizgi Spektrumu
- Isıtılan elementin atomları, aldıkları ısı enerjisini, ışık olarak ortama yayarlar (emisyon).
- Yaydıkları bu ışık, bir prizmadan geçirilirse çizgili bir spektrum oluşturur.
- Bu şekilde oluşan çizgili spektrumlara, yayılma (emisyon veya ışıma da denir) çizgi spektrumu denir.
- Işıma çizgi spektrumlarında, aydınlık bölgeler daha çoktur, karanlık bölgeler dar çizgiler halinde görünür.
Aşağıda başka bir kesikli spektrum örneği verilmiştir.

- Aynı elementin hem yayılma hem de soğurma çizgi spektrumuna bakacak olursak, spekturumlardaki tek farkın, aydınlık ve karanlık bölgelerin yer değiştirmesi olduğunu görürüz.
Aşağıda hidrojen atomunun ışıma (a) ve soğurma (b) çizgi spektrumları birlikte verilmiştir:

Güneşe Gitmeden Güneşi Anlamak
Her elementin yayılma veya soğurma çizgi sepktrumu parmak izi gibi diğer elementlerden farklıdır ama; aynı element için her zaman aynıdır. Bu spektrumlar bu yüzden elementleri tanımak için kullanılır. Mesela güneşin yapısını hangi elementlerin oluşturduğu, güneşten gelen çizgili spektrumlar incelenerek tespit edilmiştir.
Bu bir reklamdır:
Örnek:
Işık ile ilgili olarak, aşağıda verilen bilgilerden hangisi doğru değildir?
A) Işığın bir perdede bıraktığı ize spektrum denir.
B) Bir prizmaya beyaz ışık gönderildiğinde, çizgi spektrumu elde edilir.
C) Bir spektrum boyunca, hiç karanlık bölge yoksa bu spektruma sürekli spektrum denir.
D) Gaz halindeki bir element ısıtılırsa, emisyon (ışıma) çizgi spektrumu oluşur.
E) Gaz halindeki bir elementten beyaz ışık geçirilirse, soğurma (absorbsiyon) çizgi spektrumu oluşur.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Atomların Işık Saçması Nasıl Oluyor? (Temel Hal – Uyarılmış Hal)
- Atomlar; bir çok özelliklerinin yanında, ısı enerjisini ışık enerjisine çevirebilen birer makine gibidirler.
- Yani siz, atoma ısı verirsiniz, o da size ışık verir. Bu olay şöyle olur:
- Temel haldeki bir atom, enerji alırsa (absorbe ederse) uyarılmış hale geçer.
- Uyarılmış atom tekrar temel hale dönerken aldığı enerjiyi ışık saçarak aynen geri verir (emisyon).
- Yani siz, atoma ısı verirsiniz, o da size ışık verir. Bu olay şöyle olur:
Atomlarda Temel Hal
- Temel haldeki atomlarda, elektronların yörüngelere dağılımı, 2) 8) 8)… kuralında göredir.
- Elektron dağılımı bu kurala uygun olan atomlar temel haldedirler, ta ki ısı alana kadar…
- Temel haldeki atomlarda, elektronların yörüngelere dağılımı, 2) 8) 8)… kuralında göredir.
- Elektron dağılımı bu kurala uygun olan atomlar temel haldedirler, ta ki ısı alana kadar…
- Atomlardaki elektron dağılımı hakkında detaylı bilgi için, aşağıdaki bölümü okuyabilirsiniz:
Atomlarda Uyarılmış Hal
- Bir maddeyi yeterince ısıtırsanız, o ısı, maddenin elektronlarına kadar ulaşır.
- Isı enerjisini alan elektronlar, aldıkları bu enerjinin etkisiyle, üst yörüngelerdeki boş yerlere sıçrarlar.
- Üst yörüngelere sıçrayan elektronların, ayrıldıkları yerler boş kalır ve elektron dağılımı alışılmışın dışında bir görüntü alır.
- Bu şekildeki atomlara, uyarılmış atomlar denir.
- Uyarılmış atomlar, huzursuzdur yani kararsızdır.
- Elektronları, bir an önce, eski yerlerine geri dönmek ister.

İşte Işık…
- Uyarılmış bir atom kararsızdır.
- Bu kararsızlıktan kurtulmak için, üst yörüngelerdeki elektronlar, en kısa sürede, alt yörüngelerde oluşan bu boş yerlere geri düşerler.
- İşte ışık, elektronun bu şekilde alt yörüngeye geri dönmesi esnasında oluşur.
- Elektronlar üst yörüngelere çıkarken enerji alırlar (absorbe ederler); alt yörüngelere düşerken enerji verirler (emisyon yaparlar).
- Bu şekilde verdikleri enerji ışık enerjisidir.
- Yukarıdaki resim bu olayı canlandırmaktadır.
Peki Hangi Renk Işık?
- Öncelikle ışık dediğimizde, gözlerimizin görebildiği ışınları kastederiz.
- Göremediğimiz o kadar çok ışın vardır ki, ışınlar bir okyanus ise, ışık bu okyanusta bir damlanın da milyonda biri gibidir.
- Işıkların enerjisi, rengine göre değişir. Gökkuşağındaki renklerinin sırası aynı zamanda ışığın enerji sırasıdır. Kırmızı ışık enerjisi en düşük olan ışık, mor ışık ise enerjisi en yüksek ışıktır. Kırmızıdan mora doğru gidildikçe ışığın enerjisi artar.
- Bir yörünge, çekirdeğe ne kadar yakınsa, o yörüngede bulunan elektronların enerjisi o kadar küçüktür. Yani;
- Enerjisi en düşük elektronlar 1. yörüngede yaşarlar.
- 2. yörüngedeki bir elektronun enerjisi 1. yörüngedekilerden daha fazladır.
- …
- Bir elektron ne kadar yüksekten düşerse o kadar yüksek enerjili ışık saçar, saçtığı ışık mor renge o kadar yakın olur. Elektronun düştüğü yörüngeler birbirine ne kadar yakınsa, renk o kadar kırmızıya yakın olur:
- Mesela; bir elektron 2. yörüngeden 1. yörüngeye düşerse, bu iki yörünge arasındaki enerji farkı kadar enerjiyi dışarı atmak zorundadır.
- Bu mantıkla, 3. yörüngeden 1. yörüngeye düşen elektronun verdiği enerji daha yüksek olacak, yaydığı ışık da mor ışığa daha yakın bir renk olacaktır.
Bu bir reklamdır:
Örnek:
Bohr Atom Modeli ile ilgili olarak, aşağıda verilen bilgilerden hangisi yanlıştır?
A) 2. yörüngedeki elektronların enerjisi, 1. yörüngedekilerden daha düşüktür.
B) Atomların en düşük enerjili haline temel hal denir.
C) Enerji aldığında, atomların elektronları üst yörüngelere sıçrarlar ve atom uyarılmış hale geçer.
D) Elektronlar; üst yörüngelerden alt yörüngelere düşerken, dışarıya ısı, ışık gibi bir enerji yayarlar.
E) Mor ışık yayan elektronlar, kırmızı ışık yayanlara göre daha, çekirdeğe daha uzak yörüngelerden düşerler.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Bohr Atom Modeli İle İlgili Kavramlar
Atomların ışık saçmalarını açıklarken, Bohr Atom Modeline dair kritik bazı kavramları da vermiş olduk. Şimdi bu kavramları daha yakından inceleyim.
Yörünge (Kabuk, Temel Enerji Seviyesi)
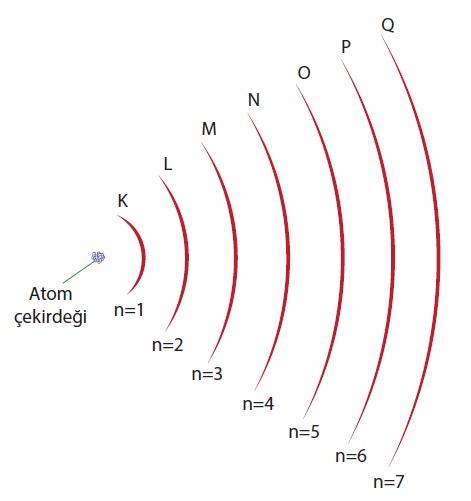
- Elektronlar, çekirdeğin çevresinde bulunan belli yörüngelerde ve yüksek hızlarda dönerler.
- Yörüngeler, çekirdeğin etrafındaki dairesel rotalardır.
- Yörüngelere kabuk veya temel enerji seviyesi de denir.
- Her bir yörüngenin bir numarası veya bir sembolü vardır.
- Çekirdeğe en yakın olandan başlayarak, yörüngelerin numaraları sırasıyla 1, 2, 3, 4, 5, 6 ve 7 şeklidedir. Bu numaralar:
- n=1 (1. yörünge demektir.)
- n=2 (2. yörünge demektir.)
- n=3 (3. yörünge demektir.)
- n=4 (4. yörünge demektir.)
- n=5 (5. yörünge demektir.)
- n=6 (6. yörünge demektir.)
- n=7 (7. yörünge demektir) şeklinde de gösterilebilir.
- Yörüngeler için numara kullanmak istemezseniz, sırasıyla K, L, M, N, O, P, Q sembollerini de kullanabilirsiniz:
- K kabuğu (1. yörünge demektir.)
- L kabuğu (2. yörünge demektir.)
- M kabuğu (3. yörünge demektir.)
- N kabuğu (4. yörünge demektir.)
- O kabuğu (5. yörünge demektir.)
- P kabuğu (6. yörünge demektir.)
- Q kabuğu (7. yörünge demektir.)
- Bu harflerin sırası hep böyledir değişmez. Yani her zaman birinci yörünge K kabuğu, ikici yörünge L kabuğu… şeklinde adlandırılır.
Aşağıdaki videoya tıklayıp, 10 saniye kadar izlediğinizde, Bohr Atom Modelinde bahsedilen yörüngeleri görebilirsiniz.
Bohr Atom Modeline Göre Atomlar
Yörüngeli model olarak da bilinen Bohr Atom Modeline göre:
- Elektronlar çekirdekten belirli uzaklıkta ve belirli enerjiye sahip yörüngelerde bulunur.
- Bu yörüngelere; temel enerji düzeyi (seviyesi), katman veya kabuk denir.
- Temel enerji düzeyi bir tam sayı ile belirtilir.
- Çekirdeğe en yakın temel enerji düzeyi 1 olmak üzere n = 1, 2, 3, 4… sayı veya K, L, M, N… gibi harflerle ifade edilir.
- Çekirdeğe en yakın kabuk minimum, en uzaktaki kabuk maksimum enerjiye sahiptir.
- Bir elektron, bulunduğu temel enerji düzeyinin enerjisine sahiptir.
- Yani 2. yörüngedeki elektronlar 1. yörüngedekilerden daha fazla enerjiye sahiptir; 3. yörüngedekiler de 2. yörüngedekilerden daha fazla enerjiye sahiptir. Bu böyle devam eder.
- Elektronun çekirdeğe en yakın en düşük enerjili hâline atomun temel hâli denir.
- Temel hâlde atom kararlıdır ve ışın yaymaz.
- Elektronun dışarıdan enerji alarak (absorbe ederek) daha yüksek enerji düzeyine geçmesine atomun uyarılmış hâli denir.
- Atom, uyarılmış hâlde iken kararsızdır.
- Kararlı olmak için temel hâle geçer.
- Temel hâle geçerken aldığı enerjiyi ışıma (emisyon) olarak geri verir.
- Yayımladığı ışığın enerjisi, elektronun uyarılmış hali ile temel hali arasındaki enerji farkına eşittir.
Bohr Atom Modelinin Eksiklikleri
- Bohr Atom Modeli, sadece elektron sayıları 1 olan atom veya iyonlar için geçerlidir.
- Bu yüzden, günümüzde geçerli olan atom modeli “Modern Atom Teorisi“dir.
Bu bir reklamdır:
Örnek:
Aşağıdakilerden hangisi Bohr Atom Modeli ile birlikte öğrendiğimiz bir bilgidir?
A) Atomlar; proton, nötron ve elektronlardan oluşur.
B) Atomların merkezinde çekirdekleri vardır.
C) Atomlarda; pozitif yük sayısı kadar negatif yük vardır.
D) Elektronlar, belirli yörüngelerde dönerler.
E) Atomlar, yoktan var edilemez ya da yok edilemez.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Modern Atom Teorisi (Bulut Modeli)
- Bohr Atom Modelinin eksikleri Modern Atom Teorisi ile giderilmiştir.
- Bu model, atom için ortaya atılan en son ve en geçerli modeldir.
- Modern Atom Teorisi, TYT kimyasına dahil değildir, bu yüzden burada işlenmeyecektir.
- Modern Atom Teorisi, Kimya 11 konusudur.
Atom Modelleri İle İlgili Testler – Tıkla Çöz
Konu Özeti
Atom Modelleri bölümünde, özetle şu bilgiler verilmiştir:
- Dalton Atom Modelinde atomlar şöyle tarif edilir:
– Atom için dolu, bölünemeyen ve çok küçük bir taneciktir.
– Bir elementin bütün atomları tıpatıp aynıdır fakat farklı atomların atomları birbirinden farklıdır.
– Kimyasal tepkimelerde atomların sayısı ve cinsi korunur, dizilimleri değişir.
– Bileşikler, elementlerin belli oranda birleşimesi ile oluşur. - Dalton, atomların içini dolu zannetmiş; elektron, proton ve nötronun varlığını keşfedememiştir.
- Thomson Atom Modelinde atomlar şöyle tarif edilir:
– Atomda pozitif ve negatif yükler vardır.
– Pozitif ve negatif yükler atomda homojen olarak dağılır.
– Atomlardaki pozitif yük sayısı ile negetif yük sayısı birbirine eşittir.
– Atomun kütlesini pozitif yükler oluşturur. - Thomson, atomun çekirdekli yapısını, elektronları yörüngesini ve nötronu görememiştir.
- Rutherford, ince bir altın levha üzerine alfa ışınları göndermiş ve alfa ışınlarının altın atomlarına çarptığında nasıl yansıdıklarını gözlemlemiştir.
- Rutherford Atom Modelinde atom şöyle tarif edilir:
– Atomun bir çekideği vardır ve pozitif yükler bu çekirdekte bulunur.
– Çekirdeğin hacmi çok küçüktür ve elektronlar çekirdeğin etrafındaki büyük boşlukta döner.
– Pozitif yüklerin kütlesi, atom kütlesinin yaklaşık yarısıdır.
– Pozitif yük miktarı, bir elementin bütün atomlarında eşittir fakat farklı element atomlarında farklıdır. - Bohr Atom Modelinde atomlar şöyle tarif edilir:
– Bir atomun elektronu enerji abdorbe ederse yani enerji alırsa, bu elektron üst yörüngeye sıçrar ve atom uyarılmış hale geçer.
– Üst yörüngeye geçen elektron çok geçmeden tekrar alt yörüngeye düşer ve aldığı enerjiyi ışık olarak verir. Bu olaya emisyon denir.
– Elektronların döndüğü yörüngeler, çekirdekten itibaren 1, 2, 3,… şeklinde tam sayılarla veya K, L, M, N,… harfleri ile gösterilir.
– Yörüngelerin; enerji seviyesi, temel enerji seviyesi, kabuk veya katman gibi farklı isimleri de vardır.
– Atomun elektronlarının enerji almamış hali, atomun temel halidir. Temel haldeki bir atomda, elektronlar çekirdeğe en yakın olacak şekilde dizilmiştir.
– Çekridekten daha uzak yörüngelerde bulunabilmek için elektronların daha çok enerjiye sahip olması gerekir. Bu yüzden bir elektronlar, çekirdekten daha uzak yörüngeler arasında sıçrarken daha çok enerji alır veya verirler.
Bu bir reklamdır:
Işık ile ilgi kavramlar
- Işığın bir ekranda bıraktığı ize spektrum denir.
- Bir spektrum, aydınlık karanlık şeklinde bir desene sahipse çizgi spektrumudur.
- Bir spektrumun sınırları içinde karanlık bir bölge yoksa bu spektrum süreklidir.
- Bir maddenin dışarıdan enerji almasına absorbsiyon (emme veya soğurma da denir) denir.
- Bir maddenin aldığı enerjiyi dışarıya salmasına emüsyon (yayma) denir.
Atom Modelleri İle İlgili Testler – Tıkla Çöz
Bu bir reklamdır:

Nazlican says:
Harika olmuş tebrikler
Gökalp AY says:
Teşekkürler Nazlican Hanım.
Nazlican says:
Harika olmuş
ayse says:
çok güzel bir site arkadaşlarıma da önereceğim 🙂
Gökalp AY says:
Teşekkürler 🙂
Ayşe says:
Okuduğum en iyi nottu teşekkürler
Asya says:
Hiç bu kadar mükemmel beklemiyordum şahsen… Çok süper olmuş, teşekkür ederim 🙂 (sanırım bir 11. sınıf olarak tyt kimya ya burdan çalışacağım)
Gökalp AY says:
Bizi çok mutlu ettiniz. Biz teşekkür ederiz 🙂