İçindekiler
“Elementleri Tanıyalım” adını verdiğimiz bu bölümde, bir elementin periyodik sistemdeki yeri ile o elementin özellikleri arasındaki ilişki açıklanacaktır.
Periyodik sistemin s, p, d ve f bloklarına ayrıldığını daha önceden biliyoruz:
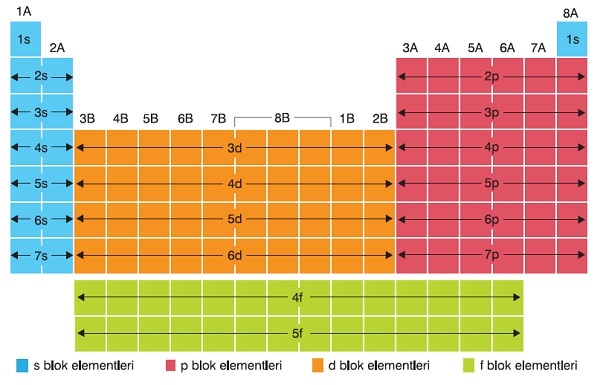
Gelin bu blokların ve bu bloklarda bulunan elementlerin temel özelliklerini öğrenelim.
s Bloku Elementleri
s blokunda yaşayan atomların, orbital dizilimleri, s orbitali ile biter. 1A ve 2A grupları, periyodik sistemin s blokudur.
1A Grubu Elementleri

- H, Li, Na, K, Rb, Cs, Fr elementlerinin grubudur. (Haydar paşa, Lisesinin, Namlı, Kimyacısı, Rbianın, Csedini, Frlattı).
- H : Hirojen
- Li : Lityum
- Na : Sodyum
- K : Potasyum
- Rb : Rubidyum
- Cs: Sezyum
- Fr : Fransiyum
- Hidrojen hariç, hepsi metaldir. Bu gruptaki metallere Alkali Metaller denir.
- Orbital dizilimleri ns1 ile biter.
- Son yörüngelerinde 1 elektron vardır, yani değerlik elektron sayıları 1’dir.
- Bileşiklerinde +1 yük alırlar. Hidrojen hem +1 hem de -1 yük alabilmektedir.
- Alkali metaller, en aktif metallerdir. Grupta, aşağıya doğru gidildikçe, metalik aktiflik daha da artar.
- Çok aktif elementler oldukları için, tabiatta tepkimeye girecek birilerini mutlaka bulurlar. Bu yüzden tabiatta, serbest halde değil hep bileşikleri halinde bulunurlar.
- Bileşik oluştururken iyonik bağ kurarlar.
2A Grubu Elementleri

- Be, Mg, Ca, Sr, Ba, Ra elementleri bu grupta yaşar. (Betül, Mgzada, Canana, Srılınca, Bayağı, Rahatladı)
- Be : Berilyum
- Mg : Magnezyum
- Ca : Kalsiyum
- Sr : Stronsiyum
- Ba : Baryum
- Ra : Radyum
- Bu gruptaki bütün elementler metaldir. Bu gruptaki metallere Toprak Alkali Metaller denir.
- Orbital dizilimleri ns2 ile biter.
- Grup, 2. periyottan itibaren başlar.
- Son yörüngelerinde 2 elektron vardır, yani değerlik elektron sayıları 2’dir.
- Bileşiklerinde +2 değerlik alırlar.
- Alkali metallerden sonra en aktif metallerin bulunduğu gruptur. Grupta, aşağıya doğru gidildikçe, metalik aktiflik daha da artar.
- Çok aktif elementler oldukları için, tabiatta tepkimeye girecek birilerini mutlaka bulurlar. Bu yüzden tabiatta, serbest halde değil, hep bileşikleri halinde bulunurlar.
- Bileşik oluştururken, iyonik bağ kurarlar.
p Bloku Elementleri
p bloku elementleri şu gruplardaki elementlerdir:
- 3A grubu
- 4A grubu
- 5A grubu
- 6A grubu
- 7A grubu
- 8A grubu
Gelin, bu grupların özelliklerini öğrenelim.
3A Grubu

- B, Al, Ga, In, Tl elementleri bu grupta yaşar.
- B : Bor (Yarı metal)
- Al : Alüminyum (Metal)
- Ga : Galyum (Metal)
- In : İndiyum (Metal)
- Tl : Talyum (Metal)
- 3A grubundaki elementleri Toprak Metalleri olarak adlandırılır.
- Gruptaki atomların orbital dizilimi ns2np1 ile biter.
- Değerlik tabakalarında 3 elektron vardır. Değerlik elektron sayıları 3’tür.
- Grup, 2. periyottan itibaren başlar.
- Gruptaki B (Bor) elementi bir yarı metaldir, diğer elementler metaldir.
- Bor elementi, kovalent bağlar kurar.
- Alüminyum (Al) elementi, bileşiklerinde, +3 yük alırken, diğer metaller hem +1 hem de +3 yük alabilmektedir.
- Grupta aşağıda doğru gidildikçe +1 yük daha çok tercih edilir.
4A Grubu
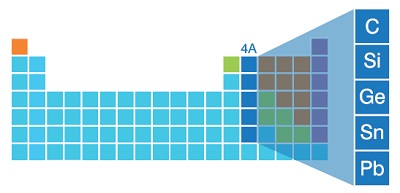
- C, Si, Ge, Sn, Pb elementleri 4A grubunda yaşar.
- C : Karbon (Ametal)
- Si : Silisyum (Yarı metal)
- Ge : Germanyum (Yarı metal)
- Sn : Kalay (Metal)
- Pb : Kurşun (Metal)
- 4A grubuna, Karbon Grubu da denir.
- Gruptaki atomların orbital dizilimi ns2np2 ile biter.
- Değerlik tabakalarında 4 elektron vardır. Değerlik elektron sayıları 4’tür.
- Grup, 2. periyottan itibaren başlar.
- Gruptaki C (Karbon) elementi ametal, Si (Silisyum) ve Germanyum (Ge) elementleri yarı metal, Kalay (Sn) ve Kurşun (Pb) elementi metaldir.
- Gruptaki elementler, bileşiklerinde, +4 ile -4 arasında yük alırlar.
5A Grubu

- N, P, As, Sb, Bi elementleri bu grupta yaşar.
- N : Azot (Ametal)
- P : Fosfor (Ametal)
- As : Arsenik (Yarı metal)
- Sb : Antimon (Yarı metal)
- Bi : Bizmut (Metal)
- 5A grubuna Azot Grubu da denir.
- Gruptaki atomların orbital dizilimi ns2np3 ile biter.
- Değerlik tabakalarında 5 elektron vardır. Değerlik elektron sayıları 5’tir.
- Grup, 2. periyottan itibaren başlar.
- Grup elementleri bileşiklerinde -3 ile +5 arasında değerlik alabilirler.
- Fosfor elementi hava ile temas edince parlayarak yanar.
6A Grubu

- O, S, Se, Te, Po elementleri bu grupta yaşar.
- O : Oksijen (Ametal)
- S : Kükürt (Ametal)
- Se : Selenyum (Ametal)
- Te : Tellür (Yarı metal)
- Po : Polonyum (Yarı metal)
- 6A grubuna Kalkojenler de denir.
- Gruptaki atomların orbital dizilimi ns2np4 ile biter.
- Değerlik tabakalarında 6 elektron vardır. Değerlik elektron sayıları 6’dır.
- Grup, 2. periyottan itibaren başlar.
- Oksijen bileşiklerinde -2 değerlik alırken, grubun diğer elementleri bileşiklerinde, -2 ile +6 arasında değerlikler alır.
7A Grubu
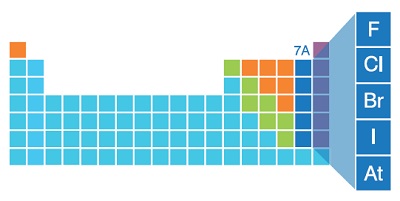
- F, Cl, Br, I ve At elementleri 7A grubunda yaşar.
- F : Flor (Ametal)
- Cl : Klor (Ametal)
- Br : Brom (Ametal)
- I : İyot (Ametal)
- At : Astatin (Yarı metal)
- 7A grubuna Halojenler (tuz oluşturanlar) de denir.
- Gruptaki atomların orbital dizilimi ns2np5 ile biter.
- Değerlik tabakalarında 7 elektron vardır. Değerlik elektron sayıları 7’dir.
- Grup, 2. periyottan itibaren başlar.
- Flor, bileşiklerinde daima -1 değerlik alırken, diğer halojenler -1 ile +7 arasında yükler alabilmektedir.
- Halojenler çok aktif ametallerdir. Bu yüzden doğada genellikle iki atomlu molekülleri halinde (F2, Cl2, Br2, I2) veya bileşikleri halinde bulunurlar.
8A Grubu

- He, Ne, Ar, Kr, Xe, Rn elementleri 8A grubunda yaşar. (Hergele, Necip, Arsız, Krısını, Xesti, Rndeledi)
- He : Helyum
- Ne : Neon
- Ar : Argon
- Kr : Kripton
- Xe : Zenon
- Rn : Radon
- 8A grubuna, Soy Gazlar veya Asal Gazlar grubu da denir.
- Gruptaki atomların orbital dizilimi ns2np6 ile biter. Fakat Helyumun orbital dizilimi 1s2 dir.
- Değerlik tabakalarında 8 elektron vardır. Değerlik elektron sayıları 8’dir. Fakat Helyumun değerlik tabakasında 2 elektron vardır ve değerlik elektron sayısı 2’dir.
- Helyum dubletini tamamlamış, diğer soy gazlar oktetini tamamlamıştır.
- Her biri kendi periyodunun, iyonlaşma enerjisi en yüksek, elektron ilgisi en düşük, atom çapı en küçük atomlarıdır.
- Soy gazlar, tepkime girme eğilimleri çok düşük elementlerdir. Bu yüzden inert (tepkime vermeyen) özellik gösterirler.
d Bloku Elementleri

- d bloğu elementlerinin hepsi metaldir.
- d bloğu elementlerine Geçiş Metalleri denir.
- d bloğu, B gruplarından oluşur. Blok, 2B grubu ile başlar, 1B grubu ile biter. B gruplarının sıralaması şöyledir:
- 3B
- 4B
- 5B
- 6B
- 7B
- 8B
- 8B
- 8B
- 1B
- 2B
- IUPAC sistemine göre, blok, 3. grup ile başlar 12. grup ile biter.
- Bu bloktaki atomların orbital dizilimleri, d orbitali ile biter.
- Bileşiklerinde +1 ile +7 arasında yükler alabilirler fakat; çoğu +2 ve +3 yüklerini tercih eder. Sc (Skandiyum) bileşiklerinde sadece +3, Ag (Gümüş) sadece +1, Zn (Çinko) sadece +2 yük alır.
f Bloku Elementleri
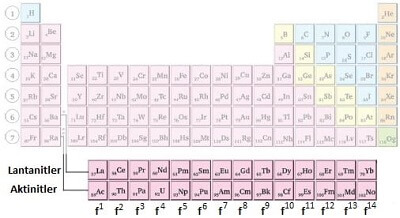
- Lantanitler ve Aktinitler olarak adlandırılırlar.
- Lantanitler 6. periyot 2A grubunun devamı, Aktinitler ise 7. periyot 2A grubunun devamıdır. Periyodik sistemin çirkin görünmemesi için altta gösterilirler.
- Lantanitler de 14 tane, Aktinitler de 14 tanedir.
- Orbital dizilimindeki son orbitalleri f orbitalidir.
- f bloğu elementlerinin hepsi metaldir. Bu metallere, İç Geçiş Metalleri veya Nadir Toprak Metalleri de denir.
- Çoğu radyoaktif elementlerdir.
- Lantanitlerden Pr (Praseodimyum) hariç hepsi tabiatta bulunur.
- Lantanitler, bileşiklerinde genellikle +3 yük alırlar.
- Aktinitlerin ilk 5 tanesi doğada bulunurken diğerleri yapay olarak elde edilir.
- Aktinitler, bileşiklerinde genellikle +3 ve +4 yük alırlar.

1 yorum: “4. Elementleri Tanıyalım”