İçindekiler
- Modern Atom Teorisi
- Bohr Atom Modelinin Sınırlılıkları
- Orbitale Giden Süreç
- Yörünge ve Orbital Arasındaki Farklar
- Orbital Kavramı
- Elektronların Orbitallere Dizilimi
- Orbitallerdeki Elektronların Kuantum Sayıları
- Pauli İlkesi
- Madelung – Kletckovski Kuralı
- Aufbau Prensibi
- Anyon ve Katyonlarda Orbital Dizilimi
- Uyarılmış ve Temel Hal Orbital Dizilimi
Modern Atom Teorisi
- Atomun Kuantum Modeli; günümüzde geçerliliğini koruyan son atom modelidir.
- Atomun Kuantum Modeli:
- Modern Atom Teorisi
- Bulut Atom Modeli
- Orbital Atom Modeli
- Kuantum Atom Modeli
olarak da adlandırılır.
- Bu modelde, önceki atom modellerinden farklı olarak, orbitallerden bahsedilir.
- Orbital kavramı, elektronların atomdaki hareketini açıklayan bir kavramdır.
Orbital: Bir elektronun bulunma ihtimalinin en yüksek olduğu bölgedir. (Orbitalleri, elektronların yaşadığı odalar gibi düşünebiliriz.)
Bohr Atom Modelinin Sınırlılıkları
- Modern Atom Teorisinden önce, geçerli olan atom modeli, Bohr Atom Modeli idi.
- Bohr Atom Modeli; tek elektronlu atom ve iyonlardaki elektron hareketini açıklamakta başarılı olmuştur.
- Tek elektronlu atomlar şunlardır:
- 1H
- 2He+
- 3Li2+
- 4Be3+
- Bohr Atom Modeli, elektron sayısı birden fazla olan atomlarda, elektronların nasıl davrandığını ve bu atomların yaydığı spektrumları açıklamakta yetersiz kalmıştır.
- Mesela, 1H atomunun çizgi spektrumunu, Bohr Atom Modelini kullanarak açıklamak mümkündür fakat; 6C atomunun çizgi spektrumunu açıklamak mümkün olmamaktadır.
Örnek:
I) 2He
II) 2He+
III) 1H
IV) 8O2-
Bohr Atom modeli, yukarıda verilen atom ve iyonlardan hangilerinin elektronlarının hareketini açıklamakta yetersiz kalır?
Cevap
Örneğin çözümü:
Orbitale Giden Süreç
Bohr Atom Modelinden sonra yapılan bilimsel çalışmalar, Modern Atom Teorisinin, dolayısıyla orbital kavramının temellerini atmıştır. Bu çalışmalar şunlardır:
 De Broglie Dalga Denklemi
De Broglie Dalga Denklemi
- Albert Einstein (Albert); enerji ve madde arasında şöyle bir ilişki olduğunu keşfetmiştir:
- E = m.c2
(E: Enerji, m: Kütle, c: Işık hızı)
- E = m.c2
- Max Planck; enerji ve ışık arasında şöyle bir ilişki olduğunu keşfetmiştir:
- E = h.ν
(h: Planck sabiti, ν: ışığın frekansı)
- E = h.ν
- 1924 yılında, Louis de Broglie, bu iki formülü birbirine eşitlemiş ve kendi adıyla anılan dalga boyu (λ) formülünü keşfetmiştir:
- λ = h / (m.V)
(λ: Dalga boyu, h: Planck sabiti, m: Kütle, V: Hız)
- λ = h / (m.V)
Bütün bu keşiflerin bizi ilgilendiren kısmı şudur:
- De Broglie dalga denklemi, sadece ışığın değil, kütlesi olan maddelerin de dalga hareketi yaptığını ispatlamıştır.
- Ortaya attığı denklemle; maddenin hızına (V) ve kütlesine (m) göre dalga boyunu hesaplanabilmektedir.
- O zaman elektron da kütlesi olan bir madde olduğuna göre, elektronda yörüngelerde düzgün doğrusal şekilde değil, dalgalar oluşturarak hareket etmektedir.
 Heisenberg Belirsizlik İlkesi
Heisenberg Belirsizlik İlkesi
- 1927 yılında, Werner Heisenberg, yaptığı deneyler sonucu, elektronun hareketinde her zaman bir belirsizlik olmasını gerektiğini keşfetmiştir. Bu belirsizliği de genel olarak şöyle ifade etmiştir:
- “Bir taneciğin, hem yeri hem de hızı aynı anda kesin olarak belirlenemez.”
- Yani, elektronun hızını ölçerken yeri değişir, yerini ölçerken hızı değişir. Bu ikisinin değerini aynı anda kesin olarak ölçmek mümkün değildir.
 Schrödinger Dalga Denklemi
Schrödinger Dalga Denklemi
- 1926 yılında, Erwin Schrödinger; elektron ve elektron gibi küçük ve hızlı hareket eden tanecikler için dalga fonksiyonları geliştirmiştir.
- Bu fonksiyonlarda, elektronların hem madde hem de ışığa benzeyen davranışları birleştirilmiştir.
- Bu sayede, elektronlara ait orbitallerin şekillerini çizmek mümkün olmuştur. Bütün orbitalleri ve şekillerini birazdan göreceksiniz.
Yörünge ve Orbital Arasındaki Farklar
Bohr Atom Modelinde ortaya atılan yörünge kavramı ile orbital kavramı arasındaki farklar ve benzerlikler aşağıda derlenmiştir:
Yörünge

- Bohr Atom Modeli ile ortaya atılmıştır.
- Elektronların hareketini açıklamak amacı ile ortaya atılmıştır.
- Elektronların dairesel rotalarıdır.
- Elektronlar, yörüngelerde ve yüksek hızlarda döner.
Orbital

- Modern Atom Teorisi ile ortaya atılmıştır.
- Elektronların hareketini açıklamak amacı ile ortaya atılmıştır.
- Elektronların, bulunma ihtimalinin en yüksek olduğu bölgelerdir.
- Elektronlar, yörüngelerdeki orbitallerde bulunur.
Orbital Kavramı
- Bir elektronun bulunma ihtimalinin en yüksek olduğu hacimsel bölgeye orbital denir.
- Her bir orbitale 2e– sığar.
- 4 çeşit orbital grubu vardır.
- Bunlar s, p, d, f orbital gruplarıdır.
- Orbital gruplarının özellikleri şöyledir:
| Orbital Grubu | Kardeş Orbital Sayısı | Elektron Kapasitesi |
|---|---|---|
| s orbitali | 1 | 2 |
| p orbitalleri | 3 | 6 |
| d orbitalleri | 5 | 10 |
| f orbitalleri | 7 | 14 |
- Elektronlar, yörüngelerdeki bu orbitallerde yaşarlar.
- Mesela; atomların 1. yörüngelerinde sadece s orbitali, 2. yörüngelerinde s ve p orbitalleri bulunur…
- Orbitallerin yörüngelere göre dağılımına birazdan geçeceğiz.
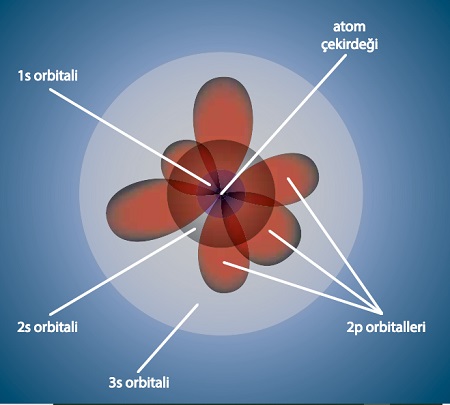
Orbitallerin Şekilleri
- Orbital şekillerine bakarken, o şeklin aslında, o orbitaldeki elektronun serbestçe hareket edebildiği fakat dışına çıkamadığı bölgeler olduğunu düşünün.
s Orbitali

- s orbitali tek bir orbitaldir, kardeş orbitalleri yoktur.
- Bir küreye benzer.
- s orbitali 2 elektron bulundurabilir. (s2)
- Her yörüngede bir tane s orbitali bulunur:
- 1. yörüngenin s orbitali (1s) daha küçük bir küre
- 2. yörüngenin s orbitali (2s) daha büyük bir küredir ve bu kural böyle devam eder.
- Yörünge büyüdükçe s orbitali de büyür.
Aşağıdaki resim, iç içe geçmiş şekliyle 1., 2. ve 3. yörüngelerdeki s orbitallerini göstermektedir:

Aynı s orbitallerinin nasıl iç içe geçtiğini anlamak için, daha şeffaf bir şekilde şöyle de gösterebiliriz:

p Orbitalleri
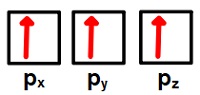
- p orbitalleri dendiğinde, 3 tane kardeş orbital aklımıza gelmelidir.
- Bunlar; px, py ve pz orbitalleridir.
- Bu üçü, eş orbitallerdir; enerji açısından birinin diğerinden farkı yoktur.
- Bu üç orbitalin her biri, ağızları birbirine yapışık iki balon gibidir.
- Aşağıda p orbitallerinin ayrı ayrı şekilleri verilmiştir:

- Şekle baktığımızda:
- px orbitalinde, X ekseni balonların içinden geçer.
- py orbitalinde, Y ekseni balonların içinden geçer.
- pz orbitalinde, Z ekseni balonların içinden geçer.
- p orbitalleri 3 tane olduğu için, her biri 2’şerden, toplam 6 elektron taşıyabilirler. (p6)
- p orbitalleri 1. yörüngede olmaz, 2. yörünge ile birlikte görülmeye başlanır:
- 2. yörüngenin p orbitalleri (2p) ile 3. yörüngenin p orbitalleri (3p) şekil olarak aynıdır fakat; 3. yörüngenin p orbitalleri daha büyüktür. Yörünge büyüdükçe orbitaller de büyür.
d Orbitalleri
- d orbitalleri, 5 tane kardeş orbitaldir.
- Ayrı ayrı her bir d orbitalinin şekli yukarıda verilmiştir.
- d orbitalleri 5 tane olduğu için, 2’şerden toplam 10 tane elektron taşıyabilirler. (d10)
- d orbitalleri 3. yörüngeden itibaren görülmeye başlar. 1. ve 2. yörüngede d orbitalleri yoktur.
f Orbitalleri
- f orbitalleri, 7 tane kardeş orbitaldir.
- Şekilleri AYT kimyasında bilmemiz gereken bir konu değildir.
- f orbitalleri, 7 tane olduğu için, 2’şerden toplam 14 tane elektron taşıyabilirler.
- f orbitalleri, 4. yörüngeden itibaren görülmeye başlarlar. 1., 2. ve 3. yörüngelerde f orbitalleri yoktur.
Aşağıdaki vidyoda, orbitallerin şekilleri gösterilmiştir:
Orbitallere Elektron Yerleştirmek
- Orbitallerin elektron sayıları, üslü ifade olarak, orbital sembolünün üstünde belirtilir:
- s1 (1 elektron bulunduran s orbitali)
- s2 (2 elektron bulunduran s orbitali)
- p1 (1 elektron bulunduran p orbitali)
- p2 (2 elektron bulunduran p orbitali)
- p3 (3 elektron bulunduran p orbitali)
- …
- p6 (6 elektron bulunduran p orbitali)
- d1 (1 elektron bulunduran d orbitali)
- d2 (2 elektron bulunduran d orbitali)
- …
- d8 (8 elektron bulunduran d orbitali)
- …
- d10 (10 elektron bulunduran d orbitali)
- f1 (1 elektron bulunduran f orbitali)
- f2 (2 elektron bulunduran f orbitali)
- …
- f14 (14 elektron bulunduran f orbitali)
Orbitallerin Yörünge Numaraları
- Orbital sembolünün önünde yazan tam sayı, orbitalin kaçıncı yörüngede olduğunu gösterir.
- Aşağıda, bu kurala ait, rastgele bazı örnekler verilmiştir:
- 3s1 (3. yörüngede 1 elektron bulunduran s orbitali)
- 1s2 (1. yörüngede 2 elektron bulunduran s orbitali)
- 2p1 (2. yörüngede 1 elektron bulunduran p orbitali)
- 4p3 (4. yörüngede 3 elektron bulunduran p orbitali)
- 3d1 (3. yörüngede 1 elektron bulunduran d orbitali)
- 5d8 (5. yörüngede 8 elektron bulunduran d orbitali)
- 4d10 (4. yörüngede 10 elektron bulunduran d orbitali)
- 6f14 (6. yörüngede 14 elektron bulunduran f orbitali)
Tam Dolu ve Yarı Dolu Orbitaller
- Bir orbitale iki elektron sığar. Bu yüzden:
- 1 tane elektronu olan bir orbital yarı dolu,
- 2 tane elektronu olan bir orbital de tam doludur.
- Hiç elektronu yoksa, orbital, boştur.
Birazdan, orbitallerin yalancı şekilleri üzerinde tam ve yarı orbitalleri tekrar göreceğiz.
Orbitallerin Yalancı Şekilleri
- Orbitallerin gerçek şekillerini çizmek hem kolay değil hem de pratik değildir.
- Bu yüzden, orbitaller için, yalancı şekiller kullanılır. Sorularda karşımıza çıkabilecek yalancı orbital şekilleri şunlardır:
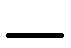 : Kızsa bir çizgi
: Kızsa bir çizgi : Bir dörtgen
: Bir dörtgen : Bir daire
: Bir daire
- Yarı dolu bir orbitalin yalancı şekli şunlardan herhangi bir olarak verilebilir:
- Tam dolu bir orbitalin yalancı şekli şunlardan herhangi biri olarak verilebilir:
Hund Kuralı
- p, d ve f orbitallerine elektron yerleştirirken Hund Kuralına uymak zorunludur.
- p, d ve f orbitallerinde, elektronlar, önce her bir kardeş orbitale teker teker ve aynı yönde yerleşir.
- Yani kardeş orbitallerin biri boş boş dururken, elektronları ötekilerine tıkmayın, bırakın herkes mümkün olduğunca yalnız takılsın.
- Hund kuralına göre d6 orbitali:

- Hund kuralına göre d6 orbitali:

Örnek:
p3 orbitalinin elektron dağılımını yapınız.
Cevap
Örneğin çözümü:
Elektronların Orbitallere Dizilimi
- Orbitallerin dizilimi bütün atomlarda aynıdır ve şöyledir:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6…
- Bütün atomlarda kullanacağımız için bu sıralamanın ezbere bilinmesi gerekiyor.
- Aşağıdaki şekil, bu sıralamayı ezberlemenize yardımcı olabilir:

- Orbital dağılımlarında, orbitallerin üslerinin toplamı, atomun elektron sayısını vermelidir.
Atomların orbital dağılımını bir örnekle anlamaya çalışalım.
Öğretici Örnek:
X10 atomunun orbital dizilimini yapalım.
- X10 atomunun 10 tane elektronu vardır.
- 10 elektron şöyle dizilir:
- Yukarıda verilen orbital sırasına bakıyoruz ve ilk orbitalin 1s2 olduğunu görüyoruz. O zaman:
- X10: 1s2
yazarsak 2 elektron yerleştirmiş oluruz. - X10: 1s2 2s2
yazarak 4 elektron yerleştirmiş olduk. - X10: 1s2 2s2 2p6
yazarak toplam 10 elektron yerleştirmiş oluruz ve atomun bütün elektronlarını yerleştirdiğimiz için cevabı bulmuş oluruz:
- X10: 1s2
- Yukarıda verilen orbital sırasına bakıyoruz ve ilk orbitalin 1s2 olduğunu görüyoruz. O zaman:
X10: 1s2 2s2 2p6
Örnek:
8Y atomunun orbital dizilimini yapınız.
Cevap
Bu bir reklamdır:
Örnek:
26Fe (Demir) atomunun temel hal orbital dağılımını yapınız.
Cevap
Bu bir reklamdır:
Örnek:
Fe23: 1s2 2s2 2p6 3s2 3p6 4s2 3d3
Yukarıda orbital dizilimi verilen Fe atomu ile ilgili olarak aşağıdaki soruları cevaplandırınız.
- Fe atomunun atom numarası kaçtır?
- Fe atomunun 1. yörüngesinde toplam kaç elektron vardır?
- Fe atomunun 2. yörüngesinde toplam kaç elektron vardır?
- Fe atomunun 3. yörüngesinde toplam kaç elektron vardır?
- Fe atomunun 4. yörüngesinde toplam kaç elektron vardır?
- Fe atomunun 5. yörüngesinde toplam kaç elektron vardır?
Cevap
Örneğin çözümü:
Tam ve Yarı Dolu Orbital Sayısı
- Son orbitalden önceki orbitaller, genellikle tam doludur.
- Yarı dolu orbitaller genellikle son orbitalde karşımıza çıkar.
- Son orbital tam dolu değilse, Hund Kuralına göre yarı dolu orbitallerini bulabiliriz.
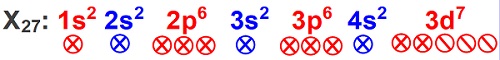
Örnek:
X27: 1s2 2s2 2p6 3s2 3p6 4s2 3d7
Yukarıda, orbital dizilimi verilen atomda, toplam kaç tane tam; kaç tane yarı dolu orbital vardır?
Cevap
Örneğin çözümü:
Orbitallerdeki Elektronların Kuantum Sayıları
- Atomlardaki her bir elektronun 4 tane kuantum sayısı vardır.
- Bir elektronun bütün kuantum sayılarını biliyorsak, o elektronun orbital dizilimindeki yerini de bulabiliriz.
- Yani; kuantum sayıları, bir elektronun adresini gösterir diyebiliriz.
- Nasıl ki her adreste;
- şehir adı
- mahalle adı
- sokak adı ve
- daire numarası
gibi bölümler oluyorsa, elektronların kuantum sayıları da buna benzer anlamlar taşır.
- Nasıl ki her adreste;
1. Baş kuantum sayısı (n)
- Elektronun kaçıncı yörüngede yaşadığını söyler.
- Orbitalinin katsayısı, elektronun baş kuantum sayısıdır:
- 1s2 elektronlarının baş kuantum sayısı 1’tür. (n=1)
- 4s1 elektronlarının baş kuantum sayısı da 4’tür. (n=4)
- 5f13 elektronlarının baş kuantum sayısı da 5’tür. (n=5)
- 4p5 elektronlarının baş kuantum sayısı da 4’tür. (n=4)
2. Açısal momentum kuantum sayısı (l)
- Açısal momentum kuantum sayısına:
- Orbital kuantum sayısı
- ikincil momentum kuantum sayısı
- yan kuantum sayısı
- alt kabuk kuantum sayısı da denir.
- Elektronun hangi orbital ailesinde yaşadığını söyler (s, p, d veya f).
- l = 0 demek; elektron s orbitalinde demektir.
- l = 1 demek; elektron p orbitalinde demektir.
- l = 2 demek; elektron d orbitalinde demektir.
- l = 3 demek; elektron f orbitalinde demektir.
- Orbital kuantum sayısı da denir.
3. Manyetik kuantum sayısı (ml)
- Elektronun, hangi kardeş orbitalde (alt orbitalde) bulunduğunu söyler (px, py, pz, dxy, ….)
- Manyetik kuantum sayısı; -3, -2, -1, 0, 1, +2, +3 değerlerinden birini alır.
- Kaç farklı değer alacağını 2l – 1 formülü ile hesaplayabiliriz.
- Formüldeki “l” harfi açısal momentum kuantum sayısıdır.
- Kaç farklı değer alacağını 2l – 1 formülü ile hesaplayabiliriz.
- Bütün kardeş orbitallerin manyetik kuantum sayıları altında yazılmıştır:

- Kardeş orbitallerin manyetik kuantum sayıları şöyledir:
- s orbitalindeki elektronların manyetik kuantum sayıs
- 0’dır.
- Kardeş p orbitallerinin manyetik kuantum sayıları;
- +1, 0, -1’dir. (Sıra önemli değildir.)
- Kardeş d orbitallerinin manyetik kuantum sayıları
- +2, +1, 0, -1, -2’dir. (Sıra önemli değildir.)
- Kardeş f orbitallerinin manyetik kuantum sayıları
- +3, +2, +1, 0, -1, -2, -3’tür. (Sıra önemli değildir.)
- s orbitalindeki elektronların manyetik kuantum sayıs
4. Spin kuantum sayısı (ms)
- Elektronun hangi yönde spin attığını yani döndüğünü söyler.
- Elektronlar aynı orbitalde yaşayabilmek için zıt yönlü spin atmak (dönmek) zorundadır.
- Orbitaldeki elektronların dönüş yönünü ifade etmek için +1/2 ve -1/2 sayıları kullanılır.
- Aynı orbitaldeki elektronlardan birinin spin yönü +1/2 ise diğerinin -1/2’dir.
- Hangi dönüş yönünün +1/2 hangisinin -1/2 yönünde döndüğüne biz karar veririz.
- Aşağıdaki resim bir orbitaldeki elektronların spin kuantum sayılarını göstermektedir:

Örnek:

Yukarıda orbital elektron dağılımı verilen 16X atomunun, kırmızı renk ile gösterilen elektronunun kuantum sayılarını bulunuz.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
n = 3 değerine sahip en fazla kaç orbital vardır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Atomlarda; n = 4, l = 2 ve ms = -1/2 olan en fazla kaç elektron vardır?
Cevap
Örneğin çözümü:
Pauli İlkesi
Pauli ilkesi, kuantum sayıları için şöyle der:
- Bir atomda, dört kuantum sayısın hepsi de eşit olan iki elektron bulunamaz.
- Zaten, kuantum sayılarını doğru hesapladıysanız, hiç bir zaman farklı elektronların bütün kuantum sayıları eşit çıkmaz. Biraz önce bahsettiğimiz gibi, aynı orbitalde yaşayan elektron çiftlerinde bile, en son spin kuantum sayısı farklı olur.
- Pauli Prensibine göre, bir yörüngenin elektron kapasitesi 2n2 formülü ile hesaplanır. Formüldeki n sayısı, yörünge numarasıdır. Bu durumda:
- yörüngenin elektron kapasitesi: 2.12 = 2 elektron
- yörüngenin elektron kapasitesi: 2.22 = 8 elektron
- yörüngenin elektron kapasitesi: 2.32 = 18 elektron
- yörüngenin elektron kapasitesi: 2.42 = 32 elektron
- Pauli Prensibine göre, bir yörüngenin orbital sayısı n2 formülü ile hesaplanır. Formüldeki n sayısı, yörünge numarasıdır. Bu durumda:
- yörüngedeki maksimum orbital sayısı: 12 = 1 orbital
- yörüngedeki maksimum orbital sayısı: 22 = 4 orbital
- yörüngedeki maksimum orbital sayısı: 32 = 9 orbital
- yörüngedeki maksimum orbital sayısı: 42 = 16 orbital
Madelung – Kletckovski Kuralı
- Orbitallerin hangi sıra ile dizildiğini verir ki biz zaten, atomların orbital dizilimini öğrenmiştik:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 …
- Madelung – Kletckovski kuralına göre enerjisi daha küçük olan orbital çekirdeğe daha yakındır.
- Bu kurala göre orbitallerin enerjileri şöyle karşılaştırılır:
- n + l toplamı küçük olan orbital önce yazılır. Yani;
- n: baş kuantum sayısı ile
- l: açısal momentum kuantum sayısının toplamı küçük olan önce yazılır.
- n + l değerleri eşit olan orbitallerde, n değeri büyük olan orbitalin enerjisi de büyüktür.
- n + l toplamı küçük olan orbital önce yazılır. Yani;
Öğretici Örnek:
3s ve 3p orbitallerinden hangisi, orbital diziliminde daha önce yazılır bulalım:
- n+l toplamı küçük olan orbital önce yazılır. Buna göre 3s ve 3p orbitallerinin n+l toplamları şöyledir:
- 3s orbitalinin n + l değeri:
- 3 + 0 = 3 olur.
- 3p orbitallerinin n + l değeri:
- 3 + 1 = 4 olur.
- 3s orbitalinin n + l değeri:
Aufbau Prensibine göre; n + l toplamı küçük olan 3s orbitali daha önce yazılır.
Örnek:
Atomların orbital diziliminde 4s ve 3d orbitallerinden hangisi daha önce yazılır?
Cevap
Örneğin çözümü:
Aufbau Prensibi
- Hund Kuralı ve Pauli Prensibinin birleşimidir.
- Elektronlar çekirdeğe en yakın ve en düşük enerjisi orbitalden başlayarak, yüksek enerjili orbitale doğru doldurulur.
- Elektron temel halde iken minimum enerjiye sahiptir.
- Düşük enerjisi orbital dolmadan, daha yüksek enerjili olana elektron yerleşmez.
Anyon ve Katyonlarda Orbital Dizilimi
Anyonlarda Elektronların Orbitallere Dizilimi
- Bir atom, elektron alarak, negatif yük kazanmışsa o atoma anyon dendiğini daha önce öğrenmiştik.
- Anyonların elektron dağılımı, tıpkı nötür atomlardaki gibi, elektron sayısına bakılarak yapılır.
- Anyondaki elektronlar, orbital sırası takip edilerek orbitallere dağıtılır.
Öğretici Örnek:
Aşağıda, -1 ve -2 yüklü iki anyonun orbital dizilimi verilmiştir:
17Cl18-1 : 1s2 2s2 2p6 3s2 3p6
8O102- : 1s2 2s2 2p6
Katyonlarda Elektronların Orbitallere Dizilimi
- Katyonlar, elektron vererek, pozitif yük kazanmış atom yada moleküllerdir.
- Proton sayısı 21 ile 30 aralığındaki katyonların orbital dağılımını yaparken dikkat etmek zorundayız. Çünkü;
- Bu aralıktaki atomların temel halde iken orbital düzenleri: 4s 3d orbitalleri ile biter.
- Özel durum da tam burada başlar: Bu atomlar, elektron vermeye 4s orbitalinden başlarlar. Çünkü; “Elektronlar son orbitalden değil son yörüngeden başlanarak verilir.“
- Bu atomun son yörüngesi 4s, son orbitali 3d’dir.
- Kural gereği önce, 4. yörüngedeki 4s elektronlarını verirler; 3. yörüngedeki 3d elektronların değil.
- 4s elektronları biterse, o zaman elektron vermeye 3d’den devam ederler.
- Bu yüzden, proton sayısı 21-30 arasında olan atomların katyonlarında; önce temel hallerine ait orbital dizilimini yazıp, sonra 4s’den başlayarak elektron vermek gerekir.
Öğretici Örnek:
26Fe, 26Fe2+ ve 26Fe3+ iyonlarının elektronlarını orbitallerine dağıtınız.
Çözüm:
Demir (Fe) atomunun proton sayısı 26’dır. Yani 21-30 arasındadır. Bu durumda, bu atomun katyonuna dikkat etmemiz gerekir. Çünkü bu atom elektron verirken önce 4s orbitalindekileri verir.
- Demir atomunun temel hal elektron dağılımı şöyle olacaktır:
- 26Fe26 : 1s2 2s2 2p6 3s2 3p6 4s2 3d6
- Fe2+ katyonu, iki elektron vermiş demir atomudur. 4s2 3d6 ile biten bir atom, 2 elektron vermesi gerektiğinde, 4s2 orbitalindeki 2 elektronu verir:
- 26Fe242+ : 1s2 2s2 2p6 3s2 3p6 3d6
- Fe3+ katyonu, üç elektron vermiş demir atomudur. 4s2 3d6 ile biten bir atom, 3 elektron vermesi gerektiğinde, 4s2 orbitalindeki 2 elektronu ve üstüne 3d6 orbitallerinden 1 elektronunu verir:
- 26Fe233+ : 1s2 2s2 2p6 3s2 3p6 3d5
DİKKAT: Sakın ola, 26Fe242+ katyonunda, 24 elektronu, nötür bir atomda yaptığımız gibi sırayla orbitallere dağıtmayın.
26Fe242+ : 1s2 2s2 2p6 3s2 3p6 4s2 3d4 (YANLIŞ)
Aynı şekilde, 26Fe233+ katyonunda, 23 elektron var diyerek, doğrudan 23 elektronu orbital sırasına göre dağıtmayın:
26Fe233+ : 1s2 2s2 2p6 3s2 3p6 4s2 3d3 (YANLIŞ)
Uyarılmış ve Temel Hal Orbital Dizilimi
- Temel haldeki atomlarda:
- Elektronlar orbitallere doldura doldura yerleşir.
- Önceki orbital dolmadan sonrakine elektron yerleşmez.
- Orbitallerin sırası bozulmaz.
- Örnek: Temel haldeki Ca atomu şöyledir:
- 20Ca20 : 1s2 2s2 2p6 3s2 3p6 4s2
- Elektronlar orbitallere doldura doldura yerleşir.
- Uyarılmış atomlarda:
- Temel haldeki bir atom enerji alırsa uyarılmış hale geçer.
- Alınan enerji ile elektronları daha sonraki boş orbitallere sıçrar.
- Elektron diziliminde boşluklar, atlamalar oluşur.
- Enerjisi temel hale göre daha çoktur.
- Elektron koparmak temel hale göre daha kolaydır.
- Örnek: Uyarılmış haldeki Ca atomu şöyle olabilir:
- 20Ca20 : 1s2 2s2 2p6 3s2 3p6 4s13d1
- Biraz daha enerji verirsek şöyle de olabilir:
- 20Ca20 : 1s2 2s2 2p6 3s2 3p6 4s14p1
- Biraz daha enerji verirsek şöyle de olabilir:
- 20Ca20 : 1s2 2s2 2p6 3s2 3p6 4s13d1



2 yorum “1. Atomun Kuantum Modeli”