İçindekiler
“Modern Atom Teorisi” ünitesi, hem Kimya 11 hem de AYT Kimyasının ilk ünitesidir.
AYT sınavında çıkan 13 tane Kimya sorusunun ortama olarak her yıl 1 tanesi bu üniteden çıkar. (2020 AYT sınavında bu üniteden 2 soru gelmiştir, 2019 ve 2018 AYT sınavında ise soru gelmemiştir.)
Ünitenin Bölümleri
Aşağıda, “Modern Atom Teorisi” ünitesinin sırasıyla bölümleri verilmiştir. Bu üniteyi öğrenmeye hemen başlamak için, 1. bağlantıya tıklayabilirsin.
- Atomun Kuantum Modeli
- Periyodik Sistem ve Elektron Dizilimleri
- Periyodik Özellikler
- Elementleri Tanıyalım
- Yükseltgenme Basamağı
Bu Üniteyi Anlamak İçin Bilmen Gerekenler
- Atom ve Periyodik Sistem (Kimya 9 – II. Ünite)
- Matematik: Sayılar
Ünitenin Anahtar Kavramları
- Atom
- Atom modelleri
- Elektron dizilimi
- Elektron ilgisi
- Elektronegatiflik
- Enerji düzeyi (katman)
- İyonlaşma enerjisi
- Kuantum sayıları
- Orbital (dalga fonksiyonu)
- Periyodik sistem
- Yörünge
- Yükseltgenme basamağı
Ünitenin Kazanımları
1. Atomun Kuantum Modeli
- Atomu kuantum modeliyle açıklar.
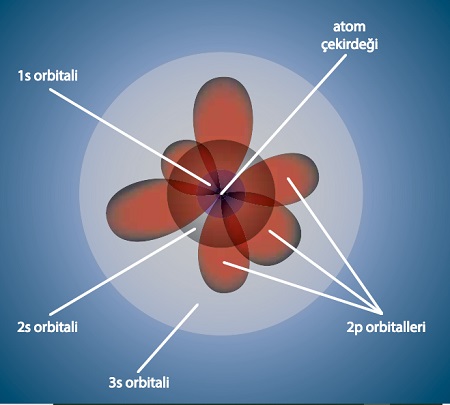
- Bohr atom modelinin deney ve gözlemlerden elde edilen bulguları açıklamadaki sınırlılıkları vurgulanarak modern atom teorisinin (bulut modelinin) önemi üzerinde durulur.
- Tek elektronlu atomlar/iyonlar için orbital kavramı elektronların bulunma olasılığı ile ilişkilendirilir.
- Yörünge ve orbital kavramları karşılaştırılır.
- Kuantum sayıları orbitallerle ilişkilendirilir.
- Çok elektronlu atomlarda orbitallerin enerji seviyeleri açıklanır.
2. Periyodik Sistem ve Elektron Dizilimleri
- Nötr atomların elektron dizilimleriyle periyodik sistemdeki yerleri arasında ilişki kurar.
- Hund Kuralı, Pauli İlkesi ve Aufbau Prensibi açıklanır.
- Atomların ve iyonların elektron dizilimlerine örnekler verilir. Atom numarası 36 ve daha küçük türlerin elektron dizilimleri esas alınır.
- Değerlik orbital ve değerlik elektronu kavramları açıklanır.
- Elektron dizilimleriyle elementin ait olduğu blok ilişkilendirilerek grup ve periyot belirlenir.
3. Periyodik Özellikler
- Periyodik özelliklerdeki değişim eğilimlerini sebepleriyle açıklar.
- Kovalent yarıçap, van der Waals yarıçapı ve iyonik yarıçapın farkları üzerinde durulur.
- Periyodik özellikler arasında metallik/ametallik, atom/iyon yarıçapı, iyonlaşma enerjisi, elektron ilgisi, elektronegatiflik ve oksit/hidroksit bileşiklerinin asitlik/bazlık eğilimleri üzerinde durulur. Periyodik özelliklerin nasıl ölçüldüğüne girilmez.
- Ardışık iyonlaşma enerjilerinin grup numarasıyla ilişkisi örneklerle gösterilir.
4. Elementleri Tanıyalım
- Elementlerin periyodik sistemdeki konumu ile özellikleri arasındaki ilişkileri açıklar.
- s, p, d bloku elementlerinin metal/ametal karakteri, iyon yükleri, aktiflikleri ve yaptıkları kimyasal bağ tipi elektron dizilimiyle ilişkilendirilir.
- f blok elementlerinin periyodik sistemdeki konumlarıyla ilgili özel durumları vurgulanır.
- Asal gaz özellikleri elektron dizilimleriyle ilişkilendirilir.
5. Yükseltgenme Basamakları
- Yükseltgenme basamakları ile elektron dizilimleri arasındaki ilişkiyi açıklar.
- Ametallerin anyon hâlindeki yükleriyle yükseltgenme basamakları arasındaki fark örneklendirilir.
- d bloku elementlerinin birden çok yükseltgenme basamağında bulunabilmeleri, elektron dizilimleriyle ilişkilendirilir.

1 yorum: “0. Modern Atom Teorisi”