İçindekiler
- Hibritleşme, “melezleşme” demektir.
- Hibritleşme olayı, atomların orbitallerinde gerçekleşir.
- Hibritleşme olayına, sadece son yörüngedeki orbitaller (değerlik orbitalleri) katılır.
- Hibritleşme olayında, son yörüngedeki orbitaller melezleşir ve hibrit orbitallerine dönüşür.
- Hibrit orbitalleri, eşit enerjili kardeş orbitallerdir.
- Hibrit orbitallerinin şekilleri, bildiğimiz s, p, d, f orbitallerinden farklıdır.
- Organik moleküllerde karşımıza çıkabilecek üç çeşit hibritleşme vardır. Bunlar:
- sp3 hibritleşmesi (1 tane s, 3 tane p orbitali hibritleşir.)
- sp2 hibritleşmesi (1 tane s, 2 tane p orbitali hibritleşir.)
- sp hibritleşmesi (1 tane s, 1 tane p orbitali hibritleşir.)
- Hibrit orbitallerinin kendilerine özgü isimleri vardır:
- sp3 hibrit orbitalleri (4 kardeş orbitaldir.)
- sp2 hibrit orbitalleri (3 kardeş orbitaldir.
- sp hibrit orbitalleri (2 kardeş orbitaldir.)
- Hibritleşmenin türü atomun kuracağı σ (sigma) ve π (pi) bağlarının sayısını belirler.
σ (Sigma) ve π (Pi) Bağları
- Kovalent bağlar, şu şekilde ikiye ayrılır.
- σ (Sigma) bağı
- π (Pi) bağları
σ (Sigma) Bağı
- İki ametal arasında kurulan ilk kovalent bağ sigma bağıdır.
- Sigma bağı yoksa, atomlar kovalent bağ kurmamış demektir.
- İki tane yarı dolu orbitalin kesişmesi ile bir sigma bağı oluşur.
Karbon atomunun sigma bağları, hibrit orbitalleri ile kurulur.
π (Pi) Bağı
- Pi bağı, ikili veya üçlü kovalent bağlarda görülür.
- İkili kovalent bağın, bir tanesi sigma diğeri pi bağıdır.
- Üçlü kovalent bağın, bir tanesi sigma, diğer ikisi pi bağlarıdır.
Karbon atomunda hibritleşmeye katılmayan yarı dolu orbitaller, pi bağı oluşturur.
Hibritleşme Türüne Göre Sigma ve Pi Bağı Sayısı
Karbon atomunun kurduğu kovalent bağların türleri şöyle tespit edilir:
- sp3 hibritleşmesi yapan C atomu, 4 tane sigma bağı kurar, hiç pi bağı kurmaz.
- sp2 hibritleşmesi yapan C atomu, 3 tane sigma bağı kurar, 1 tane pi bağı kurar.
- sp hibritleşmesi yapan C atomu, 2 tane sigma bağı kurar, 2 tane pi bağı kurar.
Öğretici örnek:
Aşağıda, etilen ve asetilen molekülündeki bağların, nasıl sigma ve pi olarak sınıflandırıldığını görüyorsunuz:

Öğretici Örnek:
Aşağıdaki organik molekülde belirtilen, σ (sigma) ve π (pi) bağlarını inceleyiniz.

C Atomunun Temel Hal Orbitalleri
- C atomu, 6 proton ve 6 elektronu olan küçük ve yetenekli bir atomdur.
- C atomunun orbital dizilimi şu şekildedir:
- 6C6 1s2 2s2 2p2
- C atomunun, hibritleşmeden önce, temel haline ait, enerji seviyeleri ile birlikte orbital dizilimini göstermek istersek, şöyle gösterebiliriz:

Hibritleşmeden önce, s ve p orbitalleri şöyle görünür:
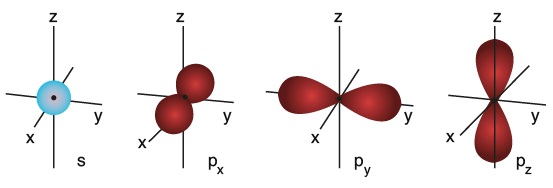
- Temel hal orbital dizilimine bakarsak, 2p orbitallerinin enerjisinin en yüksek olduğunu, 2s orbitallerinin enerjisinin de 2p orbitallerinden düşük olduğunu görürüz.
- C atomunun değerlik orbitalleri, 2s2 ve 2p2 orbitalleri olduğu için, hibritleşme bu iki orbital arasında gerçekleşir.
C Atomunun sp3 Hibritleşmesi
- C atomunda sp3 hibritleşmesi, atomun son yörüngesinde bulunan; 2s orbitali ile 3 tane kardeş 2p orbitalinin melezleşmesi ile oluşur.
- Hibritleşme gerçekleşmeden önce;
- uyarılma gerçekleşir ve
- 2s elektronlarından biri boş 2p orbitaline sıçrar.
- sp3 hibritleşmesinde;
- 2s orbitalinin enerjisi biraz artar
- 2p orbitallerinin üçünün de enerjisi biraz azalır
- Böylece 4 tane orbital ortada buluşur ve enerjileri eşitlenir
- Bu arada, 2s2 orbitalinin 1 elektronu boş olan 2p2 orbitallerine geçer.
- Bu olaylar sonucu, C atomu temel halden sp3 hibritleşmesi yapmış hale geçer.
- sp3 hibrileşmesi esnasında gerçekleşen bütün bu olaylar şu şekilde gösterilebilir:
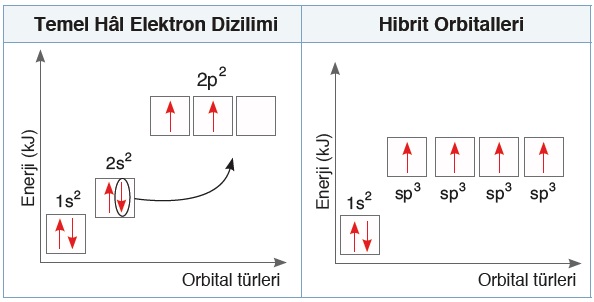
- Yukarıda görüldüğü gibi, sp3 hibrit orbitalleri, 4 tane yarı dolu orbitaldir.
- sp3 hibrit orbitalleri; biri sönük diğeri şişik iki tane balonun ağızlarından eklenmesiyle oluşan şekler benzer.
- Aşağıda, 4 adet sp3 hibrit orbitali, yönleri ile birlikte verilmiştir:

- Atomun çekirdeğinin etrafında, 4 tane sp3 hibrit orbitali, hep birlikte şöyle görünür:

sp3 Hibritleşmesi Yapmış C Atomunun Özellikleri
- sp3 orbitallerin hep birlikte oluşturduğu şekle bakarsak, eş üçgenlerden oluşan bir üçgen piramittir.
- Bu şekle düzgün dörtyüzlü denir.
- Kovalent bağlar arasındaki açı 109,5 derecedir.
- C atomu ile kovalent bağ kurmak isteyen atomlar, bu 4 tane hibrit orbitali ile kesişerek bağlanırlar.
- Yani; karbon atomuna bağlanacak atomlar, bu orbitallerin elektronlarını ortaklaşa kullanır.
- sp3 hibritleşmesi yapmış C atomu, 4 tane tekli kovalent bağ kurar.
- Tekli kovalent bağların hepsi σ (sigma) bağıdır:
- Bu karbon atomunun oluşturduğu moleküllerin geometrik şekli, düzgün dörtyüzlüdür.
- Çizim zorluğundan dolayı dik açılı gibi çizilir fakat; kovalent bağlar arasındaki açı 109,5 derecedir.
- İkili veya üçlü kovalent bağ yapmayan bütün C atomları sp3 hibritleşmesi yapmış demektir.
CH4 (Metan) Molekülü
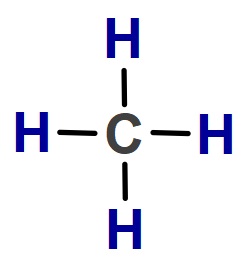
- CH4 molekülünün Lewis Elektron Nokta Yapısı’na bakarsak, C atomunun 4 tane tekli bağ (σ – sigma bağı) yaptığını görürüz. Bu yüzden;
- CH4 molekülündeki C atomu sp3 hibritleşmesi yapmıştır.
- CH4 molekülünün geometrik şekli düzgün dörtyüzlüdür.
- CH4 molekülünde, bağlar arasındaki açı 109,5 derecedir.
Aşağıda, orbitaller yapıları ile, CH4 molekülünün oluşumu verilmiştir:

CCl4 (Karbon Tetraklorür) Molekülü

- CCl4 molekülünün Lewis Elektron Nokta Yapısı’na bakarsak, C atomunun 4 tane tekli bağ (σ – sigma bağı) yaptığını görürüz. Bu yüzden;
- CCl4 molekülündeki C atomu sp3 hibritleşmesi yapmıştır.
- CCl4 molekülünün geometrik şekli düzgün dörtyüzlüdür.
- CCl4 molekülünde, bağlar arasındaki açı 109,5 derecedir.
C2H6 (Etan) Molekülü

- C2H6 molekülünün Lewis Elektron Nokta Yapısı’na bakarsak, C atomlarının ikisinin de 4’er tane tekli bağ (σ – sigma bağı) yaptığını görürüz. Bu yüzden;
- C2H6 molekülündeki 2 C atomu da sp3 hibritleşmesi yapmıştır.
- C2H6 molekülünün geometrik şekli, birbirine eklenmiş 2 tane düzgün dörtyüzlüdür.
- C2H6 molekülünde, bağlar arasındaki açı 109,5 derecedir.
C2H6 molekülünün orbital yapısı şöyledir:

C Atomunun sp2 Hibritleşmesi

- sp2 hibritleşmesinde; s orbitali ve kardeş p orbitallerinden 2 tanesi hibritleşmeye katılır, geriye kalan 1 tane p orbitali hibritleşmeye katılmaz. Yani; sp2 hibritleşmesine toplam 3 tane orbital katılır.

- s orbitali; sp3 hibritleşmesinde olduğu gibi bir elektronunu, boş olan p orbitaline verir.
- s orbitali ile 2 tane yarı dolu kardeş p orbitali, aynı enerji düzeyinde buluşur. (sp3 hibritleşmesinde olduğu gibi)
- sp2 hibritleşmesi sonucu, 3 tane sp2 hibrit orbitali oluşur.

- sp2 hibrit orbitalleri, atomun çekirdeğinden dışarıya doğru yönelen ve aralarında 120o açı olan 3 adet eş orbitaldir.
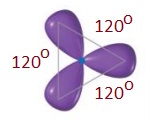
sp2 Hibritleşmesi Yapmış C Atomunun Özellikleri
- sp2 hibritleşmesi yapmış C atomu, 2 tane tekli 1 tane ikili kovalent bağ kurar.

- İkili kovalent bağlarının biri σ (sigma); diğeri π (pi) bağıdır.
- Tekli kovalent bağların ikisi de σ (sigma) bağıdır:
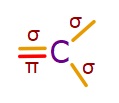
- sp2 hibritleşmesi yapmış C atomunun bağları arasındaki açı 120o‘dir.
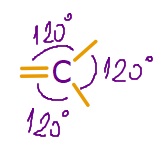
- Bu karbon atomunun oluşturduğu molekülleri geometrik şekli, düzlem üçgendir.
C2H4 (Etilen) Molekülü
Etilen, diğer adıyla eten molekülündeki C atomlarının ikisi de sp2 hibritleşmesi yapmıştır. Moleküle yakından bakalım:

- Etilen molekülündeki σ (sigma) ve π (pi) bağları şöyledir:

- C-H bağlarının her biri bir σ (sigma) bağıdır.
- sp2 hibrit orbitalleri 3 tanedir ve hepsi σ (sigma) bağı kurmak için kullanılır.
- C atomları, 3’er tane σ (sigma) bağlarını sp2 hibrit orbitalleri ile yapar.
- sp2 hibritleşmesine katılmayan p orbitali ise π (pi) bağı kurmak için kullanılır.
- C-H bağındaki elektronların biri H atomunun yarı dolu s orbitalinden, diğeri de C atomunun sp2 hibrit orbitalinden gelir.
- C=C atomları arasındaki σ (sigma) bağının elektronları, bu atomların yarı dolu birer sp2 hibrit orbitalinden gelir.
- C=C arasındaki π (pi) bağı ise, C atomlarının sp2 hibritleşmesine katılmayan p orbitallerinin ortaklaşması ile oluşur.

- Orbital yapısı ile C2H4 (Etilen) molekülünündeki sigma bağlarını şöyle gösterebiliriz:

- Orbital yapısı ile C2H4 (Etilen) molekülünündeki pi bağını şöyle gösterebiliriz:
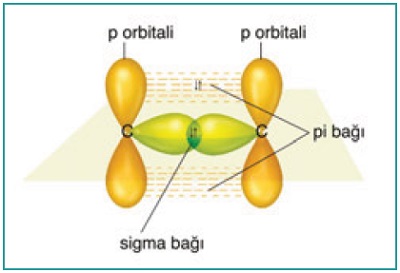
- Orbital yapısı ile C2H4 (Etilen) molekülünündeki sigma ve pi bağlarını, hep birlikte şöyle gösterebiliriz:

C Atomunun sp Hibritleşmesi

- sp hibritleşmesinde; s orbitali ve kardeş p orbitallerinden 1 tanesi hibritleşmeye katılır, geriye kalan 2 tane p orbitali hibritleşmeye katılmaz. Yani; sp hibritleşmesine toplam 2 tane orbital katılır.

- s orbitali; önceki hibritleşme türlerinde olduğu gibi bir elektronunu, boş olan p orbitaline verir.
- s orbitali ile 1 tane yarı dolu kardeş p orbitali, aynı enerji düzeyinde buluşur.
- sp hibritleşmesi sonucu, 2 tane sp2 hibrit orbitali oluşur.

- sp2 hibrit orbitalleri, atomun çekirdeğinden dışarıya doğru yönelen ve aralarında 120o açı olan 3 adet eş orbitaldir.

sp Hibritleşmesi Yapmış C Atomunun Özellikleri
- sp hibritleşmesi yapmış C atomu:
- 2 tane ikili kovalent bağ veya
- 1 tane tekli 1 tane üçlü kovalent bağ kurar.

- İkili kovalent bağlarının biri σ (sigma); diğeri π (pi) bağıdır.
- Üçlü kovalent bağlarının biri σ (sigma); diğer ikisi π (pi) bağıdır.
- Tekli kovalent bağ, σ (sigma) bağıdır:

- sp hibritleşmesi yapmış C atomunun bağları arasındaki açı 180o‘dir.

- Bu karbon atomunun oluşturduğu molekülleri geometrik şekli, doğrusaldır.
C2H2 (Asetilen veya Etin) Molekülü
- Etin, diğer adıyla asetilen molekülündeki C atomlarının ikisi de sp hibritleşmesi yapmıştır. Moleküle yakından bakalım:

- Etilen molekülündeki σ (sigma) ve π (pi) bağları şöyledir:

- C-H bağlarının her biri bir σ (sigma) bağıdır.
- sp hibrit orbitalleri 2 tanedir ve hepsi σ (sigma) bağı kurmak için kullanılır.
- C atomları, 2’şer tane σ (sigma) bağlarını sp hibrit orbitalleri ile yapar.
- sp hibritleşmesine katılmayan p orbitalleri ise 2 tane π (pi) bağı kurmak için kullanılır.
- C-H bağındaki elektronların biri H atomunun yarı dolu s orbitalinden, diğeri de C atomunun sp hibrit orbitalinden gelir.
- C
 C atomları arasındaki σ (sigma) bağının elektronları, bu atomların yarı dolu birer sp hibrit orbitalinden gelir.
C atomları arasındaki σ (sigma) bağının elektronları, bu atomların yarı dolu birer sp hibrit orbitalinden gelir. - C
 C atomları arasındaki π (pi) bağları ise, C atomlarının sp hibritleşmesine katılmayan p orbitallerinin ortaklaşması ile oluşur.
C atomları arasındaki π (pi) bağları ise, C atomlarının sp hibritleşmesine katılmayan p orbitallerinin ortaklaşması ile oluşur.
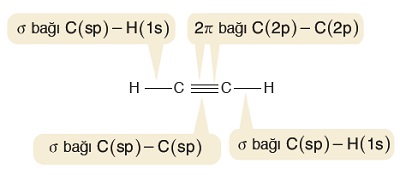
- Orbital yapısı ile C2H2 (Asetilen) molekülünündeki sigma bağlarını şöyle gösterebiliriz:

- Orbital yapısı ile C2H2 (Asetilen) molekülünündeki pi bağlarını şöyle gösterebiliriz:

Örnek:

Yukarıda bazı organik moleküller ve bu moleküllerdeki C atomları numaralandırarak verilmiştir.
Buna göre; C atomlarını hibritleşme türlerine göre sınıflandırınız.
Cevap
Örneğin çözümü:
VSEPR Yaklaşımı ve Molekül Geometrisi
Karbon (C) atomunun, bütün hibritleşme türlerini detaylı bir şekilde gördük. Peki; diğer atomlarda hibritleşme olmaz mı? Olursa, hangi hibritleşmeler olur ve bu atomların molekülleri neye benzer? Bu soruların cevabını VSEPR kuralı verir.
- VSEPR: Değerlik Katmanı Elektron Çifti İtmesi (Valance Shell Electron Pair Repulsion)
- Atomların hibritleşmeye katılan orbitalleri her zaman yarı dolu olmayabilir.
- 5A ve 6A atomlarının tam dolu bir değerlik orbitali de sp3 hibritleşmesine katılır.
- Hibritleşmeye katılan bu orbitaller tam dolu oldukları için bağa katılmadan ayrı dururlar.
- Bu orbitaller, bağ kuran orbitalleri (elektron çiftlerini) iterler. (Elektronlar arası itme)
- Bu durum bağ kuran orbitallerin birbirine yaklaşmasına sebep olur ve bağ açılarını küçültür.
- Bu da molekül geometrisini etkiler.
- VSEPR kuralı, bağa katılmayan hibrit orbitallerinin, molekül geometrisine etkisini açıklar.
N (Azot) Atomunun Hibritleşmesi (sp3)
- N atomunun 7 tane protonu ve temel halde 7 tane elektronu vardır.
- N atomunun temel hal orbital dizlimi şöyledir:
- 7N7 1s2 2s2 2p3
- N atomu, sp3 hibritleşmesi yapar. Hibritleşme olayı şöyle gerçekleşir:

- Hibrit orbitallerine bakarsak, 4 tane sp3 hibrit orbitali görürüz. Bu orbitallerin:
- 1 tanesi tam doludur:
- Bağa katılmazlar, bağ orbitallerini iterek kendinden uzaklaştırır.
- 3 tanesi yarı doludur:
- Diğer atomların (mesela H atomlarının) yarı dolu değerlik orbitalleri ile örtüşerek 3 tane sigma bağı yaparlar.
- 1 tanesi tam doludur:
- NH3 molekülünün orbital yapısına bakarak, N atomunun hibritleşmiş halini, molekülünde iken görelim:

- N atomunda, bağa katılmayan hibrit orbitalinin bağları iterek, molekül geometrisini nasıl etkilediğini aşağıda şekilde daha net görüyoruz:

- 5A grubu atomlarının (N gibi) H veya halojenler ile yaptığı moleküller:
- Üçgen Piramit bir geometrik şekle sahiptir.
- Bu tür moleküllerde, bağ açısı 107o‘dir.
O (Oksijen) Atomunun Hibritleşmesi (sp3)
- O atomunun 8 tane protonu ve temel halde 8 tane elektronu vardır.
- O atomunun temel hal orbital dizlimi şöyledir:
- 8O8 1s2 2s2 2p4
- O atomu, sp3 hibritleşmesi yapar. Hibritleşme olayı şöyle gerçekleşir:

- Hibrit orbitallerine bakarsak, 4 tane sp3 hibrit orbitali görürüz. Bu orbitallerin:
- 2 tanesi tam doludur:
- Bağa katılmazlar.
- Bağ orbitallerini ve birbirlerini iterek molekül geometrisini etkilerler.
- 2 tanesi yarı doludur:
- Diğer atomların (mesela H atomlarının) yarı dolu değerlik orbitalleri ile örtüşerek 2 tane sigma bağı yaparlar.
- 2 tanesi tam doludur:
- H2O molekülünün orbital yapısına bakarak, O atomunun hibritleşmiş halini, molekülünde iken görelim:

- O atomunda, bağa katılmayan 2 tane sp3 hibrit orbitalinin bağları iterek, molekül geometrisini nasıl etkilediğini aşağıda şekilde daha net görüyoruz:

- 6A grubu atomlarının (oksijen gibi), H veya halojenler ile yaptığı moleküller:
- Kırık Doğru (Açısal) bir geometrik şekle sahiptir.
- Bağ açıları 104,5o‘dir.
Moleküllerin VSEPR Formülleri
- VSEPR kuralına göre, molekülün VSEPR formülü bulunursa, hibritleşme türü ve molekül geometrisi de bulunabilir.
- Bir molekülün VSEPR formülü şu şablona göre yazılır:
AXnEm
- Bu formüldeki sembollerin anlamı şudur:
- A: Molekülün Merkez atomunu temsil eder. Bir molekülün merkez atomu, genelde sayısı az olan atomdur.
- X: Molekülün merkez atomuna bağlı diğer atomları temsil eder.
- n: Molekülün merkez atomuna bağlı diğer atomların sayısıdır.
- E: Molekülün merkez atomunun, bağa katılmayan elektron çiftlerini temsil eder.
- m: Molekülün merkez atomunun, bağa katılmayan elektron çiftlerinin sayısıdır. (Dikkat edin; elektron sayısı değil, elektorn çiftlerinin sayısıdır.)
Aşağıda, şu ana kadar öğrendiğimiz atom ve moleküllere dair bilgiler özetlenmiştir. Bu tablo dikkatle incelenmelidir.

Örnek:
VSEPR gösteriminde;
- A harfi: Merkezdeki atomu temsil eder.
- X harfi: Merkez atoma bağlı atomları temsil eder.
- E harfi: Merkez atomun bağ katılmayan değerlik orbitallerini (elektron çiftlerini) gösterir.
Buna göre; VSEPR formülü AX2E2 şeklinde olan bir molekül için aşağıda verilen bilgilerden hangisi yanlıştır? (8O)
A) Molekül H2O olabilir.
B) Merkezdeki atomun, temel halde iken değerlik elektron sayısı 6’dır.
C) Molekülün geometrisi, üçgen piramide benzer.
D) Bağ açıları 104,5 derecedir.
E) Merkez atom sp3 hibritleşmesi yapmıştır.
