İçindekiler
- Tabiattaki gazlar, genellikle gaz karışımları, halinde karşımıza çıkar.
- Mesela hava, LNG, LPG gibi gazlar, birer gaz karışımıdır.
Kısmi Basınç (Dalton Kısmi Basınçlar Kanunu)
- Kısmi basınç; gaz karışımlarında geçerli bir kavramdır.
- Yandaki şekilde:
- X gazının kısmi basıncı PX , mol sayısı nX
- Y gazının kısmi basıncı PY , mol sayısı nY
- Z gazının kısmi basıncı PZ , mol sayısı nZ
ile gösterilir.

Kısmi Basınç Nedir?
- Bir gaz karışımında, bir gazın tek başına yaptığı basınca o gazın kısmi basıncı denir.
- Kaptaki diğer gazların hepsini boşaltıp, sadece bir tane gaz bırakırsak, kaptaki gaz basıncı, o gazın kısmi basıncı kadar olur.
- Kısmi basınçlarının toplamı, gaz karışımının basıncını verir.
PT = Px + Py + Pz …
Kısmi Basınç (Px) Nasıl Hesaplanır?
- Bir gaz karışımındaki X gazının kısmi basıncı şöyle hesaplanır:

- Formüldeki nx / nT ifadesi, X gazının mol kesridir.
- Ya da; toplam basınç, mol sayıları ile doğru orantılı olarak paylaştırılırsa her gazın kısmi basıncı bulunmuş olur.
Örnek:

Yukarıdaki şekilde, kapalı ve sabit hacimli bir kap içinde; X, Y ve Z gazları vardır. Bu gazların mol sayıları sırasıyla 2, 1 ve 3 moldür; yaptıkları toplam basınç ise 18 atm’dir.
Buna göre, karışımdaki her bir gazın kısmi basıncını hesaplayınız.
Sorunun Çözümü
Bu bir reklamdır:
Su Üzerinde Gaz Toplanması
Suyun Buhar Basıncı (PH2O)
- Suyun üzerinde, her sıcaklıkta bir miktar buharı ve bir buhar basıncı mutlaka olur.
- Buhar halindeki maddeler, bütün gazlar gibi bir basınca sahiptir.
- Bir sıvının üzerinde biriken buharın yaptığı basınca buhar basıncı veya denge buhar basıncı denir.
Suyun Üzerinde Gaz Toplama
- Bazı katı veya sıvıların tepkimelerinde gaz halinde maddeler oluşur.
- Oluşan gazları, kaçırmadan tutmanın bir yolu, bu gazları su üzerinde toplamaktır.
Su üzerinde gaz toplama düzeneği – Başlangıç
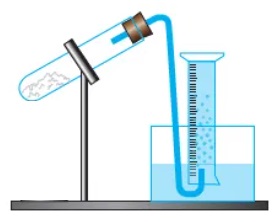
- Bir gazı su üzerinde toplamak için, tamamen su dolu ve ağzı açık bir kap, daha büyük kısmen su dolu başka bir kap içerisinde ters çevrilir.
- Tepkimede oluşan gaz, bir boru yardımı ile ters çevirdiğimiz bu kabın ağzından salınır.
Su üzerinde gaz toplama düzeneği – Sonuç

- Tepkime başladığında, tepkimede oluşan gaz, boruyu takip ederek, borunun ucundan kabarcıklar halinde ters duran kaptaki suyun yüzeyinde birikecek, gaz biriktikçe su seviyesi aşağıya inecektir.
Öğretici Örnek:
- Sorularda; gaz çıkışı olan bir tepkime verilir.
- Aşağıdaki tepkime; Oksijen gazı (O2(g)) üreten bir tepkimedir:
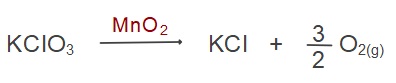
- Tepkimede oluşan oksijen gazını kaçırmadan toplamak için, tepkime şöyle bir düzenek kurularak gerçekleştirilir:

- Burada dikkat etmemiz gereken kısım:
- Oluşan Oksijen gazının su üzerinde toplanması
- Oksijenin toplandığı kapta su seviyesinin aşağıda doğru inmesi
- Leğendeki su seviyesinin ise artmasıdır.
- Bu 3 olay, tepkime bitene kadar devam eder.
- Biraz önce de belirttiğimiz gibi, Oksijen gazının toplandığı yerde, su baharı da vardır.
- Su üzerindeki toplam gaz basıncı (PT) şöyle hesaplanmalıdır:
- PT = PO2 + PH2O
- PT = Su üzerindeki toplam gaz basıncı
- PO2 = Tepkimede oluşan ve su üzerinde biriken Oksijen gazının kısmi basıncı
- PH2O = Suyun, o sıcaklıktaki buhar basıncı (denge buhar basıncı da denir)
- PT = PO2 + PH2O
Örnek:
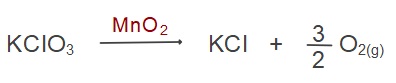
Yukarıdaki tepkime 27 oC’de gerçekleşmiş ve sonuçta, su üzerinde 820 mL oksijen gazı birikmiştir.
Su üzerindeki toplam basınç 408,5 mmHg olduğuna göre oluşan oksijen gazının kütlesini hesaplayınız. (27 oC sıcaklıkta suyun buhar basıncı PH2O = 28,5 mmHg, O: 16 g/mol)
Sorunun Çözümü
Bu bir reklamdır:
Gazların Karıştırılması
- Birbirine bağlı olan, farklı kaplardaki gazaların, aralarındaki musluğun açılması ile birbiri içinde dağılmasına izin verilirse, homojen bir gaz karışımı oluşur.
- Bu tip sorularda, musluklar açıldıktan sonra, oluşan gaz karışımının toplam basıncı (PT) aşağıdaki 2 formülle hesaplanır.
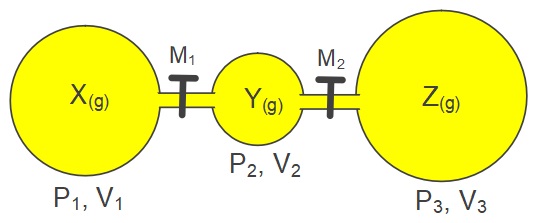
- Sabit sıcaklıkta ve tepkime olmadan musluklar açılırsa, son basıncı (PT) şu formüller hesaplarız:
PT.VT = P1.V1 + P2.V2 + P3.V3
- Yandaki kaplarda, M1 ve M2 muslukları açılırsa, toplam hacim (VT) şöyle hesaplanır:
- VT = V1 + V2 + V3
- M1 ve M2 muslukları açılırsa, PT değeri ideal gaz denklemi ile de bulunabilir:
PT.VT = nT.R.T
- Bu formül, sıcaklık sabit kalsın kalmasın; gazlar arasında tepkime olsun olmasın geçerlidir.
- nT, kaplardaki gazların mol sayılarının toplamıdır.
- nT = n1 + n2 + n3
Örnek:

Yukarıda, basınç ve hacim değerleri verilen kapların arasındaki M1 musluğu, sabit sıcaklıkta açılırsa, oluşan gaz karışımının toplam basıncı ne olur?
Sorunun Çözümü
Bu bir reklamdır:
Örnek:

Yukarıdaki şekilde, basınç ve hacim değerleri verilen kapların arasında M1 musluğu vardır.
Buna göre musluk, sabit sıcaklıkta açıldığında, He ve N2 gazlarının kısmi basınçları ne olur?
Sorunun Çözümü
Bu bir reklamdır:

1 yorum: “4. Gaz Karışımları”