İçindekiler
- Gerçek hayatta, ideal gaz diye bir gaz yoktur; gerçek hayatta “gerçek gazlar” vardır.
- Şu ana kadar; gazlar ile ilgi olarak öğrendiğimiz formüller ve kurallar, ideal gazlar için oldukça iyi çalışır.
- Fakat gerçek bir gaz için bu formülleri kullanmak istersek, bulduğumuz sonuç; gerçek değerlere uymayabilir.
- Şu ana kadar; gazlar ile ilgi olarak öğrendiğimiz formüller ve kurallar, ideal gazlar için oldukça iyi çalışır.
Gerçek Gazın İdeal Gazdan Farkı
İdeal Gaz
- Kimyasal türler esnek çarpışmalar yapar.
- Kimyasal türlerinin hacmi yok kabul edilir.
- Kimyasal türleri arasında etkileşim yok kabul edilir.
Gerçek Gaz
- Esnek çarpışma yoktur.
- Kimyasal türlerinin de bir hacmi vardır ve bu hacme öz hacim denir.
- Gerçek gaz, idealinden daha fazla hacim kaplar.
- Kimyasal türleri arasında az da olsa etkileşim vardır.
- Gerçek gazın basıncı idealinden daha azdır.
Gerçek Gazlar Ne Zaman İdeale Daha Yakın Davranır?
- Aşağıdaki koşullarda, gerçek gazlar ideal gaza daha yakın davranır:
- Yüksek sıcaklık
- Düşük basınç
- Düşük mol ağırlığı (MA)
- Kimyasal türleri apolarken
Gerçek Gazların İdeallikten Sapmaları
- Gerçek bir gazın ideallikten ne kadar saptığını anlamak için şöyle yaparız:
1. Bütün ideal gazlar, ideal gaz denklemine uygun hareket ederler:
P.V = n.R.T
2. Formülden mol sayısın (n) çekersek formül şöyle olur:

3. Bir ideal gaz 1 mol ise P.V / R.T değeri her zaman 1 çıkar:
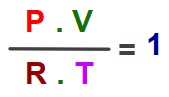
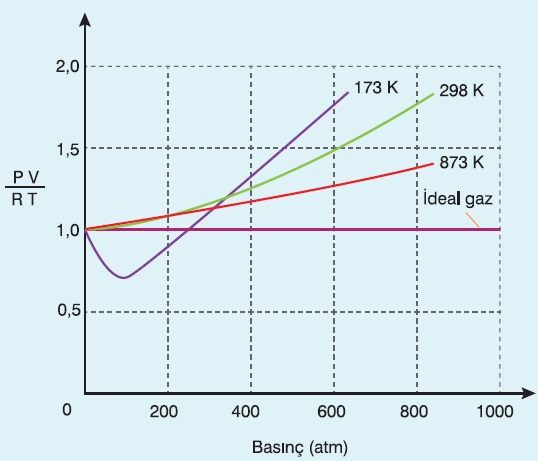
4. O zaman; gerçek bir gazdan 1 mol alıp, kapalı bir kaba koyalım ve P, V ve T değerlerini bir şekilde ölçelim. Sonra gazın (P.V/R.T) oranını hesaplayalım. İşte bu oran 1 çıkıyorsa, gaz bir ideal gaz gibi davranıyordur. Bu oran 1 den ne kadar farklı çıkıyorsa, gaz; ideal gazdan o kadar uzak davranıyordur.
- MA arttıkça ideallikten uzaklaşılır:

- Sıcaklık arttıkça idealliğe yaklaşılır:
Faz Diyagramları (Basınç-Sıcaklık Grafiği)
- Her maddenin bir faz diyagramı vardır.
- Maddelerin basınç-sıcaklık grafikleridir.
- Bir maddenin, basınç ve sıcaklık değerine göre katı–sıvı–gaz hallerinden hangisinde oluğunu görmemizi sağlar.
- Bir maddenin hangi dış basınçta iken kaç derecede hal değiştirdiğini de görebiliriz.
- Özensiz çizilmiş bir “Y” harfine benzerler.

Faz Diyagramından Maddenin Fiziksel Halini Bulma
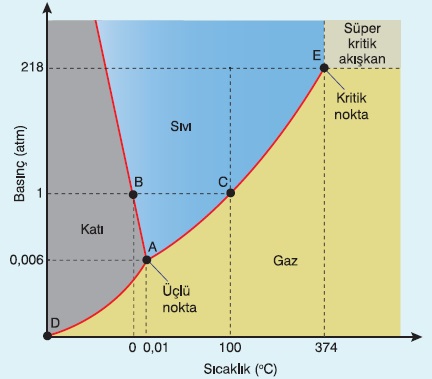
- Bütün faz diyagramlarında 3 tane faz bölgesi vardır.
- Faz bölgeleri, maddelerin katı-sıvı-gaz hallerinde oldukları sıcaklık ve basınç değerlerini gösterir.
- Faz bölgelerinin sırası her zaman aynıdır ve yandaki gibidir.

- Faz bölgeleri arasındaki çizgiler faz sınırlarıdır ve hal değişim noktalarını gösterir.
- Grafikteki A noktası üçlü nokta olarak bilinir.
- Üçlü noktada madde hem katı hem sıvı hem de gaz halindedir.
Örnek:

Faz diyagramı verilen CO2‘in aşağıdaki koşullardaki fiziksel halini bulunuz.
- 10 atm basınç ve -78,5 oC sıcaklıkta
- 10 atm basınç ve -20 oC sıcaklıkta
- 1 atm basınç ve -20 oC sıcaklıkta
Çözüm:

Verilen basınç-sıcaklık çiftlerinin kesişim noktaları hangi bölgede ise maddenin fiziksel hali odur:
- 10 atm ve -78,5 oC de madde KATI
- 10 atm ve -20 oC de madde SIVI
- 1 atm ve -20 oC de madde GAZ halindedir.
Örnek:

CO2‘e ait faz diyagramı verilmiştir. Buna göre, grafikte verilen A, B, C, D ve E noktalarının anlamları nedir?
Çözüm:
- Grafiğe baktığımızda; A, B, C, D ve E noktalarının hepsi, faz sınırlarındadır.
- Faz sınırına denk gelen noktalar, CO2‘in hal değişim noktalarıdır.
- A noktası: Üçlü noktadır.
- B noktası: Süblimleşme veya kırağılaşma noktasıdır.
- C noktası: Erime veya donma noktasıdır.
- D noktası: Kaynama veya yoğunlaşma noktasıdır.
- E noktası: Kaynama veya yoğunlaşma noktasıdır.
Faz Diyagramında Hal Değişim Sıcaklığı – Dış Basınç İlişkilisini Görme

- Faz diyagramlarnda, faz sınırlarına bakarak şunları görebiliriz:
- Bir maddenin, erime noktası, dış basınç arttıkça artar, azaldıkça azalır.
- Bir maddenin, kaynama noktası, dış basınç arttıkça artar, azaldıkça azalır.
- Bir maddenin, süblimleşme sıcaklığı, dış basınç arttıkça artar.
Suyun Faz Diyagramı
- Suyun diyagramında, katı-sıvı faz sınırı diğer maddelerden farklıdır ve sola yatıktır.


- Su dışındaki maddelerde, dış basınç arttıkça, maddenin donma sıcaklığı da artar, fakat; suyun donma sıcaklığı, dış basınç arttıkça azalır.
- Suyun faz diyagramındaki katı-sıvı sınırının diğer maddelere göre farklı olmasının sebebi budur.
Gaz – Buhar – Kritik Nokta
- Gazlar kritik noktadan, sonra basınç ile sıkışıp sıvılaşabilme özelliklerini kaybederler.
- Bir gazın, sıkışıp sıvılaşma özelliğini koruyabildiği, son sıcaklık ve basınç değerine kritik nokta denir.
- Kritik noktadaki sıcaklık değerine kritik sıcaklık, basınç değerine kritik basınç denir.
- Kritik noktadan sonra, bütün gazlar, süper kritik akışkan, kritik noktadan önce buhar olarak adlandırılır.
- Suyun faz diyagramı ve kritik noktası:
Aşağıda bazı maddelerin, kritik sıcaklık ve basınç değerleri verilmiştir:

Joule-Thomson Olayı

- Joule-Thomson olayı, gazlardan (aslında buharlardan), buz dolabı veya klima yapabilmemizi sağlayan olaydır.
- Joule-Thomson olayında:
- Gaz, ortasındaki bir engelle ikiye bölünmüş, kapalı bir kabın, bir kısmından itilerek diğer kısmına geçer. Tabi; kabın diğer kısmına geçebileceği tek yol, kabı ikiye bölen engeldeki küçük bir delik ya da deliklerdir.
- Karşıya geçerken gazın sıcaklığı düşer ya da yükselir.
- Sıcaklık değişmiyorsa, Joule-Thomson olayı yok demektir.
- Bu durumda gaz ideale daha yakın bir gazdır.
- Jolue-Thomson olayının sebebi, kimyasal türler arasındaki zayıf etkileşimlerdir.
Joule – Thomson Olayı
Soğutucu Akışkanlar
- Joule-Thomson olayında sıcaklığı düşen gazlara, soğutucu akışkan denir.
- Soğutucu akışkan örnekleri;
- NH3 (Amonyak)
- Freon (CCl2F2)
- Puron (Kütlece %50 diklorometan ve pentafloretan)
- Amonyak ve Freon gazları çevre ve sağlık ve çevre açısından sakıncalı oldukları için; günümüzde Puron gazı soğutucu akışkan olarak kullanılmaktadır.
- İyi bir soğutucu akışkanın:
- Kritik sıcaklığı yüksek, kaynama noktasına düşük olmalıdır.
- Oda koşullarında buhar halinde olmalıdır.
- Çevreye zarar vermemelidir.
- Daha az enerji tüketmelidir.
- Ucuz ve kolay temin edilebilmelidir.
- Yanıcı ve zehirli olmamalı, kimyasal yönden metallerle tepkimeye girmemelidir.
- Uygulanabilir basınç altında buharlaşmalı ve sıvılaşmalıdır.
Örnek:
Aşağıdaki tabloda bazı maddelerin normal kaynama noktaları ve kritik sıcaklıkları verilmiştir.
| Madde | Kaynama Sıcaklığı (oC) | Kritik Sıcaklığı (oC) |
|---|---|---|
| X | -35,6 | 145 |
| Y | 60 | 322 |
| Z | 101 | 384,5 |
Buna göre bu maddeler için aşağıdakilerden hangisi yanlıştır?
A) X soğutucu akışkan olarak kullanılabilir.
B) Y, oda sıcaklığında gaz haldedir.
C) Z, 384,5 derecenin üzerinde sıkıştırılıp sıvılaştırılamaz.
D) Z maddesinin kimyasal türleri arasındaki etkileşim daha güçlüdür.
E) X 120 derecede, sıkışıp sıvılaşabilir.
Cevap
Çevremizdeki Joule-Thomson Olayları

Bir el pompası ile bisiklet tekerleği şişiren herkes, zamanla pompanın ısındığını bilir. Bu olay, sıcaklığın yükseldiği bir Joule-Thomson olayıdır.

Bir çakmağın gazını, valfine kalem batırarak boşaltan herkes, bir süre sonra kalemin üzerinin kırağılandığını ve soğuduğunu bilir. Bu olay, sıcaklığın düştüğü bir Joule-Thomson olayıdır.

Sıcaklığın düştüğü Joule-Thomson olayına; buzdolapları ve klimalar da örnek olarak verilebilir.
- Havadan; Azot ve Oksijen gazlarının elde edilmesi işleminde de, Joule-Thomson olayı sayesinde havanın sıcaklığı, -200 oC ye kadar düşürülür.

3 yorum “5. Gerçek Gazlar”