İçindekiler
- Gazlarda Kinetik Teori Nedir?
- Brown Hareketi Neye Benzer
- Gazların Difüzyonu (Graham Difüzyon Kanunu)
- Graham Difüzyon Kanunu
- Sorunun Çözümü
- Sorunun Çözümü
- Sorunun Çözümü
- Sorunun Çözümü
- Gazların Efüzyonu
- Sorunun Çözümü
- Sorunun Çözümü
- Müfredat Dışı Kalan Başlıklar
- Gazların Kimyasal Türlerinin Ortalama Kinetik Enerjileri
- Gazların Bir Tane Kimyasal Türünün Hızı
Gazlarda Kinetik Teori, James Maxwell, Ludwig Boltzman gibi bilim insanlarının çalışmaları sonucu ortaya çıkmıştır. Bu teori, bizlere İdeal Gazları tanıtır.
Gazlarda Kinetik Teori Nedir?
Gazlarda Kinetik Teoriye göre, ideal gazlar şu özellikleri taşır:
- Kimyasal türlerinin kapladığı hacim, aralarındaki boşluk yanında ihmal edilebilir.
- Kimyasal türleri arasında, itme ve çekme kuvvetlerinin olmadığı kabul edilir.
- Aynı sıcaklıktaki gazların, kimyasal türlerinin ortalama kinetik enerjileri eşittir.
- Gazların ortalama kinetik enerjileri sıcaklıkları ile doğru orantılıdır.
- Gazların kimyasal türleri arasında esnek çarpışmalar olur. (Esnek çarpışma demek; enerji kaybı olmayan çarpışma demektir.)
- Kimyasal türleri, başka bir türle çarpışana kadar, doğrusal hareket eder. Bu harekete Brown Hareketi denir.
- Brown hareketi ile ilgili görseller:
Brown Hareketi Neye Benzer
Gazların Difüzyonu (Graham Difüzyon Kanunu)
Difüzyon Nedir?
- Gir gazın, başka bir gazın içerisinde kendiliğinden yayılmasına difüzyon denir.
- Ya da; gazların az yoğun olduğu bir ortamdan, çok yoğun olduğu ortama doğru kendiliğinden akmasıdır.
Graham Difüzyon Kanununun Formülü
- X ve Y gazlarının, aynı sıcaklıkta iken yayılma (difüzyon) hızları Vx ve VY ise; bu hızlar arasındaki ilişki şudur:
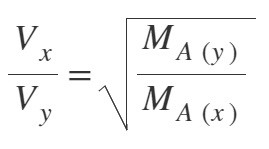
- “Graham Difüzyon Yasası” şu şekilde yorumlanabilir:
- Bir gazın yayılma (difüzyon) hızı, gazın mol kütlesinin (MA) karekökü ile ters orantılıdır.
- Yani iki gazdan birinin mol kütlesi 4 kat daha büyük ise, hızı diğer gaza göre 2 kat daha küçüktür.
- Bir gazın yayılma (difüzyon) hızı, gazın mol kütlesinin (MA) karekökü ile ters orantılıdır.
- Graham Difüzyon Yasası’na göre bir gazın difüzyon hızı:
- Gazın cinsine (MA)
- Gazın mutlak sıcaklığına (T) bağlıdır.
Graham Difüzyon Kanunu
Örnek:
Aynı sıcaklıkta O2 gazı ile H2 gazının difüzyon hızları arasındaki ilişkiyi bulunuz? (O: 16 g/mol, H: 1 g/mol)
Sorunun Çözümü
Bu bir reklamdır:
Örnek:
Aynı sıcaklıkta, He gazı X gazından 2 kat daha hızlı yayılmaktadır.
Buna göre X gazının mol ağırlığını (MA) kaçtır? (He: 4 g/mol)
Sorunun Çözümü
Bu bir reklamdır:
Difüzyon Formülü Şöyle Türetilir :
- Kinetik enerjinin formülünü hatırlayalım:
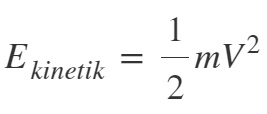
- Kinetik Teoriye göre; sıcaklıkları eşit olan X gazı ile Y gazının ortalama kinetik enerjileri de eşittir.
- X molekülünün kütlesi MA(x), Y molekülünün kütlesi MA(y) olsun.
- Hızları da sırasıyla Vx ve Vy olsun. Bu durumda:

- Yukarıdaki eşitlikte, Vx ve Vy aynı tarafta bırakılırsa:
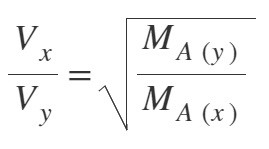
Bu eşitlik, Thomas Graham tarafından ve deneysel çalışmalar sonucu keşfedilmiştir.
Farklı Sıcaklıktaki İki Gazın Difüzyon Hızı Formülü
- Sıcaklıkları farklı olan X ve Y gazlarından; X gazının mutlak sıcaklığı Tx, Y gazının mutlak sıcaklığı ise Ty olsun.
- Bu durumda, difüzyon hızları arasındaki bağıntı şöyle olur:

Örnek:
27 oC sıcaklıktaki SO2 gazı ile 327 oC sıcaklıktaki O2 gazlarının yayılma hızları arasındaki ilişkiyi hesaplayınız? (SO2 : 64 g/mol, O2: 32 g/mol)
Sorunun Çözümü
Bu bir reklamdır:
Difüzyon Hızı İle Yoğunluk (Özkütle) İlişkisi
- Gazların yoğunluğu (d) ile mol ağırlıkları (MA) doğru orantılıdır.
- Bu yüzden, sıcaklıkları ve basınçları eşit olan X ve Y gazlarının, difüzyon hızları ile yoğunlukları arasındaki ilişki şu şekilde olur:
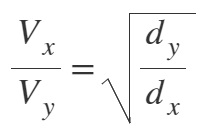
Örnek:
X gazının yoğunluğunun 0,05 g/L olduğu şartlarda Y gazının yoğunluğu 1,25 g/L’dir.
Buna göre, bu şartlarda, X gazının 60 metre yayıldığı sürede, Y gazı kaç metre yayılır?
Sorunun Çözümü
Bu bir reklamdır:
Gazların Efüzyonu
- Efüzyon olayı, patlamış bir araba lastiğindeki küçük bir delikten, havanın dışarı sızmasıdır.
- Lastik içindeki sıkışmış havanın basıncı, dışarıdaki havanın basıncından daha yüksektir.
- Bu yüzden lastikte bir delik açılınca, lastiğin havası boşalır.
- Lastik içindeki sıkışmış havanın basıncı, dışarıdaki havanın basıncından daha yüksektir.
- Gazların, yüksek basınçlı bir kapta açılan küçük bir delikten, düşük basınçlı bir ortama akmasına efüzyon denir.
- Efüzyon olayında, gazların hızları, difüzyon yasalarına göre karşılaştırılır.
Efüzyon Süresi – Difüzyon Hızı İlişkisi
- Aynı sıcaklıktaki X ve Y gazlarının;
- hızları Vx ve Vy ise,
- efüzyon süreleri tx ve ty ise, bu gazlar için aşağıdaki eşitliği yazabiliriz:

- Hız ile zaman ters orantılı büyüklüklerdir.
- Yani hızı büyük olanın zamanı kısa olur; hızlı giden çabuk varır.
- Aynı kural, efüzyon süresi için de geçerlidir.
- Difüzyonu hızlı olan gazın efüzyon süresi kısa olur.
Bu bir reklamdır:
Örnek:
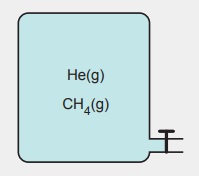
Yukarıdaki şekilde, aynı kabın içinde, eşit mol sayıda He ve CH4 gazları bulunmaktadır. Gazların toplam basıncı, dış basınçtan daha yüksektir. Bu şartlarda, kabın musluğu, kısa bir süre için açılıp kapatılıyor.
Buna göre, aşağıdaki yargılardan hangisi yanlıştır? (He: 4 g/mol, CH4: 16 g/mol)
A) Kaptan dışarıya akan He gazının mol sayısı, CH4 gazından daha çoktur.
B) Kapta kalan He gazının yaptığı basınç, CH4 gazından daha fazladır.
C) Kaptan boşalan CH4 gazının kütlesi daha fazladır.
D) Kaptaki gazların ortalama kinetik enerjileri eşittir.
E) He gazının kimyasal türleri, CH4 gazınınkilerden 2 kat hızlıdır.
Cevap
Sorunun Çözümü
Bu bir reklamdır:
Örnek:

Yukarıdaki şekilde, aralarında bir cam boru olan iki cam balonda, aynı koşullarda, He ve SO2 gazları bulunmaktadır. M1 ve M2 muslukları arasında görünen bölmeler eşit uzunluktadır.
Gazların muslukları aynı anda açıldığında, buluşma noktaları için ne söylenebilir? (He: 4 g/mol, SO2: 64 g/mol)
Sorunun Çözümü
Bu bir reklamdır:



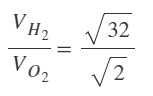
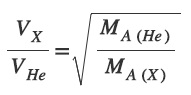
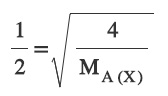
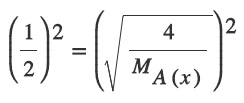
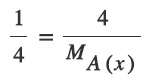
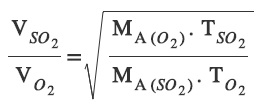
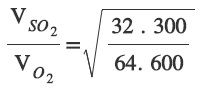
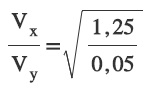


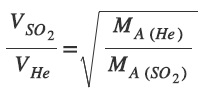



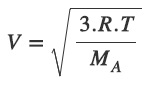
1 yorum: “3. Gazlarda Kinetik Teori”