İçindekiler
Lewis Formülleri, daha önce Kimya 9 dersinde ve “Kimyasal Türler Arası Etkileşimler” ünitesine karşımıza çıkmıştı. Bu ünitede, atomların ve bir çok molekülün Lewis Nokta Yapılarını göstermeyi öğrenmiştik. Bu ders, bu ünitede öğrendiğimiz Lewis Nokta Yapılarını‘nın, daha çok organik moleküller üzerinde bir uygulaması gibi olacaktır.
Kimya 9 dersinde gördüğümüz Lewis Nokta Yapıları ile ilgili eksiğiniz varsa, konuyu tekrar etmek için aşağıdaki dersi tekrarlamalısınız:
Organik Moleküllerin Lewis Nokta Yapıları
- Moleküller, kovalent bağ kurarak bir arada duran atomlardır.
- Kovalent bağ, ametaller arasında kurulan bir güçlü etkileşimdir.
- Organik bileşikler, kovalent bağlı bileşiklerdir.
- Bu yüzden, organik bileşikler moleküllerden oluşur.
- Lewis Elektron Nokta Yapısı‘nda, atomun sembolünün etrafına, son yörüngedeki (değerlik) elektron sayısı kadar nokta konulur.
- Aynı kenarda bulunan iki noktayı, bir çizgi ile gösterme hakkımız vardır, dilersek kullanırız, dilersek kullanmayız.
- Organik moleküllerde karşımıza çıkacak ametaller genellikle şunlardır:
- C (Karbon)
- H (Hidrojen)
- O (Oksijen)
- N (Azot)
- F (Flor)
- Cl (Klor)
- Br (Brom)
- I (İyot)
Bu ametallerin elektron dizilimleri ve Lewis yapıları şöyledir:
Organik bileşiklerde karşımıza çıkabilecek ametallerin elektron dağılımları şöyledir:
6C6 )2e– )4e–
1H1 )1e–
8O8 )2e– )6e–
7N7 )2e– )5e–
9F9 )2e– )7e–
17Cl17 )2e– )8e– )7e–
35Br35 2e– 8e– 18e– 7e–
53I53 2e– 8e– 18e– 18e– 7e–
Bu ametallerin Lewis Elektron Nokta Yapısı şöyledir:
- Organik moleküllerin Lewis Nokta Yapılarını yazmak için, Kovalent Bağlı Moleküllerin Lewis Nokta Yapılarına ait kuralları kullanırız.
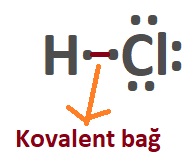
- Kovalent bağ, Lewis yapısındaki yalnız noktalar ile kurulur.
- Kovalent bağ kurulurken atomlar yalnız noktalarını (elektronlarını) ortaklaşa kullanır.
- İki ametal atomu, birer yalnız noktasını ortaya koyar ve bir kovalent bağ oluşur.
- Bir atomun, Lewis yapısında, kaç tane yalnız nokta varsa o sayıda kovalent bağ kurar.
Ametalleri, organik moleküllerde, aşağıdaki gibi kovalent bağlar kurarken görürüz:
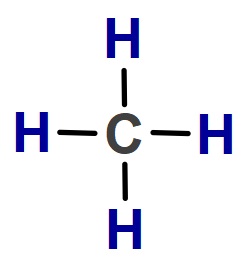
- C: 4 tane kovalent bağ yapar ve oktetini tamamlar. Lewis yapısındaki bütün elektronlar kovalent bağa katılır.

- H: 1 tane elektronu vardır ve onunla kovalent bağ yapar ve dubletini tamamlar.
- O: 2 tane kovalent bağ yapar ve oktetini tamamlar. 2 çift elektronu bağa katılmaz.
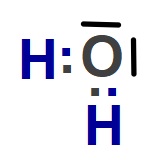 veya
veya 
- N: 3 tane kovalent bağ yapar ve oktetini tamamlar. 1 çift elektronu bağa katılmaz.

- F, Cl, Br ve I: 1 tane kovalent bağ yaparlar ve oktetlerini tamamlarlar. 3 çift elektronları bağa katılmaz.
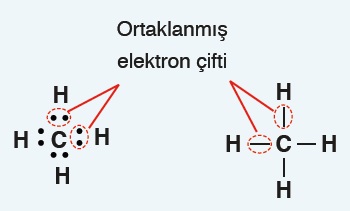
- Kovalent bağa katılan elektronlara, “ortaklanmış elektronlar” denir.
- Ortaklaşa kullanılmayan yani; kovalent bağa katılmayan elektronlara “ortaklanmamış elektronlar” denir.
Örnek:
Moleküllerde:
– C atomu 4 tane kovalent bağ yapar.
– H atomu 1 tane kovalent bağ yapar.
– Halojenler 1 tane kovalent bağ yapar ve 3 çift elektronu ortaklaşmazlar.
– O atomu 2 tane kovalent bağ yapar ve 2 çift elektronu ortaklaşmaz.
– N atomu 3 tane kovalent bağ yapar ve 1 çift elektronu ortaklaşmaz.
Bunları ezbere bilen bir öğrenci, aşağıda Lewis yapıları verilen moleküllerden hangisini hiç bir zaman çizmez?
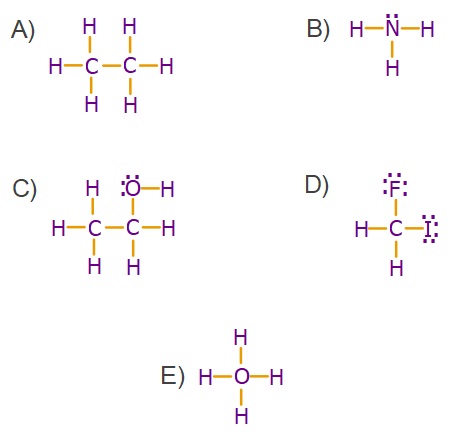
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Bazı Organik Moleküllerin Lewis Nokta Yapıları
HATIRLA:
- Kovalent bağ demek ortaklaşa kullanılan iki değerlik elektronu demektir.
- Bir kovalent bağdaki iki elektron:
- İki nokta ile de gösterilebilir.
- Kısa bir çizgi ile de gösterilebilir.
- Yapı formüllerinde, kovalent bağlardaki elektron çiftleri kısa çizgilerle gösterilirler.


Bu bir reklamdır:
