İçindekiler
Sevgili öğrencim, ünitenin adında geçen “etkileşim” kavramının “bağ” anlamına geldiğinden daha önce bahsetmiştik. Bu yüzden, kimyasal türler arası etkileşimlerin sınıflandırılması demek, kimyasal türler arasında kurulan bağları sınıflandırmak demektir.
- Bu derste işimiz;
- bağların temel mantığını,
- isimlerini ve
- hangi sınıfa ait olduklarını öğrenmek olacaktır.
Bağların nasıl kurulduğu ile ilgili ayrıntılar ilerleyen derslerin konusudur.
Etkileşimleri Kimyasal Türlere Göre Sınıflandırma
- Kimyasal türler arası etkileşimlerin sınıflandırılması için kullanılan kriterlerden biri, etkileşimi kuran türlerdir.
- Etkileşimi kuran türlere göre, kimyasal türler arası etkileşimler ikiye ayrılır:
- Atomlar arası etkileşimler: Sadece atomlar ve iyonlar arasında kurulan bağlardır.
- Moleküller arası etkileşimler: Sadece moleküller arasında kurulan bağlardır.
- Etkileşimleri, “Atomlar Arası” ve “Moleküller Arası” olarak sınıflandırmanın bazı güçlükleri vardır. Mesela;
- Yemek tuzunda (NaCl), atomlar değil iyonlar arasında bir etkileşim kurulmuştur.
- Tuzlu suda; tuz iyonları ile su molekülleri arasında bir etkileşim kurulmuştur. Yani bir iyon ile bir molekül etkileşimi kurulmuştur.
- Suya Na metali attığımızda, H2 gazı oluşur. Bu olayda da Na atomları ile su molekülleri arasında bir etkileşim kurulmuştur.
- Soy gaz atomlarının katı veya sıvı halde iken kurdukları etkileşim atomlar arasıdır fakat, moleküller arası etkileşimler gibi zayıftır.
- Görüldüğü gibi, etkileşimler sadece atomlar arası ya da moleküller arasında kurulmamaktadır.
- Bu yüzden, etkileşimleri sağlamlığına göre sınıflandırmak daha doğru bir yoldur.
Örnek:
Merve, sıra arkadaşı Zeynep’e, etkileşimlerin sınıflandırılmasını anlatmaktadır. Zeynep bu esnada Merve’ye şu soruyu sormuştur:
“Öğretmen, kimyasal türler arası etkileşimleri;
– Atomlar Arası Etkileşimler
– Moleküller Arası Etkileşimler
olarak sınıflandırmanın, bazı sorunlarının olduğunu söyledi. Ama ben bu sınıflandırmanın sorunlarını pek anlamadım.”
Buna göre Merve, Zeynep’in kafa karışıklığını gidermek için aşağıdakilerden hangisini söylerse, amacına ulaşamaz?
A) Atomlar ile moleküller arasında kurulan etkileşimler de vardır.
B) İyonlar ile atomlar arasında kurulan etkileşimler de vardır.
C) İyonlar ile moleküller arasında kurulan etkileşimler de vardır.
D) Moleküller ile moleküller arasında kurulan etkileşimler de vardır.
E) İyonlar ile iyonlar arasında kurulan etkileşimler de vardır.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Etkileşimleri Sağlamlığına Göre Sınıflandırma
Sağlamlığına göre, kimyasal türler arası etkileşimler ikiye ayrılır:
- Güçlü etkileşimler:
- Bu sınıfa giren bağları koparmak daha zordur, daha çok enerji gerektirir.
- Güçlü etkileşimlere “kimyasal bağlar” da denir.
- Zayıf etkileşimler:
- Bu sınıfa giren bağlar daha zayıftır ve daha kolay koparlar.
- Zayıf etkileşimlere “fiziksel bağlar” da denir.
Aşağıdaki şema, güçlü ve zayıf etkileşimleri detaylı olarak göstermektedir:
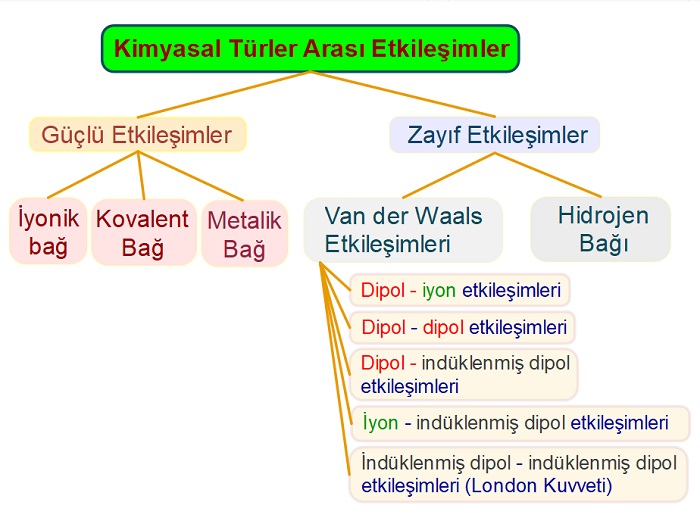
- Van der Waals Etkileşimleri‘ne;
- “Van der Waals Kuvvetleri” veya “Van der Waals Bağları” da denir.
- Bir etkileşimin güçlü mü zayıf mı olduğu bağ enerjisinden anlaşılır.
Örnek:
I) Burak: Dipol-dipol etkileşimlerini koparabilecek kadar güçlüdür.
II) Serkan: Dipol-iyon etkileşimlerini koparabilecek kadar güçlüdür.
III) Mert: İyon-indüklenmiş dipol etkileşimlerini koparacak kadar güçlüdür.
IV) Naim: Kovalent bağı koparacak kadar güçlüdür.
V) Barış: London kuvvetlerini koparacak kadar güçlüdür.
İsimleri verilen bu beş kişi arasında bir bilek güreşi turnuvası düzenlesek, kimin şampiyon olmasını daha çok bekleriz?
A) Burak
B) Serkan
C) Mert
D) Naim
E) Barış
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Bağ Enerjisi ve Etkileşimler
- Bağ enerjisi; bir bağı koparmak için gereken enerjidir.
- Bir etkileşimin bağ enerjisi ne kadar yüksekse, bağ o kadar sağlam demektir.
- Bağ enerjisinde 40 kj/mol değeri bir sınır olarak kabul edilir.
- Buna göre; bağ enerjisi değeri 40 kj/mol veya daha büyük olan bağlar güçlü etkileşim olarak sınıflandırılır.
- Bağ enerjisi 40 kj/mol değerinden daha küçük olan bağlar da zayıf etkileşim olarak sınıflandırılır.
Etkileşimler (Bağlar) Nasıl Kurulur?
- Bütün kimyasal türlerde proton ve elektronlar vardır.
- Protonlar pozitif (+), elektron ise negatif (-) yüklü taneciklerdir.
- Aynı yükler birbirini iter, zıt yükler çeker.
- Elektronlar birbirine yaklaşırsa aralarında bir itme kuvveti oluşur. Protonlar için de aynı şey geçerlidir.
- Fakat bir elektron ile bir proton birbirine yaklaşırsa, aralarında bir çekim kuvveti oluşur ve birbirlerini çekerler.
- İşte bu temel kural bir etkileşimin oluşmasında sağlayan şeydir.
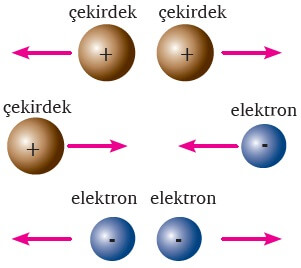
- Bir etkileşimin kurulması için, iki kimyasal türün birbirine yeterince yaklaşması gerekir.
- Birbirine yaklaşan iki kimyasal tür arasına hem itme kuvvetleri oluşur hem de çekme.
- Eğer birbirine yaklaşan iki kimyasal tür arasında oluşan itme kuvvetleri daha baskın gelirse, bu iki tür yollarına devam ederler ve aralarında herhangi bir bağ oluşmaz.
- Yaklaşan kimyasal türler arasında; çekme kuvvetleri daha baskın gelirse kimyasal türler birbirini çeken iki mıknatıs gibi yapışırlar ve aralarında bir bağ kurulmuş olur.
- İki kimyasal tür arasındaki çekim kuvveti ne kadar güçlü ise o kadar güçlü bir etkleşim oluşur ve oluşan bu güçlü etkileşim zor kopar.
Örnek:
I) A atomunun elektronları B atomunun protonlarını çeker.
II) B atomunun protonları A atomunun protonlarını iter.
III) A atomunun protonları B atomunun elektronlarını iter.
Deniz, birbirine doğru yaklaşan A ve B atomları arasında, yukarıdaki etkileşimlerin oluştuğunu iddia etmektedir. Öğretmeni ise bu iddialar arasında yanlış veya yanlışlar olduğunu fark etmiştir.
Buna göre, Deniz’in öğretmeninin fark ettiği yanlışlar, hangileridir?
A) Yalnız I
B) Yalnız II
C) Yalnız III
D) II ve III
E) I ve III
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Etkileşimlerin Genel Özellikleri
- Güçlü ve zayıf etkileşimler olmasaydı, bütün evren 118 elementin gazından oluşurdu. Evrende, ne katı bir madde, ne sıvı bir madde, ne de bir bileşik göremezdik. Çünkü; bütün katılar, sıvılar ve bileşikler varlığını etkileşimlere borçludur.
- Bütün güçlü ve zayıf bağlar, yeterince yaklaşmış iki atomun elektronları ile protonları arasındaki karşılıklı çekim kuvvetinden başka bir şey değildir (İki mıknatısın zıt kutuplarının birbirini çekmesi gibi).
- Atomlar arasında oluşan karşılıklı çekim kuvveti, güçlü olursa güçlü bir etkileşim kurulur, zayıf olursa da zayıf bir etkileşim kurulur.
- Bir metal ile bir ametal atomu arasında oluşan güçlü etkileşim adı iyonik bağdır.
- İki ametal atomu arasında oluşan güçlü etkileşimin adı kovalent bağdır.
- İki metal atomu arasında kurulan güçlü etkileşimin adı metalik bağdır.
- Bileşikler oluşurken, iyonik ya da kovalent bağlar kurulur. Metalik bağ güçlü bir bağ olmasına rağmen bileşik oluşumunda bir rolü yoktur.
- Kovalent bağ, molekülleri oluşturan güçlü bir etkileşimdir.
- İyonik bağ, kristalleri oluşturan bir güçlü bağdır.
- İyonik bileşiklerin kimyasal türleri iyonlardır.
- Moleküller birbirine bağlanmak isterlerse zayıf etkileşimleri tercih ederler. İki molekülü güçlü bir etkileşim ile bağlayamazsınız.
- Zayıf etkileşimler, moleküller arasına çizilen kesikli çizgiler ile gösterilir.
- Aşağıdaki resimde, su moleküllerini bir arada tutan hidrojen bağları gösterilmiştir.
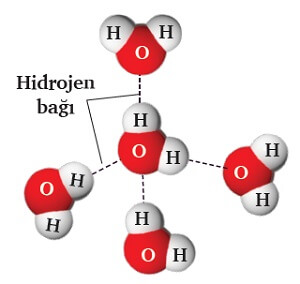
- Zayıf etkileşimler, maddelerin katı ya da sıvı halde olmasını sağlar.
- Maddelerin birbiri içinde çözünmesini sağlayan bağlar da zayıf etkileşimlerdir. Yani tuz ve su birbirinde çözünürken, tuz iyonları ile su melekülleri arasına bir zayıf bağ kurulur.
- Fiziksel olaylarda fiziksel bağlar oluşur veya kopar. Kimyasal olaylarda kimyasal bağlar oluşur ya da kopar.
- Metalik bağ güçlü bir bağdır fakat metalik bağın oluşması ya da kopması kimyasal bir olay değildir.
Örnek:
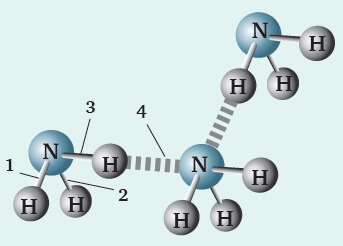
Onur, performans ödevi olarak, yukarıdaki şekli hazırlamıştır. Şekilde, üç tane NH3 (Amonyak) molekülünün top-çubuk modeli ve bağları göstermiştir.
Kimya dersinde, tahtaya kalkan Onur, bu şekli sınıf arkadaşlarına anlatmaktadır.
Buna göre, Onur, bu şekil ile ilgili olarak aşağıdakilerden hangisini söylerse arkadaşlarını yanıltmış olur?
A) 4 numaralı bağ bir zayıf etkileşimdir.
B) 1, 2 ve 3 numaralı bağlar kovalent bağlardır.
C) Şekil katı ya da sıvı NH3 maddesinin kimyasal türlerini gösteriyor.
D) 4 numaralı bağı koparsa, madde gaz haline geçer.
E) 4 numaralı bağı koparmak, 1 numaralı bağı koparmaktan daha zordur.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Esra, bir behere saf su koymuş, beheri de bir ocağın üzerine koyup altını yakmıştır. O esnada, telefonu çalan Esra, telefon görüşmesi için laboratuvardan dışarıya çıkmış ve uzun bir görüşme yapmıştır. Laboratuvara geri döndüğünde ise, suyun tamamen buharlaştığını fark etmiştir.
Buna göre, Esra’nın buharlaştırdığı bu su ile ilgili olarak aşağıdakilerden hangisi doğru değildir?
A) Sıvı halden gaz haline geçmiştir.
B) Su molekülleri arasındaki güçlü etkileşimler kırılmıştır.
C) Su molekülleri arasındaki zayıf etkileşimler kırılmıştır.
D) Esra’nın ocağı yakıp telefon görüşmesi yapması çok tehlikeli bir davranıştır.
E) Su bir hal değişimi tepkimesi vermiştir.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Konu Özeti
Kimyasal Türler Arası Etkileşimlerin Sınıflandırılması konusunda bilememiz gerekenler şunlardır:
- Kimyasal türler arası etkilelşimler demek, kimyasal türlerin aralarında kurdukları bağlar demektir.
- Kimyasal türler arası etkileşimler, bağı kuran kimyasal türlere göre ikiye ayrılır:
- Atomlar arası etkileşimler: Sadece atomlar ve iyonlar arasında kurulan bağlardır.
- Moleküller arası etkileşimler: Sadece moleküller arasında kurulan bağlardır.
- Kimyasal türler arası etkileşimler, bağın sağlamlığına göre de ikiye arılır:
- Güçlü etkileşimler: Bu sınıfa giren bağları koparmak daha zordur, daha çok enerji gerektirir. Güçlü etkileşimlere “kimyasal bağlar” da denir.
- Zayıf etkileşimler: Bu sınıfa giren bağlar daha zayıftır ve daha kolay koparlar. Zayıf etkileşimlere “fiziksel bağlar” da denir.
- Güçlü etkileşimler 3 tanedir:
- İyonik bağ
- Kovalent bağ
- Metalik bağ
- Zayıf etkileşimler 2 tanedir:
- Van der Waals Kuvvetleri
- Hidrojen Bağı
- Van der Waals Kuvvetleri 6 tanedir:
- Dipol – iyon etkileşimleri
- Dipol – dipol etkileşimler
- Dipol – indüklenmiş dipol etkileşimleri
- İyon – indüklenmiş dipol etkileşimleri
- İndüklenmiş dipol – indüklenmiş dipol etkilemişleri (Bu etkileşimlere London Kuvvetleri de denir.)
- Bütün etkileşimler, elektronlar ve protonlar arasındaki çekim kuvvetinden başka bir şey değildir.
- İki kimyasal tür birbirine yaklaştığınıda, aralarında itme kuvvetleri de oluşur çekme kuvvetleri de. Bağ kurulabilmesi için, kimyasal türler arasındaki çekim kuvvetlerinin daha güçlü olması gerekir.
- Kimyasal bağlar, güçlü etkileşimlerdir. Kimyasal olaylarda, güçlü etkileşimler oluşur ya da kopar.
- Zayıf etkileşimlerin hepsi fiziksel bağdır. Fiziksel olaylarda, zayıf etkileşiler oluşur ya da kopar.
- Zayıf etkileşimler maddelerin katı ve sıvı halde olabilmesini sağlar.
- Zayıf etkileşimler, maddelerin birbiri içinde çözünebilmesini sağlar.
- Güçlü etkileşimler, bileşiklerin oluşmasını sağlar. İyonik bağ ile iyonik bileşikler oluşur, kovalent bağ ile de kovalent bileşikler oluşur.
- İyonik bağ iyonik bileşiklerin kristallerini, kovalent bağ kovalent bileşiklerin moleküllerini oluşturur.
- Zayıf etkileşimler, molekküler arasına çizilen kesikli çizgilerle gösterilir.
