İçindekiler
Zayıf etkileşimler, bağ enerjisi 40 kj/mol değerinden daha az olan bağlardır.
- Zayıf etkileşimler olmasaydı şunları yaşardık:
- Bir çok madde katı ya da sıvı halde olamazdı.
- Zayıf etkileşimler, kimyasal türlerin bir birine tutunarak bir arada durabilmesini, böylece maddelerin, katı ve sıvı halde bulunabilmesini sağlar.
- Kimyasal türleri arasındaki zayıf etkileşimler koparsa, madde gaz fazına geçmiş olur.
- Maddeler birbirinde çözünemez ve çözeltiler oluşamazdı.
- Bütün çözeltilerde çözücü ve çözünen maddelerin kimyasal türleri birbirine zayıf etkileşimler ile tutunur.
- Bir çok madde katı ya da sıvı halde olamazdı.
Aşağıdaki vidyoda, su moleküllerinin katı, sıvı ve gaz halindeki davranışları verilmiştir. Vidyoda, su molekülleri arasında katı ve sıvı halde iken kurulan zayıf etkileşimler canlandırılmıştır:
- Zayıf etkileşimlere fiziksel bağlar da denir.
- Zayıf etkileşimlerin oluşması veya kopması fiziksel olaydır.
- Zayıf etkileşimler, kimyasal türler arasına çizilen kesikli çizgiler ile gösterilir.
- Şekilde de görüldüğü gibi, zayıf etkileşimler, kimyasal türler arasında ve kesikli çizgiler ile gösterilirler.
Örnek:
Kimyasal türleri arasında zayıf etkileşimler kuran maddeler, katı ya da sıvı halde bulunurlar; gaz halindeki maddelerin kimyasal türleri özgürdür.
Buna göre, aşağıdaki maddelerden hangisinin kimyasal türleri arasında zayıf etkileşimler yok sayılır?
A) H2O(k)
B) H2O(s)
C) CH3OH(s)
D) Na+(suda)
E) CO2(g)
Cevap
Örneğin çözümü:
Polar – Apolar Moleküller
- “Pol” kelimesi “kutup” demektir.
- “Polar” kelimesi de “kutuplu” demektir.
- “Apolar” kelimesi “kutupsuz” demektir.
- Kutup denince, + veya – kutuplar kastedilir.
- Zayıf etkileşim türü olan Van der Waals etkileşimlerini anlamak için moleküllerin polar ve apolar olanlarını fark edebilmek çok önemlidir.
- Polar ve apolar kavramları iki yerde karşımıza çıkmaktadır. Bunlar:
- Kovalent bağda polarlık ve apolarlık
- Moleküllerde polarlık ve apolarlık
- Polar-apolar molekülleri tanımak için, asıl yöntem, moleküldeki atomların elektronegatiflik değerlerini kullanmaktır. Yani şöyle:
- Moleküldeki kovalent bağlarda, toplam elektronegatiflik değeri sıfırsa molekül apolardır değilse polar moleküldür.
- Bu yöntemin uygulaması karmaşık olabilmektedir. Bu yüzden, apolar molekülleri tanımak için biz daha basit bir yöntem kullanacağız. Okumaya devam edelim…
- Moleküldeki kovalent bağlarda, toplam elektronegatiflik değeri sıfırsa molekül apolardır değilse polar moleküldür.
Apolar Moleküller
- Apolar moleküllerin pozitif (+) veya negatif (-) kutupları olmaz. Bu yüzden:
- Apolar moleküllerin arasında oluşan itme ve çekme kuvvetleri çok zayıftır.
- Apolar moleküllerin arasında kurulan etkileşimler çok zayıftır.
- Apolar katı ve sıvıların, erime ve kaynama noktaları çok düşüktür.
- Apolar moleküllerde, toplam elektronegatiflik kuvveti sıfırdır.
Apolar Moleküller Nasıl Tanınır?
- H2, Cl2, F2, Br2 ve I2 gibi 2 atomlu element moleküllerinin hepsi apolardır.
- BeH2, CH4, BH3 gibi, 2 farklı atomdan oluşan bileşik moleküllerinde:
- Atomlardan biri; 2A, 3A veya 4A grubundan ise, molekül apolardır.
- 2A: Mg, Be
- 3A: B
- 4A: C, Si
- Toplam 2 atomdan oluşan bileşik molekülleri her zaman polardır:
- BeO
- CO
- NO
- …
- Atomlardan biri; 2A, 3A veya 4A grubundan ise, molekül apolardır.
- Soy gaz atomlarının hepsi apolardır.
- He, Ne, Ar, Kr, Xe, Rn
Öğretici Örnek:
Aşağıda, bazı apolar türlerin, Lewis Elektron Nokta Yapıları verilmiştir:

- Dikkat ettiysek, apolar moleküllerin Lewis elektron nokta yapılarında, merkezdeki atomun bütün elektronları aynı atomlar ile paylaşılmıştır.
Örnek:
I) Moleküldeki toplam elektronegatiflik değeri sıfırdır.
II) F2 molekülü gibi, element molekülleri apolardır.
III) Apolar moleküllerin kalıcı kutupları vardır.
IV) H2O molekülü polardır.
Apolar moleküller için yukarıda verilen bilgilerden hangileri doğrudur? (8O)
A) I, II, III ve IV
B) I, II ve IV
C) I, II ve III
D) II ve IV
E) Yalnız IV
Cevap
Örneğin çözümü:
Polar Moleküller
- Polar moleküller, birer küçük mıknatıs gibi, zıt kutuplara sahip moleküllerdir. Bu yüzden;
- İki tane polar molekülü, yan yana getirirseniz, birinin artı kutbu diğerinin eksi kutbunu kendine doğru çeker.
- Apolar moleküllere göre kurdukları etkileşimler daha kuvvetlidir.
- Apolar moleküllere göre, polar maddelerin erime ve kaynama noktaları daha yüksektir.
- Polar moleküllerde, toplam elektronegatiflik kuvveti sıfırdan farklıdır.
Kısmi Pozitif (ẟ+) ve Kısmi Negatif (ẟ–) Kutuplar
- Polar bir moleküldeki kutuplar tam olarak artı ve eksi kutuplar değildir.
- Çünkü, moleküllerdeki atomlar, kovalent bağlı atomlardır ve kovalent bağda kesin bir elektron alış-verişi yoktur.
- Atomlar elektron almadan negatif, vermeden pozitif yük kazanmazlar. Bu yüzden, kutuplara karar vermek için, moleküllerde, bağ elektronlarının kime daha yakın olduğuna bakılır.
- Kovalent bağ, her zaman elektronegatifliği daha yüksek ametale daha yakındır.
- Bağ elektronları kime daha yakınsa molekülün o tarafı kısmi olarak negatif, diğer tarafı da kısmi olarak pozitif yüklü olur.
- Kısmi pozitif kutup şu şekilde gösteriler: ẟ+
- Kısmi negatif kutup şu şekilde gösteriler: ẟ–
- Kovalent bağ elektronları, elektronegatifliği daha yüksek olan atoma (F, O, N,…) daha yakındır.
Öğretici Örnek:
Aşağıda H2O (Su) molekülünün kısmi pozitif ve kısmi negatif kutupları gösterilmiştir:

- O (Oksijen) atomunun elektronegatifliği daha büyük olduğu için, molekülün kısmi negatif tarafı (δ–) O atomunun olduğu taraftır.
- H (Hidrojen) atomunun olduğu taraf da molekülün kısmi pozitif (δ+) tarafıdır.
Öğretici Örnek:
Aşağıda; HCl (Hidrojen klorür) molekülü, kısmi kutupları ile birlikte verilmiştir:
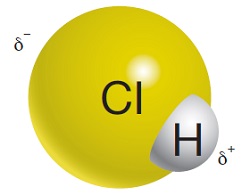
Cl (Klor) atomunun elektronegatifliği daha büyük olduğu için, molekülün kısmi negatif tarafı (δ–) Cl atomunun olduğu taraftır. H (Hidrojen) atomunun olduğu taraf da molekülün kısmi pozitif (δ+) tarafıdır.
Polar Moleküller Nasıl Tanınır?
- Apolar moleküllerin dışındaki bütün moleküller polardır.
- Polar moleküllerin başlıcaları şunlardır:
- CH3COOH, CH3OH gibi 3 veya daha fazla çeşit elementten oluşan moleküller polardır.
- HCl, HBr, CO gibi 2 atomlu bileşik molekülleri polardır.
- NH3, H2O, SO2 gibi, içinde 5A ve 6A elementlerinin olduğu bileşikler polardır.
Örnek:
I) CH4
II) NO2
III) CO
IV) C2H5OH
V) O3
VI) CO2
VII) H2
Yukarıda verilen molekülleri, polar ve apolar olarak sınıflandırınız. (1H, 6C, 7N, 8O)
Cevap
Örneğin çözümü:
Kalıcı Dipoller ve İndüklenmiş (Geçici) Dipoller
- “Dipol” kelimesi “iki kutuplu” anlamına gelir.
- Dipol moleküllerde, pozitif (+) ve negatif (-), iki kutup vardır.
Dipoller (Kalıcı Dipoller)
- Polar moleküller; kalıcı dipollerdir ve dipol etkileşimleri kurarlar.
- Polar moleküllerin, kalıcı olarak kısmi pozitif ve kısmi negatif kutupları vardır.
- Bu yüzden polar moleküllere dipoller (kalıcı dipoller) denir.
Küçük Birer Mıknatıs: Polar Moleküller

- Polar moleküller, zıt kutupları sebebiyle, birer küçük mıknatıs gibi davranırlar ve zıt kutupları ile birbirlerini çekerler.
- Bu çekim kuvvetleri, dipol etkileşimleri olarak adlandırılır.
- Yukarıdaki resimde, noktalı çizgiler, dipol etkileşimlerini göstermektedir.
İndüklenmiş Dipoller (Geçici Dipoller)
- Apolar moleküller, indüklenmiş dipollerdir ve indüklenmiş dipol etkileşimleri kurarlar.
- Apolar moleküller, aslında kutupsuzdur yani dipolleri yoktur. Fakat;
- Moleküldeki atomların elektronları; çekirdek etrafında dönerken, çarpışmaların etkisi ile veya çeşitli sebeplerle, anlık olarak, belli bir tarafta yığılırlar.
- Bu durum, güneşin etrafında dönen gezegenlerin, belli dönemlerde, güneşin belli bir tarafında, aynı hizaya gelmesine benzer. Fakat elektronlar, gezegenlere göre çok daha hızlı hareket ettikleri için, elektronlarda bu durum saniyede binlerce defa gerçekleşir.
- Elektronların anlık olarak, belli bir bölgede birikmesi sebebiyle, molekülün bu bölgesi o an için kısmi negatif bir kutup olur, diğer bölge de mecburen kısmi pozitif bir kutup olur.
- O an için molekül polar bir moleküle dönüşür ve hemen tekrar apolar haline geri döner.
- İşte bu şekilde, dış etkiler ile oluşan dipoller, geçici veya indüklenmiş dipoller olarak adlandırılır.
Van der Waals Kuvvetleri
- Van der Waals Kuvvetleri, zayıf etkileşimlerdir.
- Zayıf etkileşimlerin, kimyasal türleri bir arada tutarak, maddelerin katı ya da sıvı halde olmalarını sağladıklarını, daha önce söylemiştik.
- Van der Waals Kuvvetleri, kendi içinde beşe ayrılır:
- İyon – Dipol Etkileşimleri: Bir iyon ile bir polar molekül arasında kurulur.
- Dipol – Dipol Etkileşimleri: İki tane polar molekül arasında kurulur.
- Dipol – İndüklenmiş Dipol Etkileşimleri: Polar bir molekül ile apolar bir molekül arasında kurulur.
- İyon – İndüklenmiş Dipol Etkileşimleri: Bir iyon ile apolar bir molekül arasında kurulur.
- İndüklenmiş Dipol – İndüklenmiş Dipol Etkileşimleri: Bütün kimyasal türler arasında kurulur, fakat iki apolar tür arasında sadece bu zayıf etkileşim kurulur.
Gelin bu bağları teker teker öğrenelim.
I) İyon – Dipol Etkileşimleri
- Bir iyon ile bir dipol (polar molekül) aranda kurulan etkileşimlerdir.
- İyon-Dipol etkileşimleri, genellikle, iyonik bağlı bir bileşiğin sulu çözeltisinde kurulur. (İyonal çözeltiler)
- İyonal çözeltilerde, iyonlar ile su molekülü arasında iyon-dipol etkileşimi oluşur.
Tuzlu Suda İyon-Dipol Etkileşimleri Var
- NaCl tuzunu suya attığımızda, bileşikteki Na+ iyonları ile H2O molekülleri arasında, Cl– iyonları ile H2O molekülleri arasında, iyon-dipol etkileşimleri oluşur.
- Aşağıda resim, NaCl tuzunun suda iyon-dipol etkileşimleri kurarak çözünmesini gösteriyor:

Bir bileşik, suda iyonlarına ayrışarak çözünüyor ise, oluşan sulu çözeltiye iyonal çözelti denir. İyonal sulu çözeltilerde, iyonlar ile su molekülleri arasında, iyon-dipol etkileşimleri kurulmuştur.
Aşağıdaki animasyon, su molekülleri ile NaCl bileşiğinin iyonları arasında kurulan iyon-dipol etkileşimlerini göstermektedir:
II) Dipol – Dipol Etkileşimleri
- İki tane dipol (polar) molekül, birbirine bağlanmak isterse, dipol-dipol etkileşimi kurar.
- H2O, H2S, NH3, HCl, HCN, PH3 gibi dipol (polar karakterli) moleküllerin arasında dipol-dipol etkileşimi görülür.
Aşağıdaki moleküller, dipol (polar) moleküllerdir ve aralarındaki kesik çizgiler de dipol-dipol etkileşimleridir.

Dikkat ederseniz, dipol-dipol etkileşimleri, zıt kutuplar arasında kuruluyor.
- Bir dipolde, polarlık ne kadar artarsa, kuracağı etkileşimin kuvveti de o kadar artar.
- Zayıf Etkileşim kuvvetlendikçe de maddenin erime ve kaynama noktası artar.
III) Dipol – İndüklenmiş Dipol Etkileşimleri
- Dipol (polar) bir molekül ile apolar bir molekül arasında kurulan etkileşimdir.
- Dipol molekül, apolar moleküle yaklaştığında, apolar molekülü indüklenmiş dipol yapar. Bu şekilde, iki molekül arasında, bir dipol-indüklenmiş dipol etkileşimi kurulur.
- Bu etkileşim, polar maddelerin apolar maddelerde çözünmesiyle ya da apolar maddelerin polar maddelerde çözünmesiyle oluşur.
- Polar ile apolar maddeler birbirinde iyi çözünmezler. (Benzer benzerde çözünür.) Fakat, bu hiç çözünmezler anlamına gelmez.
- Çok az da olsa, polar moleküller apolar moleküllerde çözünür ve bu çözeltiler dipol-indüklenmiş dipol etkileşimleri kurulur:
- CH3OH (metil alkol) polar yani dipol bir moleküldür,
- I2 (iyot) ise apolar bir moleküldür.
- Metil alkol içinde iyot katısı çözersek, iyot molekülleri ile metil alkol molekülleri arasında indüklenmiş dipol-dipol etkileşimi kurulur.
Aşağıda, iki molekül arasında gördüğünüz kesikli çizgiler dipol – indüklenmiş dipol etkileşimleridir:
CH3OH …………. I2
IV) İyon – İndüklenmiş Dipol Etkileşimleri
- Bir iyon ile apolar bir molekül arasında kurulan etkileşimdir.
- CCl4 (Karbon tetraklorür) bileşiği apolar moleküllü bir bileşiktir,
- NaCl (Sodyum klorür) bileşiği iyonik bağlı bir bileşiktir.
- Karbon tetraklorür sıvısına, NaCl tuzu katarsak, tuz çok az bir oranda da olsa çözünür.
- Çözeltide; Na+ iyonları ile CCl4 molekülleri arasında ve Cl– iyonları ile CCl4 molekülleri arasında, iyon-indüklenmiş dipol etkileşimleri kurulur.
- İyon-indüklenmiş dipol etkileşimleri;
- dipol-dipol etkileşimlerinden daha zayıf
- dipol-indüklenmiş dipol etkileşimlerinden daha güçlüdür.
V) London Kuvvetleri (İndüklenmiş Dipol – İndüklenmiş Dipol Etkileşimleri)
- Katı veya sıvı haldeki bütün maddelerin kimyasal türleri arasında, London Kuvvetleri vardır.
- Bu yüzden London Kuvvetlerine “evrensel kuvvetler” denir.
- Apolar kimyasal türler arasında sadece London Kuvvetleri vardır.
- Apolar kimyasal türün, mol ağırlığı arttıkça, London Kuvveti de güçlenir.
- Soy gaz atomları (He, Ne, Ar, Kr, Xe, Rn) apolar türlerdir. Bu yüzden, soy gaz atomları arasında, katı ve sıvı halde iken, London kuvvetleri vardır.
- Soy gazların proton sayısı arttıkça, London kuvvetlerinin gücü de artar. Bu yüzden, proton sayısı büyük olan soy gazların erime ve kaynama noktaları daha büyüktür.
- 7A grubu ametallerinin molekülleri (F2, Cl2, Br2, I2) de apolardır.
- Bu moleküller de, katı ve sıvı halde iken London kuvvetleri ile birbirine tutunur.
- Bu moleküllerde de, proton sayısı arttıkça, erime ve kaynama noktaları yükselir.
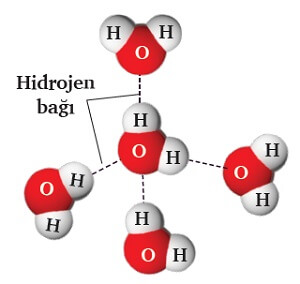
Hidrojen Bağı
- F, O veya N atomlarından birine bağlı olan H atomunun, karşı moleküldeki F, O ve N atomlarından biri ile kurduğu etkileşimdir.
Aşağıda, H2O molekülleri arasında kurulan hidrojen bağlarının farkı şekillerde gösterimi verilmiştir:

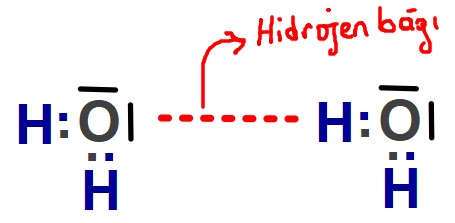
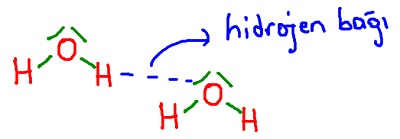
- Zayıf etkileşimlerin ikincisi hidrojen bağıdır.
- Hidrojen bağı, en kuvvetli zayıf etkileşimdir.
- Yani, hidrojen bağı içeren maddelerin erime ve kaynama noktaları, diğer zayıf etkileşimleri içerenlerden daha yüksektir.

- H2O moleküllerinden başka:
- NH3
- HF
- CH3OH
- C2H5OH
- CH3COOH
- HCOOH gibi moleküller de Hidrojen bağı kurabilir. Dikkat ederseniz, moleküllerde, hem H atomu var hem de F, O, N atomlarından biri var.


Baris says:
Allah razı olsun
Gökalp AY says:
Hepimizden.