İçindekiler
Sevgili öğrencim, asitler ve bazlar, kimyasal maddeler içinde, karşımıza en çok çıkacak bileşikler arasındadır.
- Bu derste;
- Asit ve bazları genel olarak tanımayı
- Çevremizdeki bir çok asit ve bazı
- İndikatörleri
- pH kavramını
- Asit ve bazların sulu çözeltilerini
- Asidik ve bazik oksitleri göreceğiz.
Asitleri ve Bazları Tanıyalım
Bir maddeyi tanımak için, o maddenin özelliklerini iyi bilmemiz gerekir. Bu durum asit ve bazlar için de geçerlidir. Gelin, asit ve baz bileşiklerinin özelliklerine bir bakalım.
Asitlerin Genel Özellikleri
- Asitlerin tadı ekşidir. (Asit kelimesinin anlamı da zaten “ekşi”dir.)
- Genellikle suda iyonlarına ayrışarak çözündükleri için sulu çözeltileri elektrik akımını iletir. Bu yüzden asit çözeltileri elektrolittir.
- Mavi turnusol kâğıdının rengini kırmızıya çevirir.
- Asitler bazlarla tepkimeye girerek tuz ve su oluşturur. Bu tepkimeye nötürleşme (nötralleşme) tepkimesi denir.
- Asitler, karbonatlı (CO32-) bileşiklere etki ederek CO2 (karbon dioksit) gazı açığa çıkarır.
CaCO3(k) + 2HCl(suda) → CaCl2(suda) + CO2(g) + H2O(s) - Asitler, bütün aktif metallerle (Mg, Fe, Zn gibi) tepkimeye girerek hidrojen gazı (H2(g)) çıkmasına neden olur.
2HCl(suda) + Zn(k) → ZnCl2(suda) + H2(g) - Asitler aşındırıcı ve tahriş edici özelliğe sahiptir. Ciltle temas ettiklerinde yakıcı etki gösterir.
Bazların Genel Özellikleri
- Bazların tadı acıdır.
- Bazlara, “alkali maddeler” de denir.
- Bazlar, ciltte kayganlık hissi oluşturur.
- Genellikle suda iyonlarına ayrışarak çözündükleri için sulu çözeltileri elektrik akımını iletir. Bu yüzden baz çözeltileri elektrolittir.
- Kırmızı turnusol kâğıdının rengini maviye çevirir.
- Bazlar asitler ile reaksiyona girerek nötralleşme tepkimesi verir.
- Kuvvetli bazlar, “amfoter metallerle” reaksiyona girerek hidrojen gazı çıkmasına neden olur. Amfoter metaller 6 tanedir:
- Çinko (Zn)
- Krom (Cr)
- Alüminyum (Al)
- Kurşun (Pb)
- Kalay (Sn)
- Berilyum (Be)
- Bazlar da tıpkı asitler gibi aşındırıcı ve tahriş edicidirler ve Ciltle temas ettiklerinde yakıcı etki gösterir.
Çevremizdeki Asitler
Meyve Asitleri
- Bütün meyvelerin asitleri vardır. Biz bu asitlere “meyve asitleri” diyoruz.
- Meyvelerdeki asit miktarı arttıkça, meyvenin da tadındaki ekşilik de artar.
Bazı meyve asitleri şunlardır:
- Elma asidi: Malik asit
- Çilek asidi: Folik asit
- Üzüm asidi: Tartarik asit
- Limon ve portakal asidi: Sitrik asit
- Zeytin asidi: Oleik asit
Bazı Doğal Asitler
Meyvelerin dışında da bir çok asit ile iç içe yaşıyoruz. Aşağıda bu asitlere örnekler verilmiştir:
- Isırgan otunda formik asit vardır. Isırgan otunun ısırması bu yüzden yakar.
- Karıncalarda da formik asit vardır.
- Sütte, laktik asit vardır. Süt bayatladıkça laktik asit oranı artar.
- Gazozda ve bütün gazlı içeceklerde karbonik asit vardır.
- Araba akülerinde sülfürik asit çözeltisi vardır.
Bazı Yaygın Asitler ve Formülleri
- HF: Hidroflorik asit (Hidrojen florür)
- HCl: Hidroklorik asit (Hidrojen klorür)
- HBr: Hidrobromik asit (Hidrojen bromür)
- HI: Hidroiyodik asit (Hidrojen iyodür)
- HNO3: Nitrik asit (Kezzap)
- H2SO4: Sülfürik asit (Zaç yağı)
- HClO4: Perklorat asidi
- H2CO3: Korbonik asit
- CH3COOH: Asetik asit (sirke)
- H3PO4: Fosforik asit
Çevremizdeki Bazlar
Temizlik Maddeleri Genellikle Bazdır
- Bazların tadı acıdır. Bu özelliği, bazları tanımamızda bize yardımcı olabilir. Mesela hardal, karabiber ve acı biberin yapısında baz olduğunu buradan anlayabiliriz.
- Ele kayganlık hissi vermeleri, bazların diğer belirgin özellikleridir. Bu özellik yardımı ile, bir çok temizlik maddesinin bazik maddeler olduğunu anlamak gayet kolaydır.
Bazı Doğal Bazlar
Aşağıda, çevremizde görebileceğimiz bazlardan bazı örnekler verilmiştir:
- Sabunlar
- Deterjanlar
- Şampuanlar
- Diş macunu
- Kireç
- Çamaşır sodası
- Kül (Odun veya kömür külü)
- Kabartma tozu (Karbonat)
- Sodalar
- Yağ çözücüler
- Lavabo açıcısı
- Mermer
Bazı Yaygın Bazlar ve Formülleri
- NaOH: Sodyum hidroksit (Sud kostik)
- KOH: Potasyum hidroksit (Potas kostik)
- Mg(OH)2: Magnezyum hidroksit
- Ba(OH)2: Baryum hidroksit
- NH3: Amonyak
- Ca(OH)2: Kalsiyum hidroksit
İndikatörler
Kimyasallar Tadına Bakılarak Tanınmaz

- Resimdeki mantar, Amanita Muscaria (emanita muskariya) adlı bir mantardır ve yapısında İbotenik Asit bulundurur.
- İbotenik Asit, zehirlidir ve bu mantarı yiyenlerin ölüm riski vardır.
İndikatörler
- Asitleri ve bazları tanımak için her zaman tadına bakmak mümkün değildir.
- Çünkü bir çok asit veya baz oldukça zararlıdır hatta zehirlidir.
- Tadına bakmadan asit ve bazları tanımanın bir yolu, indikatör kullanmaktır.
- Asit çözeltisinde başka, baz çözeltisinde başka renk veren organik maddelere indikatör denir.
Doğal İndikatörler
Aşağıda bazı doğal indikatörler ve verdikleri renkler verilmiştir:
| Doğal İndikatör | Asitte Verdiği Renk | Bazda Verdiği Renk |
|---|---|---|
| Kırmızılahana | Kırmızı – Pembe | Yeşil – Sarı |
| Gül yaprağı | Açık Pembe | Sarı |
| Kırmızı soğan kabuğu | Açık Kırmızı | Açık Kahverengi |
| Kuşburnu | Kırmızı | Koyu Yeşil |
| Çilek | Açık Turuncu | Sarı – Yeşil |
| Çay | Sarı | Kahverengi |
| Kiraz | Açık Pembe | Açık Sarı |
| Lavanta | Renksiz | Kahverengi |
Kırmızı (Mor) Lahana Suyu Deneyi
- Mor (kırmızı da denir) lahana suyunun üzerine;
- asit dökerseniz kırmızı-pembe renkli bir sıvıya döner
- baz dökerseniz yeşil-sarı renkli bir sıvıya döner.
Ortanca Çiçeği

Asidik Toprakta Yetişen Ortanca Çiçeği 
Bazik – Nötür Toprakta Yetişen Ortanca Çiçeği
- Asidik toprakta yetişirse mavi renkli olur
- Bazik ya da nötür toprakta yetişirse pembe renkli olur.
Turnusol Kağıdı Deneyi
- Turnusol kağıdı;
- asit çözeltilerinde kırmızı
- baz çözeltilerinde mavi renk alır.
- Turnusol kağıdını asitler kızartır, bazlar morartır.
Gül Suyunun İndikatör Olarak Kullanılması Deneyi
- Gül yaprağından elde edilen su da bir indikatördür.
- Asidik ortamda Açık Pembe
- Bazik ortamda sarımsı bir renk alır.
Yaygın Kullanılan İdikatörler
- Aşağıdaki tablo, laboratuvarlarda görebileceğiniz bazı indikatörleri vermektedir.
- Tablo, indikatörlerin, maddenin pH değerine göre verdikleri renkleri göstermektedir.
- Bu tablodaki indikatörleri ezberlemek zorunda değilsiniz.
| Doğal İndikatör | pH Sınırının Altında | pH Sınırı | pH Sınırının Üstünde |
|---|---|---|---|
| Metil menekşesi (metilviyole) | Sarı | 0,0 – 0,16 | Mavi – Menekşe |
| Malahit yeşili | Sarı | 0,2 – 0,18 | Mavi – Menekşe |
| Metil sarısı (etanolde) | Kırmızı | 2,9 – 4,0 | Sarı |
| Bromfenol mavisi | Sarı | 3,0 – 4,6 | Menekşe |
| Kango kırmızısı | Mavi | 3,0 – 5,2 | Kırmızı |
| Metil turuncusu | Turuncu | 3,1 – 4,4 | Sarı |
| Bromkrezol yeşili | Sarı | 3,8 – 5,4 | Mavi |
| Metil kırmızısı | Kırmızı | 4,2 – 6,3 | Sarı |
| Litmus (azolitmin) | Kırmızı | 4,5 – 8,3 | Mavi |
| Bromkrezol moru | Sarı | 5,2 – 6,6 | Menekşe |
| Bromkrezol mavisi | Sarı | 6,0 – 7,6 | Mavi |
| Fenol kırmızısı | Sarı | 6,6 – 8,0 | Kırmızı |
| Fenolftalein | Renksiz | 8,2 – 10,0 | Mavi – Menekşe |
| Timolftalein | Renksiz | 9,4 – 10,6 | Mavi |
| Alizarin sarısı R | Sarı | 10,1 – 12,0 | Portakal – Kırmızı |
| İndigo karmin | Mavi | 11,4 – 13,0 | Sarı |
Asit-Baz Çözeltilerinde H+ ve OH– İyonları
H+ iyonu ile H3O+ (hidronyum) iyon aynıdır.
OH– iyonunun adı hidrosit veya hidroksildir.
- Şeker gibi, asitler ve bazların da çoğu suda iyi çözünür.
- Bir asit suda çözündüğünde “asit çözeltisi” oluşur.
- Bir baz suda çözündüğünde “baz çözeltisi” oluşur.
- Asitler sulu çözeltilerine H+1 veya H3O+ iyonu verirler.
- Bazlar sulu çözeltilerine OH-1 iyonu verirler.
- Bir sulu çözeltinin, asidik mi bazik mi olduğu, çözeltide bulunan H+1 (H3O+1 de denir) ve OH-1 sayıları arasındaki ilişkiye bağlıdır.
- Bir sulu çözeltide; H+1 sayısı daha fazla ise, o sulu çözelti asidiktir.
- Bir sulu çözeltide; OH-1 sayısı daha fazla ise çözelti baziktir.
- Eğer bir sulu çözeltideki H+1 ve OH-1 sayısı birbirine eşitse çözelti nötürdür.
- Asidik sulu çözelti: H+ sayısı > OH– sayısı
- Bazik sulu çözelti: OH– sayısı > H+ sayısı
- Nötür sulu çözelti: H+ sayısı = OH– sayısı
- Nötür çözeltiler; asidik özellik de göstermez bazik özellik de göstermez.
Örnek:
Öğretmeni, kimya dersinde Burak’a asitlerin tanımını sormuştur. Fakat Burak, o anda heyecanlanıp cevabı hatırlayamamıştır ve sıra arkadaşından yardım istemiştir.
Buna göre, Burak’ın sıra arkadaşı aşağıdakilerden hangisini söylerse doğru bir asit tanımı yapmış olur?
A) Suya OH– iyonu veren bileşikler asittir.
B) Suya H+ iyonu veren bileşikler asittir.
C) Suya selam veren bileşikler asittir.
D) Sudan H+ alan bileşikler asittir.
E) Suda çözünen bileşikler asittir.
Cevap
Örneğin çözümü:
Sulu Çözeltilerde pH Kavramı
- pH, “hidrojenin gücü (power of the hydrogen ion)” demektir.
- pH kavramı, çözeltilerdeki H+1 iyonlarının oranını anlamak için kullanılan bir kavramdır.
- pH değeri bilinen bir çözeltinin asit mi baz mı olduğunu anlayabiliriz.
- pH değerinin nasıl hesaplandığı Kimya 11 konusudur. Bu yüzden burada bu hesaba girilmeyecektir.
pH Değerlerinin Anlamı
- pH, 0 ile 14 arasında değerler alır.
- Bir çözeltinin pH değerine biliyorsak, çözeltinin asidik ve bazik karakterini de biliriz.
- Asidik çözeltilerde pH değeri 7’den daha küçüktür.
- Bazik çözeltilerde pH değeri 7’den daha büyüktür.
- Nötür çözeltilerde ise pH tam 7 dir.
pH < 7 ise Asit çözeltisidir.
pH > 7 ise Baz çözeltisidir.
pH = 7 ise Nötr bir çözeltidir.
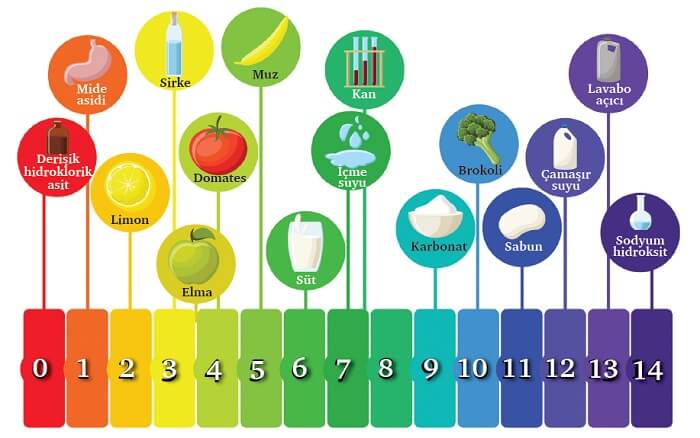
Aşağıdaki şekilde, dikey bir pH ekseni ve bazı maddelerin pH değerleri gösterilmiştir:

Meraklısı için, aşağıdaki resimde, çevremizdeki bazı maddelerin pH değerleri verilmiştir.
Kuvvetli ve Zayıf Asitler
- Kuvvetli asitlerin pH değeri sıfıra yakındır.
- Kuvvetli asitler şunlardır:
- HCl (Hidroklorik asit)
- HBr (Hidrobormik asit)
- HI (Hidroiyodik asit)
- HNO3 (Nitrik asit, kezzap)
- H2SO4 (Sülfürik asit, zac yağı, akü asidi)
- HClO4 (Perklorat asidi)
- Kuvvetli asitlerin kimyasal türleri, suya atıldıklarında %100 iyonların ayrışırlar.
- Kuvvetli asitler şunlardır:
- pH değeri 7’ye daha yakın olan asitler zayıftır.
- Zayıf asitlerden bazıları şunlardır:
- HF (Hidroflorik asit)
- HCN (Hidrojen siyanür)
- H2S (Hidrojen sülfür)
- HCOOH (Formik asit, karınca asidi)
- CH3COOH (Asetik asit, sirke asidi)
- H2CO3 (Karbonik asit)
- H3PO4 (Fosforik asit)
- Zayıf asitlerin kimyasal türleri, suya atıldıklarında, çok düşük bir oranda iyonların ayrışırlar.
- Bu yüzden, zayıf asitler suya çok az H+ iyonu verirler.
- Zayıf asitlerden bazıları şunlardır:
Kuvvetli ve Zayıf Bazlar
- Kuvvetli bazların pH değeri de 14’e yakındır.
- Kuvvetli bazlar genellikle 1A ve 2A metallerinin bazlarıdır ve şunlardır:
- NaOH (Sodyum hidroksit)
- LiOH (Lityum hidroksit)
- KOH (Postasyum hidroksit)
- Sr(OH)2 (Stronsiyum hidroksit)
- Ca(OH)2 (Kalsiyum hidroksit)
- Ba(OH)2 (Baryum hidroksit)
- Kuvvetli bazların kimyasal türleri, suya atıldıklarında %100 iyonların ayrışırlar.
- Kuvvetli bazlar genellikle 1A ve 2A metallerinin bazlarıdır ve şunlardır:
- pH değeri 7’ye daha yakın olan bazlar daha zayıftır.
- Zayıf bazlardan bazıları şunlardır:
- Mg(OH)2 (Magnezyum hidroksit)
- Fe(OH)3 (Demir-III-hidroksit)
- AgOH (Gümüş hidroksit)
- NH3 (Amonyak)
- Zayıf bazların, sudaki çözünürlükleri düşüktür veya suda çözündüklerinde çok düşük bir oranda iyonlarına ayrışırlar.
- Zayıf bazlardan bazıları şunlardır:
pH Kağıdı

- pH kağıdı, üzerinde genelde 4 çeşit renk olan uzun ince bir kağıttır.
- Bu kağıtlar bir kutu içinde ve çok sayıda olur.
- pH kağıdı kutusunun bir yüzünde 0’dan 7’e kadar sayılar ve bu sayıların altında renk desenleri vardır.
- Diğer yüzünde de 7’den 14’e kadar sayılar ve bu sayıların altında farklı renk desenleri vardır.
pH Kağıdı ile pH Ölçümü Nasıl Yapılır?
- pH kağıdı ile bir çözeltinin pH değeri tespit edilebilir. Bunun yapılması gerekenler sırasıyla şöyledir:
- Bunun için pH kağıdı çözeltiye batırılır kısa bir süre beklenir ve kağıt çözeltiden çıkarılır.
- Sonra pH kağıdı üzerinde oluşan renk desenine bakılır.
- pH kağıdın üzerindeki renk deseni, kutusunun üzerindeki desenlerden hangisine daha yakında pH değeri yaklaşık o kadardır.
Mesela; yukarıda verilen resimde, kişinin tuttuğu pH kağıdın desenine baktığımızda, 4 sayısının altındaki desene daha çok benzediğini görürürüz. Demek ki bu pH kağıdı hangi çözeltiye batırıldı ise, o çözeltinin pH değeri yaklaşık olarak 4’tür.
pH Metre
- Çözeltilerin pH değerini ölçmek için, pH metreden de yararlanabiliriz.
- pH metre, ekranı olan elektronik cihazdır.
- pH metre, çözeltiye batırıldığında, ekranında, çözeltinin pH değeri yazar.
- Piyasada, bir çok farklı tipte pH metreler vardır.
Aşağıdaki vidyo, harici ekranlı ve hassas bir pH metrenin kullanımını göstermektedir:
Bu da dahili ekranlı başka bir pH metre:

Asit ve Bazların Suda Çözünme Tepkimeleri
- 1887 yılında İsveçli kimyacı Arrhenius (Arhenus) asit ve bazlar için şu tanımı yapmıştır:
- Suya H+1 iyonu (H3O+1 iyonu da denir) verebilen maddeler asittir.
- Suya OH-1 (hidroksit veya hidroksil) iyonu verebilen maddeler de bazdır.
- Bu tanıma göre, asit ve bazların suda çözünme tepkimelerine ve bu tepkimelerin ürünlerine bakarak, maddelerin, suya hangi iyonları verdiğini görebiliriz.
Asitlerin Suda Çözünmesi Tepkimeleri
- Bir maddesinin çözünme tepkimesinin ürünlerinde:
- H+ veya
- H3O+ iyonu varsa madde asittir.
- Aşağıda; HCl asidinin suda çözünme tepkimesi verilmiştir:
- HCl(s) + H2O(s) → H3O+(suda) + Cl–(suda)
- Yukarıda verilen tepkimede, HCl sıvısı suda çözünmüş ve suya H3O+ iyonu ve Cl– iyonu vermiştir. Tepkimenin ürünlerine baktığımızda, bunu rahatça görebiliriz.
- Suya verilen Cl– iyonu şu anda bir anlam ifade etmiyor fakat; H3O+ iyonu bize bir mesaj veriyor: HCl bileşiği, suya H3O+ iyonu verdiği için bir asittir.
HCl bileşiği suda çözünürken, HCl ve H2O moleküllerindeki atomların düzeni nasıl değişiyor? Bunu görmek için yukarıda verdiğimi çözünme tepkimesini bir de moleküllerin top-çubuk modelleri ile görelim:

- Yukarıdaki gösterime baktığımızda, tepkimede bir tane atom, arkadaşını terk edip öteki moleküle gidiyor:
- HCl molekülündeki H+ iyonu, Cl– iyonundan kopup, H2O molekülüne geçiyor.
- Aslında bütün tepkime bu basit olaydan ibaret. Sonuçta;
- H2O molekülüne bir H+ daha geldiği için, H3O+ iyonuna dönüşüyor;
- HCl molekülündeki Cl– de, arkadaşı gittiği için yalnız kalıyor.
Aşağıda, başka asitlerin suda çözünme tepkimeleri verilmiştir.
- Asit olduklarını anlamak için; verdikleri H3O+ iyonuna dikkat etmemiz yeterlidir.
- H2SO4(s) + 2H2O(s) → 2H3O+(suda) + SO42-(suda)
- H3PO4(s) + 3H2O(s) → 3H3O+(suda) + PO43-(suda)
- CH3COOH(s) + H2O(s) → H3O+(suda) + CH3COO–(suda)
Çözünme Tepkimelerinde Su Bazen Görünmez
- Çözünme tepkimelerinde, genelde, suyu yazmaya üşeniriz. Bu durumda, asit, suya H3O+ değil H+ iyonu verir.
- Çözünme tepkimelerinde, suyun görünmesi ya da görünmemesi arasında, tepkimenin yazımı dışında bir fark yoktur.
- H2SO4(s), H3PO4(s) ve CH3COOH(s) asitlerinin suda çözünme tepkimeleri şöyle de verilebilir:
- H2SO4(s) → 2H+(suda) + SO42-(suda)
- H3PO4(s) → 3H+(suda) + PO43-(suda)
- CH3COOH(s) → H+(suda) + CH3COO–(suda)
- Çözünme tepkimelerinde, su, tepkime okunun üzerinde de gösterilebilir. Bu gösterim şeklinde de asitler, suya H+1 iyonu vereceklerdir.
Bazların Suda Çözünmesi Tepkimeleri
- Bir maddesinin çözünme tepkimesinin ürünlerinde:
- OH– iyonu varsa madde bazdır.
- NaOH bazının suda çözünme tepkimesi şöyledir:
- NaOH(k) → Na+(suda) + OH–(suda)
- NaOH bileşiğinin çözünme tepkimesine baktığımızda, bu bileşiğin bir baz olduğunu anlıyoruz. Çünkü suya OH– iyonu veriyor.
- NaOH(k) → Na+(suda) + OH–(suda)
Aşağıda, başka bazı bazların suda çözünme tepkimeleri verilmiştir.
- Ürünlerdeki OH– iyonuna dikkat edersek baz olduklarını anlayabiliriz:
- KOH(k) → K+(suda) + OH–(suda)
- Ca(OH)2(k) → Ca+2(suda) + 2OH–(suda)
- Mg(OH)2(k) → Mg+2(suda) + 2OH–(suda)
NH3 (Amonyak) Bazının Suda Çözünmesi
- Bazların formülünde OH– iyonunu görürüz, suya da formüllerindeki bu OH– iyonunu verirler.
- Fakat; NH3 (Amonyak) bileşiği, formülünde OH– içermeyen bir bileşiktir ve suya OH– iyonu verebiliyor, yani bir bazdır.
- Amonyak bu özelliği ile biraz manyak diyebiliriz.
- Amonyağın suda çözünme tepkimesi şöyledir:
- NH3(g) + H2O(s) → NH4+(suda) + OH–(suda)
Yukarıdaki tepkimede neler olup bittiğine daha yakından bakmak için, tepkimenin top-çubuk modeli ile gösterimini görelim:

- Yukarda, atom modelleri ile verilen tepkimede suyun hidrojenlerinden biri yer değiştiriyor. Bütün tepkime bundan ibaret.
- Su (H2O) bileşiği, bir hidrojenini kaybedince OH– iyonuna dönüşüyor;
- NH3 bileşiği de, suyun H+ iyonunu alınca NH4+ iyonuna dönüşüyor. Yani, Amonyak, uyanıklık edip, OH– vermiyor, suda zaten var olan OH– (hidroksit) iyonunu ortaya çıkarıyor.
Alkollere Dikkat!
- Alkoller sadece C (karbon), H (Hidrojen) ve O (Oksijen) elementlerinden oluşan organik bileşiklerdir. Sayıları çok fazladır. En bilinen bir kaç tanesi şunlardır:
- CH3OH (Metil alkol)
- C2H5OH (Etil alkol)
- C3H7OH (Propil alkol)
- Formüllerine dikkat edersek, hepsinde OH– vardır ama bu onları baz yapmaya yetmiyor. Demek ki; her OH’lı bileşik de baz değildir. Yani; alkollerin sizi sarhoş edip, baz gibi davranmalarına izin vermeyin.
- Biraz önce sıraladığımız alkollerin suda çözünme tepkimelerine bir bakalım:
- CH3OH(s) + H2O(s) → CH3OH(suda)
- C2H5OH(s) + H2O(s) → C2H5OH(suda)
- C3H7OH(s) + H2O(s) → C3H7OH(suda)
Ortalıkta hiç OH– iyonu yok. Kimse suya OH– iyonu vermemiş. Dolayısıyla bu tepkimelerde baz bileşiği yok.
Örnek:
I) CH3OH(s) + H2O(s) → CH3OH(suda)
II) NH3(g) + H2O(s) → NH4+(suda) + OH–(suda)
III) C6H12O6(k) + H2O(s) → C6H12O6(suda)
IV) Ca(OH)2(k) → Ca+2(suda) + 2OH–(suda)
V) CH3COOH(s) → H+(suda) + CH3COO–(suda)
Yukarıda, çözünme tepkimeleri verilen maddelerden asit ve baz olanlar hangileridir?
Cevap
Örneğin çözümü:
Örnek:
Laboratuvarda bir baz bileşiği arayan Ayten, dolaplardaki şişelerin etiketlerine bakmaktadır.
Buna göre, etiketinden aşağıdakilerden hangisi yazan kapta bir baz bileşiği vardır?
A) HCl
B) CH3OH
C) CH3COOH
D) NaOH
E) HNO3
Cevap
Örneğin çözümü:
Oksitler
- Herhangi bir elementin oksijen ile yaptığı bileşiğe oksit bileşiği denir.
- Oksit bileşiklerinde yalnız iki çeşit element olur; bu iki elementten biri her zaman oksijendir.
Aşağıda bazı oksit bileşikleri verimiştir:
- CaO (Kalsiyum oksit)
- Na2O (Sodyum oksit)
- CO2 (Karbon dioksit)
- SO2 (Kükürt dioksit)
- N2O5 (Diazot pentaoksit)
Örnek:
I) Fe2O3
II) HNO3
III) H2O
Yukarıda verilenlerden hangileri bir oksit bileşiğidir?
A) Yalnız I
B) Yalnız II
C) Yalnız III
D) I ve III
E) I, II ve III
Cevap
Örneğin çözümü:
- Oksit bileşikleri de kendi aralarında sınıflara ayrılır:
- Asidik Oksitler
- Bazik Oksitler
- Nötür Oksitler
- Amfoter Oksitler
Bazik Oksitler
- Metallerin oksitleri bazik oksitlerdir.
- Bazik oksitlere “susuz bazlar” da denir.
- Suyla tepkimeye girerek bazları oluştururlar.
- Bazik oksitler, bazlar gibi, suya OH– iyonu verirler.
- Ca ve Na elementleri metal oldukları için; CaO ve Na2O oksitleri baziktir ve suya hidroksil iyonu verirler. Suda çözünme tepkimeleri şöyledir:
CaO(k) + H2O(s) → Ca2+(suda) + 2OH–(suda)
Na2O(k) + H2O(s) → 2Na+(suda) + 2OH–(suda)
- Bazik oksitler, bazlar gibi davranırlar.
- Bazik oksitler, asitlerle tepkimeye girerek tuz ve su oluştururlar.
Asidik Oksitler
- Ametallerin, oksijeni daha fazla olan oksitleri asidiktir. Yani asidik oksitlerin molekül formüllerinde, oksijen sayısı ametal sayısından fazla olmalıdır.
- “Susuz asitler” olarak da bilinirler.
- Suyla tepkimeye girerek, asitleri oluştururlar.
- Asitler gibi suya H+ iyonu verirler.
Aşağıda, asidik oksitlere örnekler verilmiştir:
- CO2 (Karbon dioksit)
- SO2 (Kükürt dioksit)
- N2O5 (Diazot pentaoksit)
(Oksijen sayısı, ametalin sayısından fazla olduğu için, bu oksitlerin hepsi asidik özellik gösterir.)
Suda çözünme tepkimeleri şöyledir:
CO2(g) + H2O(s) → 2H+(suda) + CO32-(suda)
SO2(g) + H2O(s) → 2H+(suda) + SO32-(suda)
N2O5(g) + H2O(s) → 2H+(suda) + 2NO3–(suda)
- Asidik oksitler, asitler gibi davranırlar.
- Asidik oksitler, bazlarla tepkimeye girerek tuz ve su oluştururlar.
Nötür Oksitler
- Nötür oksitler de tıpkı asidik oksitler gibi ametallerin oksitleridir.
- Fakat; nötür oksitlerde, oksijen sayısı ametal sayısından fazla değildir. Oksijen sayısı ya ametal sayısına eşit ya da daha azdır.
Aşağıda nötür oksitlere örnekler verilmiştir:
- CO (Karbon monoksit)
- NO (Azot monoksit)
- N2O (Diazot monoksit)
- Nötür oksitler, asit ya da baz özelliği göstermezler.
- Asit ya da bazlarla ya da suyla tepkimeye girmezler.
Amfoter Oksitler
- Bir madde amfoter ise, o madde hem asidik hem de bazik özellik gösteriyor demektir.
- Amfoter oksitler de, hem asidik hem bazik özellik gösteren oksitlerdir.
- Su bir amfoter oksittir.
- Amfoter metallerin oksitleri, amfoter oksittir.
- Amfoter metaller şunlardır:
- Al (Alüminyum)
- Cr (Krom)
- Pb (Kurşun)
- Sn (Kalay)
- Zn (Çinko)
- Be (Berilyum)
- Amfoter oksitleri şöyle ezberleyebilirsiniz: Ali Cerenin Pabucunu Seninki Zannetti Betül
- Amfoter oksitler şunlardır:
- Al2O3 (Alüminyum oksit)
- Cr2O3 (Krom -III- oksit)
- PbO2 (Kurşun -IV- oksit)
- SnO2 (Kalay -IV- oksit)
- ZnO (Çinko oksit)
- BeO (Berilyum oksit)
- Amfoter oksitler; asitlerle ve bazlarla tepkimeye girerler.
- Amfoter oksitler; suyla tepkimeye girmezler.
Konu Özeti
Bu ünitenin, Asitler ve Bazlar bölümünde, bilmemiz gerekenler kısaca şunlardır:
- Asitler ve bazlar iki önemli bileşik sınıfıdır.
- Asitlerin genel özellikleri şunlardır:
- Asitlerin tadı ekşidir. (Asit kelimesinin anlamı da zaten “ekşi”dir.)
- Genellikle suda iyonlarına ayrışarak çözündükleri için sulu çözeltileri elektrik akımını iletir.
- Mavi turnusol kâğıdının rengini kırmızıya çevirir.
- Asitler bazlarla tepkimeye girerek tuz oluşturur.
- Asitler aşındırıcı özelliğe sahiptir. Ciltle temas ettiklerinde yakıcı etki gösterir.
- Asitler, karbonatlı bileşiklere etki ederek CO2 gazı açığa çıkarır.
CaCO3(k) + 2HCl(suda) → CaCl2(suda) + CO2(g) + H2O(s) - Asitler, bütün aktif metallerle (Mg, Fe, Zn gibi) tepkimeye girerek hidrojen gazı çıkmasına neden olur.
2HCl(suda) + Zn(k) → ZnCl2(suda) + H2(g) - Asitler aşındırıcı ve tahriş edici özelliğe sahiptir.
- Bazların genel özellikleri şunlardır:
- Bazların tadı acıdır.
- Bazlara, “alkali maddeler” de denir.
- Bazlar, ciltte kayganlık hissi oluşturur.
- Genellikle suda iyonlarına ayrışarak çözündükleri için sulu çözeltileri elektrik akımını iletir.
- Kırmızı turnusol kâğıdının rengini maviye çevirir.
- Bazlar asitler ile reaksiyona girerek nötralleşme tepkimesi verir.
- Bazlar, “amfoter metallerle” reaksiyona girerek hidrojen gazı çıkmasına neden olur. Amfoter metaller beş tanedir:
- Çinko (Zn)
- Krom (Cr)
- Alüminyum (Al)
- Kurşun (Pb)
- Kalay (Sn)
- Berilyum (Be))
- Bazlar da tıpkı asitler gibi aşındırıcı ve tahriş edicidiler.
Asit – Baz Örnekleri
- Bazı asit örnekleri:
- Elma asidi: Malik asit
- Çilek asidi: Folik asit
- Üzüm asidi: Tartarik asit
- Limon ve portakal asidi: Sitrik asit
- Zeytin asidi: Oleik asit
- Isırgan otunda formik asit vardır. Isırgan otunun ısırması bu yüzden yakar.
- Karıncalarda da formik asit vardır.
- Sütte laktik asit vardır. Süt bayatladıkça laktik asit oranı artar.
- Gazozda ve bütün gazlı içeceklerde karbonik asit vardır.
- Araba akülerinde sülfürik asit çözeltisi vardır.
- HCl: Hidroklorik asit (Hidrojen klorür)
- HBr: Hidrojen bromür
- HF: Hidrojen florür
- HNO3: Nitrik asit (Kezzap)
- H2SO4: Sülfürik asit (Zaç yağı)
- H2CO3: Korbonik asit
- CH3COOH: Asetik asit (sirke)
- H3PO4: Fosforik asit
- Bazı baz örnekleri:
- Sabunlar
- Deterjanlar
- Şampuanlar
- Diş macunu
- Kireç
- Çamaşır sodası
- Kül (Odun veya kömür külü)
- Kabartma tozu (Karbonat)
- Şampuan
- Sodalar
- Yağ çözücüler
- Lavabo açıcısı
- Mermer
- NaOH: Sodyum hidroksit (Sud kostik)
- KOH: Potasyum hidroksit (Potas kostik)
- NH3: Amonyak
- Ca(OH)2: Kalsiyum hidroksit
İndikatörler
- İndikatörler, asit ve bazları tanımak için kullanılan organik maddelerdir.
- Kırmızı lahana suyu, gül suyu, çay gibi maddeler doğal indikatörlerdir.
pH
- Bütün sulu çözeltilerde H+1 ve OH-1 iyonları vardır. H+1 sayısı daha çok olan çözeltiler asit, OH-1 sayısı daha çok olan çözeltiler baz, ikisi birbirine eşit olan çözeltiler nötürdür.
- pH, çözeltideki H+1 sayısından hesaplanır.
- Asit ve baz çözeltilerinin pH değerleri 0 ile 14 arasındadır.
- pH değeri 7 olan çözeltiler nötür, 7’den düşük olan çözeltiler asit, 7’den büyük olan çözeltiler ise baz çözeltileridir.
- pH kağıdı, renk deseni yardımı ile bir çözeltinin pH değerini ölçmeye yarayan bir kağıttır.
Asite ve Bazların Suda Çözünme Tepkimeleri
- Asitlerin suda çözünme tepkimelerine baktığımızda suya H+ veya H3O+ iyonu verdiklerini görürüz.
HCl(s) + H2O(s) → H3O+(suda) + Cl–(suda) - Bazların suda çözünme tepkimelerine baktığımızda da suya OH– iyonu verdiklerini görürüz.
NaOH(k) → Na+(suda) + OH–(suda) - Amonyak (NH3) istisnai bir bazdır. Suda çözünme tepkimesi şöyledir:
NH3(g) + H2O(s) → NH4+(suda) + OH–(suda) - Alkoller, formüllerinde OH– bulundursalar da baz bileşikleri değillerdir. Çünkü suya OH– veremezler:
C2H5OH(s) + H2O(s) → C2H5OH(suda)
Asidik ve Bazik Oksitler
- Oksit bileşikleri bir elementin sadece oksijen ile oluşturduğu bileşiklerdir.
- Metallerin oksitleri bazik oksitlerdir: CaO, Na2O…
- Ametallerin oksijeni daha fazla olan oksitleri asidik oksitlerdir: CO2, SO2, N2O5…
- Ametallerin, oksijeni daha fazla olmayan okstileri nötür oksitlerdir: N2O, CO, NO…
- Bazik oksitler, su ile tepkimeye girerek bazları oluştururlar ve suya OH– iyonu verirler.
- Asidik oksitler, su ile tepkimeye girerek asitleri oluştururlar ve suya H+ iyonu verirler.
- Nötür oksitler asit ya da bazlarla tepkimeye girmezler ve asidik ya da bazik karakterleri yoktur.







5 yorum “1. Asitler ve Bazlar”