İçindekiler
Mol Kavramı, atomların ve moleküllerin sayısını hesaplamak için geliştirilmiş bir kavramdır.
- Günümüzde, atomları bize gösterebilen bir cihaz yoktur. Çünkü atomlar, çok küçük maddelerdir.
- Çok çok küçük maddeler olduğu için, atomları sayarken, çok büyük sayılarla uğraşmak zorunda kalırız.
Mesela; ortalama bir bardak suyun içinde, yaklaşık olarak
180000000000000000000000000
tane atom vardır.
- İşte mol kavramı tam da burada işimize yarıyor ve bizi büyük sayılar ile uğraşmaktan kurtarıyor.
Avogadro Sayısı (NA)
- Avogadro sayısı, 6,02×1023 sayısıdır.
- Avogadro Sayısı Amedeo Avogadro adında bir kimyacı tarafından hesaplanmış bir sayıdır.
- Avogadro Sayısı, tıpkı pi (π) sayısı gibi, sabit bir sayıdır.
- Avogadro sayısı, bazı sorularda, işlem kolaylığı açısından 6×1023 olarak da alınabilir.
- Avogadro sayısı için, şu sembollerden herhangi biri kullanılır:
- N
- N0
- NA (favorimiz bu)
- NA = 6,02×1023
- Avogadro sayısı kadar tane olan her şey 1 moldür. Detaylar için okumaya devam edelim…
Bu bir reklamdır:
Avogadro Sayısı Çok Büyük Bir Sayıdır
- Avogadro sayısı çok büyük bir sayıdır. Nasıl mı?
- Dünyadaki bütün insanlar, yemeden içmeden, doğumdan itibaren ölene kadar saysalar, sonra, herkesin saydığı sayılar toplansa 6,02×1023 yapmaz.
- Dünya tarihi boyunca ekilen bütün buğday tanelerinin toplam sayısı henüz 6,02×1023 tane olmadı.
- Ama sadece 1 gram Hidrojen gazında (H2(g)), 6,02×1023 tane Hidrojen atomu var. Atomlar ne kadar küçük ve kalabalık değil mi?
Mol Sayısının Sembolü ve Birimi
- Mol sayısı, “n” harfi ile gösterilen bir kavramdır.
- Mol sayısının birimi de “mol” kelimesidir.
- Mol kavramı, sorularda veya cümle içinde şöyle karşımıza çıkar:
- n = 2 mol (2 mol madde demektir.)
- narmut = 0,2 mol (0,2 mol armut demektir.)
- nFe = 0,5 mol (0,5 mol Demir atomu demektir.)
- nH2O = 0,2 mol (0,2 mol H2O molekülü demektir.)
- nNa+ = 0,8 mol (0,8 mol Na+ iyonu demektir.)
- Maddelerin mol sayısı, verilen bilgiye göre üç farklı şekilde hesaplanabilir. Bunlar şunlardır:
- Sayısından Mol Sayısını Hesaplama
- Maddenin kimyasal türlerinin sayısı verildiyse bu yöntem kullanılır.
- Kütlesinden Mol Sayısını Hesaplama
- Maddenin kütlesi ve mol ağırlığı verildiyse bu yöntem kullanılır.
- Hacminden Mol Sayısını Hesaplama
- Madde gaz ise ve hacmi verildiyse bu yöntem kullanılır.
- Sayısından Mol Sayısını Hesaplama
1- Sayısından Mol Sayısını Hesaplama
- Bir kimyasal türün kaç tane olduğunu biliyorsak, kaç mol olduğunu da hesaplayabiliriz.
- Bir kimyasal türün kaç mol olduğunu biliyorsak, kaç tane olduğunu da hesaplayabiliriz.
- Yapmamız gereken tek şey, aşağıdaki ifadelerin birini kullanarak orantı kurmaktır.
1 mol demek 6,02×1023 tane demektir.
veya
1 mol demek NA tane demektir.
(NA = 6,02×1023)
- Orantı kurmak “Pek bana göre değil!” diyenler, aynı kapıya çıkan şu formülü kullanılabilir:
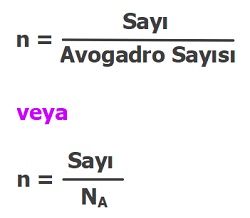
- Formülde basit bir işler dışlar çarpımı yaparsak formül şu hale gelir:
- Sayı = n . 6,02×1023 veya
- Sayı = NA
Bu bir reklamdır:
Öğretici Örnek:
- Her şeyin 1 molü:
- 6,02×1023 tanedir.
- NA tanedir.
- Her şeyin 1 molü 6,02×1023 tane ise, 2 molü:
- 12,04×1023 tanedir.
- Her şeyin 1 molü NA tane ise, 2 molü:
- 2NA tanedir.
Bu hesap böyle devam eder…
Aşağıdaki ifadelerin hepsi doğrudur. Lütfen bu basit ifadelere göz atmadan geçmeyin:
- 1 mol akıllı bileklik:
- 6,02×1023 tanedir.
- NA tanedir.
- 1 mol öğrenci:
- 6,02×1023 tanedir.
- NA tanedir.
- 1 mol Fe atomu:
- 6,02×1023 tanedir.
- NA tanedir.
- 1 mol H2O molekülü:
- 6,02×1023 tanedir.
- NA tanedir.
- 1 mol Na+ iyonu:
- 6,02×1023 tanedir.
- NA tanedir.
- 1 mol O2 molekülü:
- 6,02×1023 tanedir.
- NA tanedir.
- 2 mol akıllı bileklik:
- 12,04×1023 tanedir.
- 2NA tanedir.
- 2 mol öğrenci:
- 12,04×1023 tanedir.
- 2NA tanedir.
- 2 mol Fe atomu:
- 12,04×1023 tanedir.
- 2NA tanedir.
- 2 mol H2O molekülü:
- 12,04×1023 tanedir.
- 2NA tanedir.
- 2 mol Na+ iyonu:
- 12,04×1023 tanedir.
- 2NA tanedir.
- 2 mol O2 molekülü:
- 12,04×1023 tanedir.
- 2NA tanedir.
- 0,5 mol akıllı bileklik:
- 3,01×1023 tanedir.
- 0,5NA tanedir.
- 0,5 mol öğrenci:
- 3,01×1023 tanedir.
- 0,5NA tanedir.
- 0,5 mol Fe atomu:
- 3,01×1023 tanedir.
- 0,5NA tanedir.
- 0,5 mol H2O molekülü:
- 3,01×1023 tanedir.
- 0,5NA tanedir.
- 0,5 mol Na+ iyonu:
- 3,01×1023 tanedir.
- 0,5NA tanedir.
- 0,5 mol O2 molekülü:
- 3,01×1023 tanedir.
- 0,5NA tanedir.
Tabi bu hesapların tam tersi de doğrudur:
- 6,02×1023 tane öğrenci 1 moldür.
- 6,02×1023 tane Fe atomu 1 moldür.
- 6,02×1023 tane H2O molekülü 1 moldür.
- …
- 3,01×1023 tane öğrenci 0,5 moldür.
- 3,01×1023 tane Fe atomu 0,5 moldür.
- 3,01×1023 tane H2O molekülü 0,5 moldür.
- ….
Bu bir reklamdır:
Örnek:
18,06×1023 tane Fe atomu kaç moldür?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Bir balonun içinde 0,1 mol H2(g) molekülü vardır.
Buna göre, bu balonda kaç tane H2(g) molekülü vardır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
3NA tane Hidrojen (H) atomu kaç mol gelir?
Cevap
Örneğin çözümü:
Molekül Sayısı – Atom Sayısı
- Moleküller, en az 2 atomdan oluşan atom topluluklarıdır.
- Moleküllerin sayısı ile atomların sayısı aynı şey değildir; tıpkı tavşanların sayısı ile kulaklarının sayısının aynı olmaması gibi.
- Kulak sayısı = Tavşan sayısı x 1 Tane tavşandaki kulak sayısı
Bir Benzetme:
Öğretici Örnek:
- Bir molekülün formülünde, hangi atomdan kaç tane olduğu zaten yazar.
- Atom sayısı = Molekülün sayısı x atomun moleküldeki sayısı
- 1 tane H2O molekülünde:
- 2 tane H atomu vardır.
- 1 tane O atomu vardır.
- Toplam 3 tane atom vardır.
- 2 tane H2O molekülünde:
- 4 tane H atomu vardır.
- 2 tane O atomu vardır.
- Toplam 6 tane atom vardır.
- 1 mol H2O molekülünde:
- 2 mol H atomu vardır.
- 1 mol O atomu vardır.
- Toplam 3 mol atom vardır.
- 2 mol H2O molekülünde:
- 4 mol H atomu vardır.
- 2 mol O atomu vardır.
- Toplam 6 mol atom vardır.
- 1 tane H2SO4 molekülünde:
- 2 tane H atomu vardır.
- 1 tane S atomu vardır.
- 4 tane O atomu vardır.
- Toplam 7 tane atom vardır.
- 3 tane H2SO4 molekülünde:
- 6 tane H atomu vardır.
- 3 tane S atomu vardır.
- 12 tane O atomu vardır.
- Toplam 21 tane atom vardır.
- 1 mol H2SO4 molekülünde:
- 2 mol H atomu vardır.
- 1 mol S atomu vardır.
- 4 mol O atomu vardır.
- Toplam 7 mol atom vardır.
- 3 mol H2SO4 molekülünde:
- 6 mol H atomu vardır.
- 3 mol S atomu vardır.
- 12 mol O atomu vardır.
- Toplam 21 mol atom vardır.
Bu bir reklamdır:
Öğretici Örnek:
- Atomlarının sayısını biliyorsak, molekülün sayısını biliriz:
- Molekülün sayısı = Atomun sayısı / Atomun moleküldeki sayısı
- 2 tane H atomu içeriyorsa H2O molekülü:
- 1 tanedir.
- 2 tane O atomu içeriyorsa H2O molekülü:
- 2 tanedir.
- 10 tane H atomu içeriyorsa H2O molekülü:
- 5 tanedir.
- 10 tane O atomu içeriyorsa H2O molekülü:
- 10 tanedir.
- 16 tane H atomu içeriyorsa CH4 molekülü:
- 4 tanedir.
- 16 tane C atomu içeriyorsa CH4 molekülü:
- 16 tanedir.
- 2 mol H atomu içeriyorsa H2O molekülü:
- 1 moldür.
- 2 mol O atomu içeriyorsa H2O molekülü:
- 2 moldür.
- 10 mol H atomu içeriyorsa H2O molekülü:
- 5 moldür.
- 10 mol O atomu içeriyorsa H2O molekülü:
- 10 moldür.
- 16 mol H atomu içeriyorsa CH4 molekülü:
- 4 moldür.
- 16 mol C atomu içeriyorsa CH4 molekülü:
- 16 moldür.
Bu bir reklamdır:
Öğretici Örnek:
- Atomlarının toplam sayısını biliyorsak, molekülün sayısını biliriz:
- Molekülün sayısı = Atomların toplam sayısı / 1 tane moleküldeki toplam atom sayısı
- 3 tane atom içeriyorsa H2O molekülü:
- 1 tanedir.
- 6 tane atom içeriyorsa H2O molekülü:
- 2 tanedir.
- 12 tane atom içeriyorsa H2O molekülü:
- 4 tanedir.
- 5 tane atom içeriyorsa CH4 molekülü:
- 1 tanedir.
- 5 tane atom içeriyorsa CH4 molekülü:
- 1 tanedir.
- 3 mol atom içeriyorsa H2O molekülü:
- 1 moldür.
- 6 mol atom içeriyorsa H2O molekülü:
- 2 moldür.
- 12 mol atom içeriyorsa H2O molekülü:
- 4 moldür.
- 15 mol atom içeriyorsa CH4 molekülü:
- 3 moldür.
- 5 mol atom içeriyorsa CH4 molekülü:
- 1 moldür.
Bu bir reklamdır:
Örnek:
Toplamda 0,6 mol Hidrojen (H) atomuna sahip H2O (su) molekülleri kaç moldür?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
5 mol H2O (su) molekülünde toplam kaç mol atom vardır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
3 mol CO2 bileşiğinde kaç tane Oksijen (O) atomu vardır? (NA = 6.1023)
Cevap
Örneğin çözümü:
2- Kütlesinden Mol Sayısını Hesaplama
- Bir maddenin kütlesinden mol sayısını hesaplamak için o maddenin mol ağırlığını bilmek gerekir.
Bağıl Atom Kütlesi (Mol Ağırlığı – MA)
- Atomlar, göremeyeceğimiz kadar küçük maddelerdir.
- Dolayısıyla, hiç bir zaman elma, armut sayar gibi, parmaklarımızla atom saymamız mümkün değildir.
- Ama bir maddeyi saymak için, o maddeyi görmemiz de şart değildir. Nasıl mı?
MESELA:
Bir tane kalemin kaç gram geldiğini bilirsek, kalemleri saymak için onları görmemiz gerekmez.
Mesela; bir kalemin kütlesi 5 gram geliyorsa ise, bu kalemlerden oluşan 500 gramlık bir örnekte, hiç göremesek de 100 tane kalem olduğunu anlarız.
Bu örnekteki 5 gram nasıl bir kalemin kütlesi demekse bağıl atom kütlesi de bir atomun kütlesi demektir.
Kalem örneğine benzer şekilde, Atomları saymak için, bir tane atomun kütlesini bilmemiz yeterli oluyor.
- Tek bir atomun hesaplanan kütlesine “Bağıl Atom Kütlesi” denir.
- Bağıl Atom Kütlesi, sorularda şu isimlerin herhangi biri ile de karşımıza çıkabilir;
- Mol Ağırlığı (MA)
- Molekül Ağırlığı (MA)
- Mol Kütlesi (MA)
- Atom Kütlesi
- Atom Ağırlığı
- Bağıl Atom Kütlesi, sorularda şu isimlerin herhangi biri ile de karşımıza çıkabilir;
- Bağıl atom kütleleri her madde için sabittir ve genellikle farklıdır.
- Maddelerin bağıl atom kütleleri soruların sonunda parantez içinde verilir.
- Mesela: (H: 1g/mol, O:16 g/mol, H2O:18 g/mol) gibi
- Kabaca, bağıl atom kütlesi bir kimyasal türün kütle numarasına eşittir diyebiliriz.
- Biz bağıl atom kütlesi genellikle “Mol ağırlığı” veya “Molekül ağırlığı” şeklinde kullanılır ve MA ile gösterilir.
Mol Ağırlığı Yardımı ile Kütle Hesaplama
- Bir atomun Mol Ağırlığını (MA) biliyorsak, şunları biliyoruz demektir:
- O atomun 1 tanesi MA akb gelir.
- O atomun 1 molü MA gram gelir.
- Mesela Fe atomunun mol ağırlığı 56 g/mol’dür. Bu yüzden:
- 1 tane Fe atomu 56 akb gelir.
- 1 mol Fe atomu ise 56 gram gelir.
- Mesela Fe atomunun mol ağırlığı 56 g/mol’dür. Bu yüzden:
- Bu dediklerimizi soruları çözerken şu şekilde ortan
1 mol kimyasal tür MA kadar gramdır.
veya
1 tane kimyasal tür MA kadar akb gelir.
- Orantı kurmak “Pek bana göre değil!” diyenler, aynı kapıya çıkan şu formülü kullanılabilir:
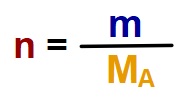
- Formüldeki sembollerin anlamları şöyledir:
- n: Maddenin mol sayısı
- m: Maddenin gram olarak kütlesi
- MA: Maddenin mol ağırlığı
- Formülde içler-dışlar çarpımı yaparsak, aşağıdaki formülleri türetebiliriz:
- m = n . MA
- MA = m/n
- Atomların mol ağırlıkları (MA), genellikle sorunun sonunda ve parantez içinde verilir.
- Mol ağırlığının birimi “g/mol” dür.
Öğretici Örnek:
He (helyum) ve C (karbon) atomu için aşağıdakilerden hepsi doğrudur. (He: 4 g/mol, C: 12 g/mol)
- 1 tane He atomu:
- 4 akb gelir.
- 1 tane C atomu:
- 12 akb gelir.
- 2 tane He atomu:
- 8 akb gelir.
- 2 tane C atomu:
- 24 akb gelir.
- 10 tane He atomu:
- 40 akb gelir.
- 10 tane C atomu:
- 120 akb gelir.
- 1 mol He atomu:
- 4 gram gelir.
- 1 mol C atomu:
- 12 gram gelir.
- 2 mol He atomu:
- 8 gram gelir.
- 2 mol C atomu:
- 24 gram gelir.
- 10 mol He atomu:
- 40 gram gelir.
- 10 mol C atomu:
- 120 gram gelir.
Bu bir reklamdır:
Öğretici Örnek:
He (helyum) ve C (karbon) atomu için aşağıdakilerden hepsi doğrudur. (He: 4 g/mol, C: 12 g/mol)
- 4 akb He elementi:
- 1 tanedir.
- 8 akb He elementi:
- 2 tanedir.
- 40 akb He elementi:
- 10 tanedir.
- 12 akb C elementi:
- 1 tanedir.
- 24 akb C elementi:
- 2 tanedir.
- 4 gram He elementi:
- 1 moldür.
- 8 gram He elementi:
- 2 moldür.
- 40 gram He elementi:
- 10 moldür.
- 12 gram C elementi:
- 1 moldür.
- 24 gram C elementi:
- 2 moldür.
Bağıl Atom Kütleleri Nasıl Hesaplanmıştır?
- Bir atomun bağıl atom kütlesi hesaplanırken, 12C izotopunun kütlesi kullanılır.
- Bir atomun, 12C atomuna bağlı olarak hesaplanan kütlesine Bağıl Atom Kütlesi denir.
- Yani; terazinin bir kefesinde her zaman 12C atomları, diğer kefesinde de kütlesini bulmak istediğimiz atom olur. Bu şekilde, bütün atomların 12C atomuna bağlı olarak kütleleri hesaplanır.
- Bu mantıkla, periyodik sistemdeki bütün atomların bağıl atom kütleleri hesaplanmıştır.
- 12C atomunun kütlesi, tam olarak, 12,00 akb kabul edilmiştir.
- 1 akb; 12C atomunun kütlesinin 12’de biridir.
akb: Atomik kütle birimi
1 akb = 6,02×1023 gram
- Bağıl atom kütlelerini hesaplamak için, 12C atomundan önce, kıyaslama atomu olarak;
- 1H ve 16O izotopları kullanılmıştır.
- Fakat; günümüzde bu atomlardan vaz geçilmiş, 12C izotopunda karar kılınmıştır.
Bileşiklerin Mol Ağırlığı (MA)
- Bir bileşiğin mol ağırlığı, bileşiğin formülüne bakılarak hesaplanır.
- Bileşiğin “mol ağırlığını” hesaplamak için, formülündeki bütün atomların “mol ağırlıklarını” toplamak yeterlidir.
- Atomların, mol kütleleri, sorunun sonunda parantez içinde verilir.
Öğretici Örnek:
Aşağıda bazı atomların mol ağırlıkları (MA) verilmiş, mol ağırlıkları ile ilgili yorumlar yapılmıştır. Mol ağırlığı kavramını daha iyi anlamak için inceleyiniz:
– C:12 g/mol
1 tane C atomunun kütlesi 12 akb gelir.
1 mol C atomunun kütlesi 12 gram gelir.
2 tane C atomunun kütlesi 24 akb gelir.
2 mol C atomunun kütlesi 24 gram gelir.
– O:16 g/mol
1 tane O atomu 16 akb gelir.
1 mol O atomu 16 gram gelir.
– H:1 g/mol
1 tane H atomu 1 akb gelir.
1 mol H atomu 1 gram gelir.
– H2O:18 g/mol
1 tane H2O molekülü 18 akb gelir.
1 mol H2O molekülü 18 gram gelir.
– NaOH: 40 g/mol
1 tane NaOH 40 akb gelir.
1 mol NaOH 40 gram gelir.
Örnek:
H2O bileşiğinin mol ağırlığını hesaplayınız. (H:1, O:16)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Öğretici Örnek:
- Tıpkı elementler gibi, bileşiklerin de;
- 1 molü MA kadar gram gelir.
- 1 tanesi MA kadar akb gelir.
H2O bileşiği için aşağıdakilerden hepsi doğrudur. (H2O: 18g/mol)
- 1 tane H2O molekülü:
- 18 akb gelir.
- 2 tane H2O molekülü:
- 36 akb gelir.
- 1 mol H2O bileşiği:
- 18 gramdır.
- 2 mol H2O bileşiği:
- 36 gramdır.
- Kütlesinden yola çıkarak, bileşiklerin mol sayısı da bulunur:
- 18 akb gelen H2O molekülü:
- 1 tanedir.
- 36 akb gelen H2O molekülü:
- 2 tanedir.
- 360 akb gelen H2O molekülü:
- 20 tanedir.
- 18 gram gelen H2O bileşiği:
- 1 moldür.
- 9 gram gelen H2O bileşiği:
- 0,5 moldür.
- 36 gram gelen H2O bileşiği:
- 2 moldür.
Bu bir reklamdır:
Örnek:
C2H5OH bileşiğinin mol kütlesi 46 ise, bu bileşikteki Karbon atomunun bağıl atom kütlesi kaçtır? (H:1, O:16)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
112 gram Fe (Demir) elementi kaç mol gelir? (Fe: 56 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
22 gram CO2 (Karbon dioksit) gazı kaç mol gelir? (C: 12 g/mol, O: 16 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
5 mol H2O bileşiği kaç gram gelir? (H2O: 18 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
3 mol H2SO4 bileşiği kaç gramdır? (H:1 g/mol, S:32 g/mol, O:16 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
3 mol H2SO4 bileşiğinde kaç gram H elementi vardır? (H:1 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
12,8 gram Oksijen elementi içeren H2SO4 bileşiği kaç mol gelir? (O:16 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
12 tane H2O molekülü kaç akb gelir? (H: 1 g/mol, O: 16 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
112 gram Fe (Demir) elementi kaç akb gelir?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
0,5 mol CO2 (Karbon dioksit) gazı kaç akb gelir? (C: 12 g/mol, O: 16 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
I) 10 tane O2 molekülü
II) 10 tane atom içeren O2 molekülü
III) 10 mol O2 molekülü
IV) 10 akb O2 molekülü
Yukarıda verilen maddeleri, kütlelerine göre sıralayınız. (O: 16 g/mol)
Cevap
Örneğin çözümü:
3- Hacminden Mol Sayısını Hesaplama
- Maddelerin hacmini (V) kullanarak da mol sayısı hesaplanabilir. Fakat bunun için madde:
- Gaz halinde olmalıdır.
- Normal koşullarda olmalıdır.
- Normal koşullara; “Normal Şartlar” da denir.
- NK: Normal koşullarda demektir.
- NŞA: Normal şartlar altında demektir.
- Normal koşullardaki gazların sıcaklığı 0oC ve basıncı 1 atm’dir.
- Bu şartları sağlayan her gazın mol sayısını hesaplamak için şu cümle ile basit orantılar kurabiliriz:
NŞA 1 mol gaz 22,4 Litre hacim kaplar.
- Gazların hacmi ile mol sayısı arasında hesap yapmak için, orantı kurmayı sevmeyenler, aşağıdaki formülü kullanabilir:

- Formülde:
- V: Hacim (Litre olarak)
- n: Mol sayısı demektir.
- Litre birimi ile ilgili olarak şu eşitlikler unutulmamalıdır:
- 1 L = 1000 mL
- 1 L = 1 dm3
- 1 mL = 1 cm3
- Formülde basit bir içler-dışlar yaparsak, normal koşullardaki bir gazın hacmi için; formülü şöyle de kullanabiliriz:
- V = n . 22,4
- Formülden anlıyoruz ki, bir gazın normal koşullardaki hacmini bulmak için mol sayısını bilmek yeterlidir.
Gazları tanımak basit:
Maddelerin gaz olduğunu anlamak için, formüllerinin altında “(g)” sembolü görmemiz yeterlidir. Aşağıda verilen bütün maddeler gaz halindedir:
- O2(g)
- H2(g)
- CO2(g)
- NH3(g)
- H2O(g)
- He(g)
- F2(g)
- CH4(g)
- Cl2(g)
- Ne(g)
Bu bir reklamdır:
Örnek:
NŞA 11,2 Litre hacim kaplayan CH4 gazı kaç mol gelir?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
6,4 gram O2(g) normal koşullarda kaç Litre gelir?(O: 16 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Toplam 0,5.NA tane atom içere CH4 (metan) gazı normal koşullarda kaç Litre hacim kaplar?
Cevap
Örneğin çözümü:
Oda Koşullarındaki Gazlar
- Oda koşullarındaki bir gazın, basıncı 1 atm, sıcaklığı 25 oC değerindedir.
- Oda koşullarında 1 mol gaz 24,5 Litre gelir.
- Oda koşullarındaki bir gazın mol sayısı için, aşağıdaki formül kullanılabilir:
- n = V / 24,5
Mol Sayısının Diğer İfadeleri
- Aşağıdaki ifadelerin hepsi mol sayısı yerine kullanılabilir:
- Formül-gram: İyonik bileşiklerin mol sayısı demektir.
- İyon-gram: İyonların mol sayısı demektir.
- Molekül-gram: Kovalent bileşiklerin mol sayısı demektir.
- Atom-gram: Atomların mol sayısı demektir.
Öğretici Örnek:
Aşağıda, “mol sayısı” anlamına gelen bazı kavramlar verilmiştir. Dikkatle inceleyiniz:
- 2 molekül-gram H2O demek
- 2 mol H2O demektir.
- 3 iyon-gram Na+ demek
- 3 mol Na+ iyonu demektir.
- 4 atom-gram Fe demek
- 4 mol Fe atomu veya elementi demektir.
- 5 formül-gram NaCl demek
- 5 mol NaCl demektir.
Bu bir reklamdır:
Örnek:
I) CH4
II) C2H4
III) C3H8
Yukarıdaki bileşiklerin her birinden bir miktar örnek alınıyor. Daha sonra, örneklerin üçünün de, eşit sayıda Hidrojen (H) atomu içerdiği anlaşılıyor.
Buna göre, bu üç bileşikten alınan örneklerin, kütleleri arasındaki ilişki, hangi seçenekte doğru olarak verilmiştir?
A) I=II=III
B) I>II>III
C) II>III>I
D) III>II=I
E) II>I>III
Cevap
Örneğin çözümü:
İzotop Atomlarda Ortalama Atom Kütlesi
- İzotop atomlar, aynı elementin farklı nötron sayısına sahip atomlarıdır.
- Yani, proton sayıları aynı, nötron sayıları farklı olan atomlara izotop atomlar denir.
- İzotop atomların, nötron sayıları farklı olduğu için, kütle numaraları (proton sayısı ile nötron sayısı toplamı) da farklıdır.
- Mesela; tabiattaki Ne (Neon) atomlarının hepsinin proton sayısı 10’dur, fakat; bu atomların:
- % 90,5 ‘inin nötron sayısı 10, kütle numarası 20’dir.
- % 0,3 ‘ünün nötron sayısı 11, kütle numarası 21’dir.
- %9,2 ‘sinin nötron sayısı 12, kütle numarası 22’dir.
- Yani, Ne izotoplarının tabiattaki bolluk durumunu şu şekilde özetleyebiliriz:

- Peki bu durumda, Ne atomunun atom kütlesi kaçtır? Periyodik sisteme kaç yazılacaktır? Bu sorunun cevabı, her izotopun yüzdesi ile doğru orantılı olarak bir ortalama hesaplanarak bulunur.
- Aşağıda, izotop atomların ortalama atom kütlelerini (OAK), yüzdeleriyle doğru orantılı olarak hesaplayan formül verilmiştir:
OAK = (1. izotopun kütlesi x 1. izotopun yüzdesi) + (2. izotopun kütlesi x 2. izotopun yüzdesi) + (3. izotopun kütlesi x 3. izotopun yüzdesi) + …
Örnek:
Bakır (Cu) elementinin iki izotopundan, 63Cu doğada %80 oranında, 65Cu doğada %20 oranında bulunmaktadır.
Cu atomunun ortalama atom kütlesini (OAK) bulunuz.
Cevap
Örneğin çözümü:
Bu bir reklamdır:


11 yorum “2. Mol Kavramı”