Kimyanın Temel Kanunları ve Kimyasal Hesaplamalar → 2. Bölüm
İçindekiler [göster]
- 2. Bölüm: Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
- Mol Kavramı
DERS
TYT Kimya
Kimya 10
KONU
ÜNİTE I
KİMYANIN TEMEL KANUNLARI VE KİMYASAL HESAPLAMALAR
II. Bölüm
2. Bölüm: Mol Kavramı
Dersin Özellikleri:
- Seviye: Hiç Bilmeyenler İçin
- Süre: 40 dakika
- Gerekli Bilgiler:
- Kimyanın Sembolik Dili
- Matematik: Sayılar, Üslü İfadeler, Oran Orantı
- Öğretmen:
- Gökalp AY
Anlatılacak Başlıklar*:
- Mol Kavramı
- Sayısından Mol Sayısına
- Kütlesinden Mol Sayısına
- Hacminden Mol Sayısına
- İzotop Atomların Ortalama Atom Kütleleri
* Konu anlatımı, örneklerle zenginleştirilmiştir.
Mol Kavramı
Mol Kavramı Nedir?
- Atomların ve moleküllerin sayısını hesaplamak için geliştirilmiş bir kavramdır.
Avogadro Sayısı (NA)
- 6,02×1023 sayısıdır.
- Sembolleri:
- N
- N0
- NA
- NA = 6,02×1023
- Avogadro sayısı kadar gelen her şey 1 moldür.
Mol Sayısı
- Sembolü, “n” harfidir.
- Birimi “mol” kelimesidir.
- n = 2 mol (2 mol madde demektir.)
- narmut = 0,2 mol (0,2 mol armut demektir.)
- nFe = 0,5 mol (0,5 mol Demir atomu demektir.)
- nH2O = 0,2 mol (0,2 mol H2O molekülü demektir.)
Mol Kavramı
1. Formül: Sayısından Mol Sayısını Hesaplama
Bu formül; bir kimyasal türün sayısından mol sayısını hesaplamak için kullanılır.
Formül:
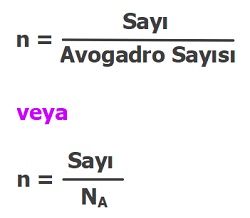
Orantısı:
1 mol olan her şey 6,02×1023 tanedir.
Mol Kavramı
1. Formül: Sayısından Mol Sayısını Hesaplama
Mesela:
- 1 mol akıllı bileklik de
- 1 mol öğrenci de
- 1 mol Ca atomu de
- 1 mol H2O molekülü de
- 6,02×1023 tanedir.
- NA tanedir.
- 2 mol akıllı bileklik de
- 2 mol öğrenci de
- 2 mol Ca atomu de
- 2 mol H2O molekülü de
- 12,04×1023 tanedir.
- 2NA tanedir.
- 0,5 mol akıllı bileklik de
- 0,5 mol öğrenci de
- 0,5 mol Ca atomu de
- 0,5 mol H2O molekülü de:
- 3,01×1023 tanedir.
- 0,5NA tanedir.
Mol Kavramı
1. Formül: Sayısından Mol Sayısını Hesaplama
Örnek:
18,06×1023 tane Fe atomu kaç moldür?
Örnek:
Bir balonun içinde 0,1 mol H2(g) molekülü vardır.
Buna göre, bu balonda kaç tane H2(g) molekülü vardır?
Mol Kavramı
1. Formül: Sayısından Mol Sayısını Hesaplama
Örnek:
3NA tane Hidrojen (H) atomu kaç mol gelir?
Mol Kavramı
Molekül Sayısından Atom Sayısını Bulma
- Molekülün sayısı, atomun sayısı ile çarpılır.
Bir Benzetme:
Kutu Örneği ile Molekül Sayısı – Atom Sayısı Mantığı
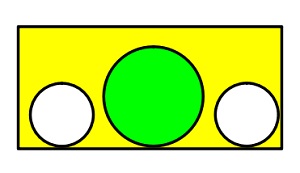
Bir kutuya 2 tane pinpon topu 1 tane de tenis topu koyalım ve ağzını kapatalım. Elimizde bir tane kutu vardır ama toplam 3 tane top vardır. Bu 3 topun 2 tanesi pinpon, 1 tanesi de tenis topudur.
Şimdi kutu örneğini biraz daha ilerletelim ve elimizde bu kutulardan 5 tane olduğunu kabul edelim. Bu durumda, elimizdeki pinpon ve tenis toplarının sayısı hesaplamak için şöyle düşünürüz:
Her kutuda 2 tane pinpon topu olduğundan, 5 tane kutuda:
5 . 2 = 10 tane pinpon topu vardır.
Her kutuda 1 tane tenis topu olduğundan, 5 tane kutuda:
5 . 1 = 5 tane tenis topu vardır.
Kutu örneğinde bir adım daha gidelim ve elimizde 5 mol kutu olduğunu kabul edelim. Gerçi; 5 mol kutu, bütün dünyayı kaplar ama zaten biz de hayal kuruyoruz. Peki; 5 mol kutumuz varsa, kaç mol pinpon ve tenis topumuz vardır? Bunu hesaplamak da oldukça basittir:
Her kutuda 2 tane pinpon topu olduğundan, 5 mol kutuda:
5 . 2 = 10 mol pinpon topu vardır.
Her kutuda 1 tane tenis topu olduğundan, 5 mol kutuda:
5 . 1 = 5 mol tenis topu vardır.
Kutu örneğine devam ederek, soruları tersten soralım. Mesela; elimizdeki kutularda toplam 30 tane pinpon topu olduğunu biliyor olalım. Peki bu durumda kaç tane kutumuz var demektir?
Her kutuda 2 tane pinpon topu olduğundan:
30 / 2 = 15 tane kutumuz var demektir. Çünkü ancak 15 tane kutuda 30 tane pinpon topu bulunabilir.
Peki, elimizde kaç tane kutu olduğunda, toplamda 60 tane topumuz olur? Toplamda 60 tane topumuzun olması için şu hesabı yaparak, elimizdeki kutu sayısını bulabiliriz:
Her kutuda 3 tane top olduğu için:
60 / 3 = 20 tane kutumuz var demektir. Çünkü ancak 20 tane kutuda 60 tane top bulunabilir.
Bu hesapların aynısını, mol sayısı ile de yapabiliriz. Çünkü mol sayısı da topların ya da kutuların kaç tane olduğunu ifade etmenin bir başka yoludur. Hemen bir örnek yapalım.
Kutu örneğine devam edelim biraz önce sorduğumuz soruyu şöyle soralım:
Toplamda 60 mol topumuz varsa kaç mol kutumuz var demektir?
60 tane top için ne yaptıysak 60 mol top için de aynısını yapacağız:
Her kutuda 3 tane top olduğu için:
60 / 3 = 20 mol kutumuz var demektir. Çünkü ancak 20 mol kutuda 60 mol top bulunabilir.
Aynı mantık ile, bileşiklerin moleküllerini birer kutu olarak kabul edin ve moleküldeki atomları da bu kutuların içindeki toplar olarak düşünün.
Mesela; H2O (su) molekülünü bir kutu olsun ve formülde gördüğünüz 2 tane hidrojen ile 1 tane oksijeni bu kutunun içindeki toplar olarak düşünün. Bu durumda, elimizde 1 tane H2O (su) molekülü (kutusu) varsa 3 tane de atom var demektir. Bu 3 atomun 2 tanesi Hidrojen (H), 1 tanesi de Oksijen (O) atomudur.
Mesela:
- 3 tane H2SO4 molekülünde:
- 6 tane H atomu vardır.
- 3 tane S atomu vardır.
- 12 tane O atomu vardır.
- Toplam 21 tane atom vardır.
- 3 mol H2SO4 molekülünde:
- 6 mol H atomu vardır.
- 3 mol S atomu vardır.
- 12 mol O atomu vardır.
- Toplam 21 mol atom vardır.
Mol Kavramı
Molekül Sayısından Atom Sayısını Bulma
Örnek:
5 mol H2O (su) molekülünde toplam kaç mol atom vardır?
Örnek:
3 mol CO2 bileşiğinde kaç tane Oksijen (O) atomu vardır? (NA = 6.1023)
Mol Kavramı
Atom Sayısından Molekül Sayısını Bulma
- Atomun sayısı, yine atomun formüldeki sayısına bölünür.
Bir Benzetme:
Kutu Örneği ile Molekül Sayısı – Atom Sayısı Mantığı

Bir kutuya 2 tane pinpon topu 1 tane de tenis topu koyalım ve ağzını kapatalım. Elimizde bir tane kutu vardır ama toplam 3 tane top vardır. Bu 3 topun 2 tanesi pinpon, 1 tanesi de tenis topudur.
Şimdi kutu örneğini biraz daha ilerletelim ve elimizde bu kutulardan 5 tane olduğunu kabul edelim. Bu durumda, elimizdeki pinpon ve tenis toplarının sayısı hesaplamak için şöyle düşünürüz:
Her kutuda 2 tane pinpon topu olduğundan, 5 tane kutuda:
5 . 2 = 10 tane pinpon topu vardır.
Her kutuda 1 tane tenis topu olduğundan, 5 tane kutuda:
5 . 1 = 5 tane tenis topu vardır.
Kutu örneğinde bir adım daha gidelim ve elimizde 5 mol kutu olduğunu kabul edelim. Gerçi; 5 mol kutu, bütün dünyayı kaplar ama zaten biz de hayal kuruyoruz. Peki; 5 mol kutumuz varsa, kaç mol pinpon ve tenis topumuz vardır? Bunu hesaplamak da oldukça basittir:
Her kutuda 2 tane pinpon topu olduğundan, 5 mol kutuda:
5 . 2 = 10 mol pinpon topu vardır.
Her kutuda 1 tane tenis topu olduğundan, 5 mol kutuda:
5 . 1 = 5 mol tenis topu vardır.
Kutu örneğine devam ederek, soruları tersten soralım. Mesela; elimizdeki kutularda toplam 30 tane pinpon topu olduğunu biliyor olalım. Peki bu durumda kaç tane kutumuz var demektir?
Her kutuda 2 tane pinpon topu olduğundan:
30 / 2 = 15 tane kutumuz var demektir. Çünkü ancak 15 tane kutuda 30 tane pinpon topu bulunabilir.
Peki, elimizde kaç tane kutu olduğunda, toplamda 60 tane topumuz olur? Toplamda 60 tane topumuzun olması için şu hesabı yaparak, elimizdeki kutu sayısını bulabiliriz:
Her kutuda 3 tane top olduğu için:
60 / 3 = 20 tane kutumuz var demektir. Çünkü ancak 20 tane kutuda 60 tane top bulunabilir.
Bu hesapların aynısını, mol sayısı ile de yapabiliriz. Çünkü mol sayısı da topların ya da kutuların kaç tane olduğunu ifade etmenin bir başka yoludur. Hemen bir örnek yapalım.
Kutu örneğine devam edelim biraz önce sorduğumuz soruyu şöyle soralım:
Toplamda 60 mol topumuz varsa kaç mol kutumuz var demektir?
60 tane top için ne yaptıysak 60 mol top için de aynısını yapacağız:
Her kutuda 3 tane top olduğu için:
60 / 3 = 20 mol kutumuz var demektir. Çünkü ancak 20 mol kutuda 60 mol top bulunabilir.
Aynı mantık ile, bileşiklerin moleküllerini birer kutu olarak kabul edin ve moleküldeki atomları da bu kutuların içindeki toplar olarak düşünün.
Mesela; H2O (su) molekülünü bir kutu olsun ve formülde gördüğünüz 2 tane hidrojen ile 1 tane oksijeni bu kutunun içindeki toplar olarak düşünün. Bu durumda, elimizde 1 tane H2O (su) molekülü (kutusu) varsa 3 tane de atom var demektir. Bu 3 atomun 2 tanesi Hidrojen (H), 1 tanesi de Oksijen (O) atomudur.
Mesela:
- Toplam 8 tane oksijen atomu içeren H2SO4 molekülü:
- 8/4 = 2 tanedir.
- Toplam 8 mol oksijen atomu içeren H2SO4 molekülü:
- 8/4 = 2 moldür.
Mol Kavramı
Molekül Sayısından Atom Sayısını Bulma
Örnek:
Toplamda 0,6 mol Hidrojen (H) atomuna sahip H2O (su) molekülleri kaç moldür?
Mol Kavramı
2. Formül: Kütlesinden Mol Sayısını Hesaplama
Formül:
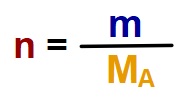
- n: Mol sayısı
- m: Kütle (gram)
- MA: Mol ağırlığı
Orantısı:
1 mol kimyasal tür MA kadar gramdır.
veya
1 tane kimyasal tür MA kadar akb gelir.
MA: Mol Ağırlığı
- Toplam bağıl atom kütlesidir.
Bağıl Atom Kütlesi
- Bir atomun, 12C izotopuna kıyasla ölçülen kütlesidir.
- 12C izotopunun kütlesi, tam olarak, 12,00 akb kabul edilmiştir.
- 1 akb; 12C atomunun kütlesinin 12’de biridir.
- Bağıl atom kütleleri sorunun sonunda parantez içinde verilir.
1 g = 6,02×1023 akb
Mol Kavramı
2. Formül: Kütlesinden Mol Sayısını Hesaplama
Örnek:
He atomu için aşağıdaki soruları cevaplayınız? (He: 4 g/mol)
- 1 tane He atomunun kütlesi: 4 akb
- 5 tane He atomunun kütlesi: 20 akb
- 10 tane He atomunun kütlesi: 20 akb
- 1 mol He atomunun kütlesi: 4 g
- 5 mol He atomunun kütlesi: 20 g
- 10 mol He atomunun kütlesi: 40 g
Mol Kavramı
2. Formül: Kütlesinden Mol Sayısını Hesaplama
Örnek:
H2O bileşiği için aşağıdakileri hesaplayınız. (H:1 g/mol, O:16 g/mol)
- 1 tane H2O atomunun kütlesi:
- 5 tane H2O atomunun kütlesi:
- 10 tane H2O atomunun kütlesi:
- 1 mol H2O atomunun kütlesi:
- 5 mol H2O atomunun kütlesi:
- 10 mol H2O atomunun kütlesi:
Mol Kavramı
2. Formül: Kütlesinden Mol Sayısını Hesaplama
Örnek:
C2H5OH bileşiğinin mol kütlesi 46 ise, bu bileşikteki Karbon atomunun bağıl atom kütlesi kaçtır? (H:1, O:16)
Örnek:
112 gram Fe (Demir) elementi kaç mol gelir? (Fe: 56 g/mol)
Mol Kavramı
2. Formül: Kütlesinden Mol Sayısını Hesaplama
Örnek:
22 gram CO2 (Karbon dioksit) gazı kaç mol gelir? (C: 12 g/mol, O: 16 g/mol)
Örnek:
5 mol H2O bileşiği kaç gram gelir? (H2O: 18 g/mol)
Mol Kavramı
2. Formül: Kütlesinden Mol Sayısını Hesaplama
Örnek:
3 mol H2SO4 bileşiği kaç gramdır? (H:1 g/mol, S:32 g/mol, O:16 g/mol)
Örnek:
3 mol H2SO4 bileşiğinde kaç gram H elementi vardır? (H:1 g/mol)
Mol Kavramı
2. Formül: Kütlesinden Mol Sayısını Hesaplama
Örnek:
12,8 gram Oksijen elementi içeren H2SO4 bileşiği kaç mol gelir? (O:16 g/mol)
Örnek:
12 tane H2O molekülü kaç akb gelir? (H: 1 g/mol, O: 16 g/mol)
Mol Kavramı
2. Formül: Kütlesinden Mol Sayısını Hesaplama
Örnek:
112 gram Fe (Demir) elementi kaç akb gelir?
Örnek:
0,5 mol CO2 (Karbon dioksit) gazı kaç akb gelir? (C: 12 g/mol, O: 16 g/mol)
Mol Kavramı
2. Formül: Kütlesinden Mol Sayısını Hesaplama
Örnek:
I) 10 tane O2 molekülü
II) 10 tane atom içeren O2 molekülü
III) 10 mol O2 molekülü
IV) 32 akb O2 molekülü
Yukarıda verilen maddeleri, kütlelerine göre sıralayınız. (O: 16 g/mol)
Mol Kavramı
3. Formül: Hacminden Mol Sayısını Hesaplama
Bir gazın hacminden mol sayısını hesaplamak için kullanılır.
Formül:

- Formülde:
- V: Hacim (Litre olarak)
- n: Mol sayısı demektir.
Orantısı:
NŞA 1 mol gaz 22,4 Litre hacim kaplar.
- NŞA:
- Normal şartlar altında demektir.
- 0oC de ve 1 atm basınç yapan her gaz normal koşullarda sayılır.
Mol Kavramı
3. Formül: Hacminden Mol Sayısını Hesaplama
Örnek:
NŞA 11,2 Litre hacim kaplayan CH4 gazı kaç mol gelir?
Mol Kavramı
3. Formül: Hacminden Mol Sayısını Hesaplama
Örnek:
6,4 gram O2(g) normal koşullarda kaç Litre gelir?(O: 16 g/mol)
Örnek:
Toplam 0,5.NA tane atom içere CH4 (metan) gazı normal koşullarda kaç Litre hacim kaplar?
Mol Kavramı
3. Formül: Hacminden Mol Sayısını Hesaplama
Oda Koşullarındaki Gazlar İçin
- Oda koşullarında:
- Gazın basıncı 1 atm, sıcaklığı 25 oC değerindedir.
- 1 mol gaz 24,5 Litre gelir.
- Oda koşullarındaki bir gazın mol sayısı için, aşağıdaki formül kullanılabilir:
1 mol gaz 24,5 L hacim kaplar.
veya

Mol Kavramı
Mol Sayısının Diğer İfadeleri
- Aşağıdaki ifadelerin hepsi mol sayısı yerine kullanılabilir:
- Formül-gram: İyonik bileşiklerin mol sayısı demektir.
- İyon-gram: İyonların mol sayısı demektir.
- Molekül-gram: Kovalent bileşiklerin mol sayısı demektir.
- Atom-gram: Atomların mol sayısı demektir.
Mesela:
- 2 molekül-gram H2O demek
- 2 mol H2O demektir.
- 3 iyon-gram Na+ demek
- 3 mol Na+ iyonu demektir.
- 4 atom-gram Fe demek
- 4 mol Fe atomu veya elementi demektir.
- 5 formül-gram NaCl demek
- 5 mol NaCl demektir.
Mol Kavramı
3. Formül: Hacminden Mol Sayısını Hesaplama
Örnek:
I) CH4
II) C2H4
III) C3H8
Yukarıdaki bileşiklerin her birinden bir miktar örnek alınıyor. Daha sonra, örneklerin üçünün de, eşit sayıda Hidrojen (H) atomu içerdiği anlaşılıyor.
Buna göre, bu üç bileşikten alınan örneklerin, kütleleri arasındaki ilişki, hangi seçenekte doğru olarak verilmiştir?
A) I=II=III
B) I>II>III
C) II>III>I
D) III>II=I
E) II>I>III
Mol Kavramı
İzotop Atomlarda Ortalama Atom Kütlesi (OAK)
OAK = (1. izotopun kütlesi x 1. izotopun yüzdesi) + (2. izotopun kütlesi x 2. izotopun yüzdesi) + (3. izotopun kütlesi x 3. izotopun yüzdesi) + …
- Proton sayıları aynı, nötron sayıları farklı olan atomlara izotop atomlar denir.
- İzotop atomların:
- Fiziksel özellikleri farklıdır.
- Kimyasal özellikleri aynıdır.
- Tabiattaki bollukları farklıdır.

Mol Kavramı
İzotop Atomlarda Ortalama Atom Kütlesi (OAK)
Örnek:
Bakır (Cu) elementinin iki izotopundan, 63Cu doğada %80 oranında, 65Cu doğada %20 oranında bulunmaktadır.
Cu atomunun ortalama atom kütlesini (OAK) bulunuz.

Kimyanın Temel Kanunları ve Kimyasal Hesaplamalar
II. Bölüm
(Mol Kavramı)
Bitti
