İçindekiler
- Kimyasal Tepkimelerde Hesaplamalar dersi, bize, bir kimyasal tepkime denklemine bakarak, nasıl hesap yapabileceğimizi öğretir.
- Bu konu, içinde hesaplama bulunan bütün kimya ünitelerinde karşımıza çıkacaktır. Bu yüzden, özellikle sayısal düşünen öğrencilerin dikkat etmesi gereken önemli bir konudur.
- Bu dersin anlaşılması için; Mol Kavramı ve Kimyasal Tepkime Denklemlerinin Denkleştirilmesi konusunun anlaşılmış olması gerekir.
Mol Kavramı ve Kimyasal Tepkime Denklemlerinin Denkleştirilmesi ile ilgili bir sorun yaşıyorsanız, aşağıdaki derslere tıklayarak, eksiğinizi giderebilirsiniz:
Kimyasal Hesaplamalar
- Kimyasal hesaplamalar, tepkimelerdeki maddelerin;
- mol sayılarını
- kimyasal türlerinin sayısını
- kütlelerini
- hacimlerini hesaplama işlemidir.
- Kimyasal tepkimelerde, bu özellikleri hesaplarken, daha çok “mol kavramı” kurallarından yararlanırız.
Bu bir reklamdır:
Kimyasal Hesaplamalarda Katsayıların Anlamı
Kimyasal tepkimelerde hesaplama yaparken, tepkime denklemindeki katsayılarından şöyle yararlanılır:
- Kimyasal tepkimelerde katsayıların oranı; maddelerin mol sayıları arasındaki oranı verir.
Öğretici Örnek:
4A + 2B → 3C
Yukarıdaki tepkimenin katsayılarına bakarak şunları söyleyebiliriz:
- 4 mol A maddesi ile 2 mol B maddesi tepkimeye girer ve 3 mol C oluşur.
- 8 mol A maddesi ile 4 mol B maddesi tepkimeye girer ve 6 mol C oluşur.
- 12 mol A maddesi ile 6 mol B maddesi tepkimeye girer ve 9 mol C maddesi oluşur.
- …
- Kimyasal tepkimelerde katsayıların oranı; maddelerin kimyasal türlerinin sayıları arasındaki oranı verir.
Öğretici Örnek:
4A + 2B → 3C
Yukarıdaki tepkimenin katsayılarına bakarak şunları söyleyebiliriz:
- 4 tane A ile 2 tane B tepkimeye girer ve 3 tane C oluşur.
- 8 tane A ile 4 tane B tepkimeye girer ve 6 tane C oluşur.
- 12 tane A ile 6 tane B tepkimeye girer ve 9 tane C oluşur.
- …
Bu bir reklamdır:
- Kimyasal tepkimelerde katsayıların oranı; aynı koşullardaki gazların hacimleri arasındaki oranı verir.
Öğretici Örnek:
4A(g) + 2B(g) → 3C(g)
Yukarıdaki tepkimenin katsayılarına bakarak şunları söyleyebiliriz:
- 4 Litre A gazı ile 2 Litre B gazı tepkimeye girer ve 3 Litre C gazı oluşur.
- 8 Litre A gazı ile 4 Litre B gazı tepkimeye girer ve 6 Litre C gazı oluşur.
- 12 Litre A gazı ile 6 Litre B gazı tepkimeye girer ve 9 Litre C gazı oluşur.
- …
Bu bir reklamdır:
Örnek:
3H2 + N2 → 2NH3
Yukarıdaki tepkimeye göre, 6 mol H2 (Hidrojen) kaç mol N2 (Azot) ile tepkime verir?
Cevap
Örneğin çözümü:
Katsayılar Mutlaka Olmalı
- Kimyasal hesabın temelinde, tepkimedeki katsayılar yatar dedik.
- Demek ki, bir kimyasal tepkime ile ilgili hesap yapabilmek için, öncelikle, tepkimedeki maddelerin katsayılarına bakmamız gerekiyor.
- Tepkimelerin katsayıları, ancak, tepkime denkleştirilmişse bellidir.
- Bu durumda, bir kimyasal tepkime denk değilse, hesap yapmaya başlamadan önce tepkimeyi denkleştirmemiz gerekir.
Bu bir reklamdır:
Örnek:
H2 + N2 → NH3
Yukarıdaki tepkimeye göre, 8 mol NH3 (Amonyak) oluşması için kaç mol H2 (Hidrojen) kullanılmalıdır?
Cevap
Örneğin çözümü:
Katsayıları Doğru Kullanmak
- Kimyasal bir tepkimede katsayıların oranı her zaman, aşağıda verilen özelliklerin oranını verir:
- Mol oranı
- Sayı oranı
- Sabit basınçtaki gazların hacim oranı
- Katsayıların oranı, hiç bir zaman, maddelerin kütleleri arasındaki oranı vermez.
Örnek:
3H2(g) + N2(g) → 2NH3(g)
Yukarıdaki tepkimeye göre, 12 litre N2 (Azot) gazının tam tepkimesinden, aynı şartlarda, kaç litre NH3 gazı oluşur?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
3H2(g) + N2(g) → 2NH3(g)
Yukarıdaki tepkimeye göre, 24 tane H2 (Hidrojen) molekülünün tam tepkimesinden, kaç tane NH3 (Amonyak) molekülü oluşur?
Cevap
Örneğin çözümü:
Soru Tipleri
- Kimyasal hesaplamalar ile ilgili soru tipleri ne olursa olsun, kullanacağımız kural ve formüller hep aynıdır:
- mol sayısı kuralları
- katsayıların oranı.
Kimyasal hesaplama soruları, genelde şu tiplerde gelir:
1. Bir Maddenin Miktarı Verilir Diğeri Sorulursa
- Yukarıda çözdüğümüz sorular bu tip sorulardır.
- Bu tip sorularda, tepkimedeki maddelerden birinin miktarı verilir, diğerinin miktarı sorulur.
- Bu sorular çözülürken, verilen ve sorulan maddelerin katsayıları arasındaki orana bakılır. Bu orana göre, sorulan maddenin miktarı hesaplanır.
Örnek:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) + ısı
Yukarıdaki tepkimeye göre, 48 gram Metan (CH4) gazı yandığında, kaç mol su (H2O) buharı oluşur? (C: 12 g/mol, H: 1 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) + ısı
Yukarıdaki tepkimede, NK (Normal Koşullarda) 5,6 L CO2 (Karbon dioksit) gazı oluştuğuna göre, kaç gram O2 (Oksijen) gazı harcanmıştır? (O: 16 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
2Al(k) + 6HCl(suda) → 2AlCl3(suda) + 3H2(g)
tepkimesine göre, oluşan H2 gazının normal koşullarda (NK) hacmi 6,72 litredir.
Buna göre tepkimede kaç tane Al atomu harcanmıştır?
Cevap
Örneğin çözümü:
2. Karışım Soruları
- Bir karışımda, kimsenin tepkimesi kimseyi ilgilendirmez.
- Karışımdaki maddelerin tepkimelerini ayrı ayrı yazmalıyız.
- Karışımdaki her bir maddenin tepkimesi için, ayrı ayrı, yukarıda öğrendiğimiz kuralları kullanırız.
Örnek:
CH4 ile C2H6 gazlarından oluşan bir karışımın, 5 molü tamamen yanıyor ve bu karışımın yanmasından toplam 8 mol CO2 gazı oluşuyor.
Buna göre bu karışımdaki, CH4 ile C2H6 gazlarının kütleleri kaçar gramdır? (C: 12 g/mol, H: 1 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Zn ile Agʼden oluşan 160 gramlık karışım, yeterince HCl ile tepkimeye girince NKA’da 44,8 L H2 gazı açığa çıktığına göre;
a) Karışımdaki gümüşün kütlesi kaç gramdır?
b) Karışımdaki gümüşün kütlece yüzdesi nedir? (Zn: 65 g/mol)
Cevap
Örneğin çözümü:
3. Mol Ağırlığı (MA) Soruları
Mol sayısı formülünden:
MA = m / n
- Bu tip sorularda, tepkimedeki bir bileşiğin ya da elementin mol ağırlığını (MA) bulmamız gerekecek.
- Bunu için bir şekilde, bu maddenin mol sayısına ve kütlesine ulaşmaya başarmalıyız çünkü; yukarıda da görüldüğü gibi, kütlesini mol sayısına bölünce, maddenin mol ağırlığı bulunur.
Bu bir reklamdır:
Örnek:
X + 2HBr → XBr2 + H2(g)
Yukarıdaki tepkimeye göre, 16 gram X yeterince HBr ile tepkimeye girdiğinde NKA’da 0,4 mol H2 gazı açığa çıkıyor.
Buna göre X elementinin atom kütlesi kaçtır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
X(OH)2(k) + 2HNO3(suda) → X(NO3)2(suda) + 2H2O(s)
tepkimesine göre 23,2 gram X(OH)2 yeterince HNO3 ile tepkimeye girdiğinde 14,4 gram H2O oluşuyor.
Buna göre X elementinin mol kütlesini hesaplayınız. (H: 1 g/mol, O: 16 g/mol)
Cevap
Örneğin çözümü:
4. Bileşik Formülü Bulma Soruları
Bileşik formülü bulma soruları iki çeşittir:
- Tepkime Denkleminden Bileşik Formülü Bulma Soruları
- Bu tip sorularda, bir tepkime denklemi verilir yada kurulur. Tepkime bir şekilde eşitlenir. Eşit olan tepkimedeki atom sayıları da eşit olmalıdır. Bu kural düşünülerek formüldeki sayılar bulunur.
- Mol Sayılarından Bileşik Formülü Bulma Soruları
- Bileşikteki bütün atomların ayrı ayrı mol sayıları bulunur. Bulunan mol sayıları, en küçük tam sayılara çevrilerek atomların altına yazılır. Bu şekilde bileşiğin kaba formülü elde edilir.
Örnek:

Yukarıdaki grafik, bir kimyasal tepkimeye ait hacim-zaman grafiğidir. Tepkimedeki maddelerin hepsinin gaz olduğu bilinmektedir.
Bu gazlar, aynı koşullarda olduğuna göre, XaYb gazının formülü nedir?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
C, H, ve O elementlerinden oluşan bir bileşiğin 9,2 gramında; 4,8 gram C, 1,2 gram da H elementi vardır.
Buna göre bu bileşiğin kaba formülü nedir? (C: 12 g/mol, H: 1 g/mol, O: 16 g/mol)
Cevap
Örneğin çözümü:
5. Sınırlayıcı Reaktif (Artan Madde) Soruları
- Artan madde sorularında, tepkimeye giren en az iki maddenin miktarları verilir. Fakat, katsayılara göre hesaplandığında, maddelerin biri diğerine fazla gelir.
- Fazla gelen madde, diğer madde bittiği için artacaktır.
- Artan maddelerin olduğu tepkimelerde, tamamen biten maddeye sınırlayıcı bileşen veya sınırlayıcı reaktif denir.
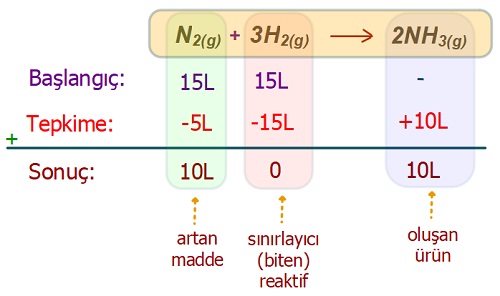
Örnek:
N2(g) + 3H2(g) → 2NH3(g)
Aynı koşullardaki, 15’er Litre N2 ve H2 gazı yukarıdaki denkleme göre tepkimeye giriyor.
Tepkime tam verimle gerçekleştiğine göre, artan gazın ve oluşan NH3 gazının hacmini hesaplayınız.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
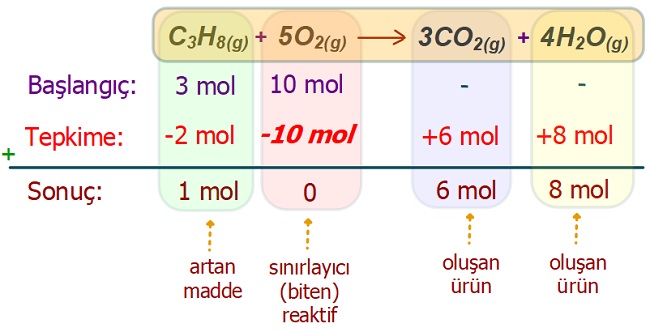
Örnek:
132 gram C3H8 ile 10 mol O2 gazı karışımının, tam verimle yanması sonucu, kaç mol CO2 gazı elde edilir.
Buna göre, bu tepkimede, hangi maddeden kaç gram artar? (C: 12 g/mol, H:1 g/mol, O: 16 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
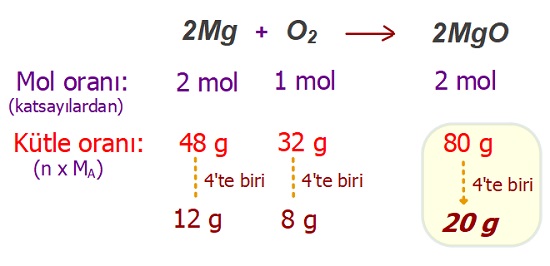
Örnek:
Eşit kütledeki magnezyum ve oksijen tepkimesinden 20 gram magnezyum oksit elde edilmektedir.
Buna göre, bu tepkimde, başlangıçta alınan magnezyum ve oksijen miktarları ve artan elementin miktarı nedir? (O: 16 g/mol, Mg: 24 g/mol)
Cevap
Örneğin çözümü:
6. Yüzde Verim Soruları
- Tam verimle gerçekleşen tepkimelerde, tepkimeye giren maddelerin en az biri sıfırlanır. Yani, tepkime sonuna kadar gerçekleşir.
- Ürünlerin miktarı da, sıfırlanan (sınırlayıcı bileşenin) miktarına göre hesaplanan kadardır.
- Bu şekilde, girenlerden en az birinin tükendiği tepkimeler, %100 verimle gerçekleşir.
- Fakat gerçekte, bir çok tepkime, tam verimle gerçekleşmez. Yani, bir çok tepkimede, tam verime göre hesapladığımızdan daha az ürün oluşur. Böyle tepkimelerde, verim %100 değildir.
- Bir tepkimede, hesaplanan ürün miktarına teorik (kuramsal) verim, tepkimede oluşan gerçek ürün miktarına da gerçek verim denir.
- Yani teorik verim, beklenen ürün miktarıdır; gerçek verim, tepkimede oluşan ve elimize geçen ürün miktarıdır.
Bir tepkimenin yüzde verimi, şu formül ile hesaplanır:

Mesela; biz tepkimeden 5 mol madde beklerken, 3 mol oluştuysa, o tepkime %100 verimle gerçekleşmemiştir. Tepkimenin verimini şöyle hesaplayabiliriz:
% verim = ( 3 / 5 ) x 100
% verim = 60
Yani tepkime, %60 verimle gerçekleşmiştir.
Tepkimelerin veriminin, %100’den daha düşük olmasının çeşitli nedenleri olabilir. Bu nedenlerden bazıları aşağıda sıralanmıştır:
- İstenmeyen başka tepkimeler gerçekleşerek istenen ürünün yanında yan ürünler oluşabilir veya oluşan ürünler kendi aralarında başka tepkimeler verebilir.
- Bazı tepkimeler tersinir (geri dönebilir) tepkimedir. Oluşan ürünlerin bir kısmı tekrar başlangıçtaki maddeleri oluşturur.
- Sulu çözeltiler gibi bazı ortamlardan ürünün alınması zordur. İşlemler sırasında madde kaybı olabilir.
- Elde edilen ürünün saf olmayışı, saflaştırma yapılırken madde kaybı olması verimi düşürebilir.
- Kullanılan sistem veya cihazlardan kaynaklanan hatalar olabilir.
- Tepkimenin gerçekleştiği basınç ve sıcaklık koşullarına bağlı olarak maddenin bir kısmı tepkimeye girmeyebilir.
Örnek:
Bir tepkimede hesaplanan teorik verim 8 gramdır. Ancak elde edilen ürün 6,4 gramdır.
Buna göre, bu tepkimede % verim nedir?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Ca(k) + 2HCI(suda) → CaCl2(suda) + H2(g)
Yukarıdaki tepkimeye göre, Ca ve yeterince HCIʼin tepkimesinden, normal koşullarda 33,6 L H2 gazı oluşmaktadır.
Tepkimenin %75 verimle gerçekleştiği bilindiğine göre, başlangıçta kullanılan Ca kütlesi kaç gramdır? (Ca:40 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
16 gram kükürt (S) yandığında, NK’da 8,96 litre SO2 elde ediliyor.
Tepkimenin yüzde verimi kaçtır? (S: 32 g/mol)
Cevap
Örneğin çözümü:
7. Saf Olmayan Madde Soruları
- Tabiatta saf madde bulmak oldukça zordur. Laboratuvarlarda kullanılan maddelerin bile neredeyse hepsi, %100 saf değildir.
- Mesela; laboratuvar ortamında, rafından indirip, 40 gram Ca (Kalsiyum) metali tarttınız. Büyük ihtimal, tarttığınız Ca metalinin içinde 1-2 gram başka maddeler de vardır.
- Bir maddenin içine karışmış başka maddelere safsızlık denir.
- Safsızlığından dolayı, 40 gram sandığınız Ca metali ile gerçekleştirdiğiniz tepkimede, oluşacak ürünler, tam da 40 gram Ca metalinden beklenen kadar olmayacaktır.
- Bir maddenin, saflık miktarı, yüzde olarak verilir.
- Mesela, saflığı %80 olan Ca metalinden, 100 gram tartarsanız, tarttığınız Ca metalinin 20 gramı başka maddeler, 80 gramı gerçekten Ca metalidir.
Örnek:
MgCO3(k) → MgO(k) + CO2(g)
%50 saflıkta MgCO3 içeren 42 gramlık bir karışım, yukarıdaki tepkimeye göre ayrışıyor.
Tepkimede kaç gram MgO oluştuğunu ve oluşan CO2 gazının, NK’daki hacmini hesaplayınız. (C: 12 g/mol, O: 16 g/mol, Mg: 24 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:



5 yorum “4. Kimyasal Tepkimelerde Hesaplamalar”