“Kimyasal Tepkimelerde Denge” ünitesi, Kimya 11 dersinin 6. ünitesidir. Bu ünite bir AYT konusudur.
Kimyasal Tepkimelerde Denge ünitesinden, AYT sınavında, her yıl ortalama 2 tane soru gelmektedir.
Ünitenin Bölümleri
- Kimyasal Denge
- Dengeyi Etkileyen Faktörler
- Sulu Çözelti Dengeleri
Bu Üniteyi Anlamak İçin Bilmen Gerekenler
- Kimyasal Türler Arası Etkileşimler
- Mol Kavramı
- Kimyasal Tepkimeler ve Denklemler
- Kimyasal Tepkimelerde Hesaplamalar
- Kimyasal Tepkimelerde Hız
- Oran Orantı
Ünitenin Anahtar Kavramları
- Asit-baz çifti
- Asitlik/bazlık sabiti
- Brönsted-Lowry asidi/bazı
- Çökelme tepkimesi
- Çözünürlük çarpımı
- Denge sabiti
- Eşdeğerlik noktası
- İndikatör
- Kimyasal denge
- Kuvvetli asit/baz
- Le Chatalier İlkesi
- Oto-iyonizasyon
- pH/pOH
- Tampon çözelti
- Titrasyon
- Zayıf asit/baz
Ünitenin Kazanımları
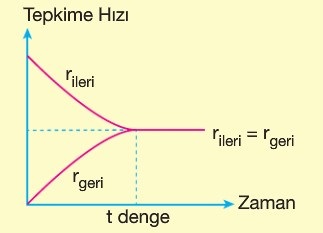
- İleri ve geri tepkime hızları üzerinden denge açıklanır.
- Dengeyi etkileyen faktörleri açıklar.
- Sıcaklığın, derişimin, hacmin, kısmi basınçların ve toplam basıncın dengeye etkisi, denge ifadesi üzerinden açıklanır.
- Le Chatalier İlkesi, örnekler üzerinden irdelenir.
- Katalizör-denge ilişkisi vurgulanır.
- pH ve pOH kavramlarını suyun oto-iyonizasyonu üzerinden açıklar.
- Brönsted-Lowry asitlerini/bazlarını karşılaştırır.
- Katyonların asitliğini ve anyonların bazlığını, su ile etkileşimleri temelinde açıklar.
- Kuvvetli/zayıf asitler ve bazlar tanıtılır; konjuge asit-baz çiftlerine örnekler verilir.
- Asit gibi davranan katyonların ve baz gibi davranan anyonların su ile etkileşimleri üzerinde durulur.
- Asitlik/bazlık gücü ile ayrışma denge sabitler arasında ilişki kurar.
- Asitlerin/bazların iyonlaşma oranlarının denge sabitleriyle ilişkilendirilmesi sağlanır.
- Kuvvetli ve zayıf monoprotik asit/baz çözeltilerinin pH değerlerini hesaplar.
- Çok derişik ve çok seyreltik asit/baz çözeltilerinin pH değerlerine girilmez.
- Zayıf asitler/bazlar için [H+] = (Ka.Ca)1/2 ve [OH–]=(Kb.Cb)1/2 eşitlikleri esas alınır.
- Polprotik asitlere girilmez.
- Tampon çözeltilerin özellikleri ile günlük kullanım alanlarını ilişkilendirir.
- Tampon çözeltilerin pH değerlerinin seyrelme ve asit/baz ilavesi ile fazla değişmemesi ortamdaki dengeler üzerinden açıklanır. Henderson formülü ve tampon kapasitesine girilmez.
- Tampon çözeltilerin canlı organizmalar açısından önemine değinilir.
- Tuz çözeltilerinin asitlik/bazlık özellikleri açıklanır.
- Anyonu zayıf baz olan tuzlara örnekler verilir.
- Katyonu NH4+ veya anyonu HSO4- olan tuzların asitliği üzerinde durulur.
- Hidroliz hesaplamalarına girilmez.
- Kuvvetli asit/baz derişimlerini titrasyon yöntemiyle belirler.
- Titrasyon deneyi yaptırılıp, sonuçların grafik üzerinden gösterilere yorumlanması sağlanır.
- Titrasyonla ilgili hesaplama örnekleri verilir.
- Sulu ortamlarda çözünme-çökelme dengeleri açıklanır.
- Çözünme-çökelme denge örneklerine yer verilir; çözünürlük çarpımı (Kçç) ve çözünürlük (s) kavramları ilişkilendirilir.
- Tuzların çözünürlüğüne etki eden faktörlerden; sıcaklık ve ortak iyon etkisi üzerinde durulur.