İçindekiler
“Tepkimelerde Isı Değişimi“, tepkimelerin enerji ile ilişkisini anlamamızı sağlayan bir başlıktır.
- Bütün kimyasal tepkimeler, ortamdan (çevreden) az ya da çok, enerji alarak başlarlar ve gerçekleşirken ortama az ya da çok enerji verirler.
Endotermik ve Ekzotermik Tepkimeler
- Bütün kimyasal tepkimelerin başlaması için, çevreden (ortamdan) enerji almaları gerekir.
- Çevreden ısı enerjisi alarak başlayan tepkimeler, gerçekleşirken, bu defa, çevreye enerji verirler.
- Bazı tepkimeler, aldığı enerjiden daha fazlasını geri verirler, bazılar ise daha azını geri verirler.
- Tepkimeler; ısı alma ve ısıyı geri verme durumlarına göre, “endotermik tepkimeler” ve “ekzotermik tepkimeler” olarak sınıflandırılırlar.
Gelin, “endotermik ve ekzotermik tepkime” kavramlarını daha yakından tanıyalım.
Endotermik Tepkimeler
- Bazı tepkimeler, ortamdan aldığı ısının hepsini değil, bir kısmını geri verir ve sonuçta ısı almış olur.
- Böyle tepkimelere, endotermik (ısı alan) tepkime denir.
- Bir endotermik tepkimede, ortam, tepkimedeki maddelere verdiği enerjiden daha azını geri alabilir.
- Yani, tepkime sonucunda, enerji değeri açısından, ortam zararlı çıkar, tepkimedeki maddeler karlı çıkar.
- Endotermik tepkimeler gerçekleşirken, maddeler, ortamdan aldıkları enerjinin çoğunu potansiyel enerji olarak depolarlar.
- Bu yüzden bir endotermik tepkimede, ürünlerin enerjisi her zaman artar ve girenlerin enerjisinden daha fazla olur.
- Bir endotermik tepkime gerçekleşirken, tepkimedeki maddelerin, potansiyel enerjilerinin zamanla değişimi, aşağıdaki grafikte gösterildiği şekilde olur:

- Grafikten de anlaşılıyor ki; endotermik bir tepkimede, ürünlerin enerjisi girenlerden daha fazladır.
- Endotermik bir tepkimeye giren maddelerin, ürünlere dönüşebilmesi için çevreden enerji almaları gerekir.
- Endotermik tepkimelerde, maddeler çevreden aldıkları enerjiyi, potansiyel enerji olarak depolarlar.
Bu bir reklamdır:
Endotermik Tepkimelerin Denklemleri
- Endotermik tepkimeleri, grafiklerinden başka, tepkime denklemlerine bakarak da tanıyabiliriz.
Bir endotermik tepkimeyi denkleminden tanımanın iki yolu vardır:
I. YOL:
Bir tepkimenin endotermik olduğunu anlamanın bir yolu; tepkime denkleminin girenler kısmına bakmaktır. Endotermik tepkimeler ısı aldıkları için, tepkime denkleminin girenler kısmında:
– sayısal bir enerji değeri veya
– enerji değerini temsil eden bir sembol (Q veya E gibi) veya
– enerji ile ilgili bir kelime (Enerji veya ısı gibi) veya
olmalıdır. Aşağıda, endotermik bir tepkime üç farklı şekilde verilmiştir:
A + B + ısı → C + D
A + B + Q → C + D
A + B + 190 kj/mol → C + D
(Yukarıda verilen 190 sayısı temsilidir, bunun yerine herhangi bir sayı olabilir.)
II. YOL:
Bir tepkimenin endotermik olduğunu anlamanın bir başka yolu da, tepkimenin entalpi değişimi (ΔH) değerine bakmaktır. Endotermik tepkimelerin ΔH değeri sıfırdan büyüktür.
Aşağıda, endotermik bir tepkimenin denklemi verilmiştir:
A + B + → C + D ΔH = +190 kj/mol
Tepkimede verilen ΔH = +190 kj/mol değeri, bu tepkimenin 190 kj/mol kadar enerji aldığını gösterir.
(Yukarıda verilen 190 sayısı temsilidir, bunun yerine herhangi bir sayı olabilir.)
Endotermik Tepkime Örnekleri
- Erime, kaynama ve süblimleşme olayları
- Ekzotermik tepkimelerin tersi endotermiktir.
Bu bir reklamdır:
Ekzotermik Tepkimeler
- Bir tepkime, ortamdan aldığı enerjiden daha fazlasını geri veriyorsa, bu tepkimeye, ekzotermik (ısı veren) tepkime denir.
- Bir ekzotermik tepkimede, ortam, tepkimedeki maddelere verdiği enerjiden daha fazlasını geri alır.
- Yani, tepkime sonucunda, enerji değeri açısından, ortam karlı çıkar, tepkimedeki maddeler zararlı çıkar.
- Ekzotermik tepkimeler gerçekleşirken, maddeler, zaten depo etmiş oldukları enerjinin de bir kısmını ortama verirler.
- Bu yüzden bir ekzotermik tepkimede, ürünlerin enerjisi her zaman azalır ve girenlerin enerjisinden daha az olur.
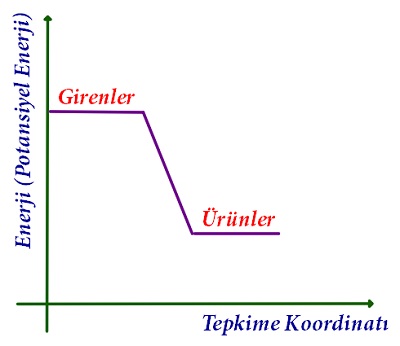
- Grafikten de anlaşılıyor ki; ekzotermik bir tepkimede, ürünlerin enerjisi girenlerden daha azdır.
- Ekzotermik bir tepkimeye giren maddelerin, ürünlere dönüşebilmesi için depo ettikleri potansiyel enerjinin bir kısmını vermeleri gerekir. Bu yüzden, oluşan ürünlerin potansiyel enerjisi her zaman, girenlerden daha azdır.
Bu bir reklamdır:
Ekzotermik Tepkimelerin Denklemleri
- Ekzotermik tepkimeleri, grafiklerinden başka, tepkime denklemlerine bakarak da tanıyabiliriz.
Bir ekzotermik tepkimeyi denkleminden tanımanın iki yolu vardır:
I. YOL:
Bir tepkimenin ekzotermik olduğunu anlamanın bir yolu; tepkime denkleminin ürünler kısmına bakmaktır. Ekzotermik tepkimeler ısı verdikleri için, tepkime denkleminin ürünler kısmında:
– sayısal bir enerji değeri veya
– enerji değerini temsil eden bir sembol (Q veya E gibi) veya
– enerji ile ilgili bir kelime (Enerji veya ısı gibi) veya
olmalıdır. Aşağıda, ekzotermik bir tepkime üç farklı şekilde verilmiştir:
C + D → A + B + ısı
C + D → A + B + Q
C + D → A + B + 190 kj/mol
(Yukarıda verilen 190 sayısı temsilidir, bunun yerine herhangi bir sayı olabilir.)
II. YOL:
Bir tepkimenin ekzotermik olduğunu anlamanın bir başka yolu da, tepkimenin entalpi değişimi (ΔH) değerine bakmaktır. Ekzotermik tepkimelerin ΔH değeri sıfırdan küçüktür.
Aşağıda, ekzotermik bir tepkimenin denklemi verilmiştir:
C + D → A + B ΔH = -190 kj/mol
Tepkimede verilen ΔH = -190 kj/mol değeri, bu tepkimenin 190 kj/mol kadar enerji verdiğini gösterir.
(Yukarıda verilen 190 sayısı temsilidir, bunun yerine herhangi bir sayı olabilir.)
Ekzotermik Tepkime Örnekleri
- Yanma tepkimeleri (İstisna: N2 gazının yanması endotermiktir.)
- Donma, yoğunlaşma ve kırağılaşma olayları
- Nötürleşme tepkimeleri
- Endotermik tepkimelerin tersi ekzotermiktir.
Bu bir reklamdır:
Endotermik ve Ekzotermik Tepkimelerin Enerji Grafikleri
- Yukarıda verdiğimiz grafiklerin yanında, endotermik ve ekzotermik tepkimelerin Enerji-Tepkime Koordinatı grafikleri şöyle de verilebilir:
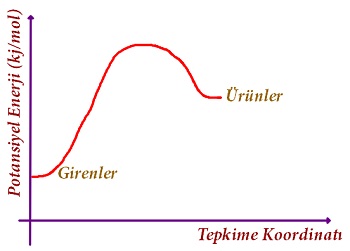

- Endotermik ve ekzotermik tepkimelerin Enerji grafikleri şöyle de karşımıza çıkabilir:

Bu bir reklamdır:
Örnek:
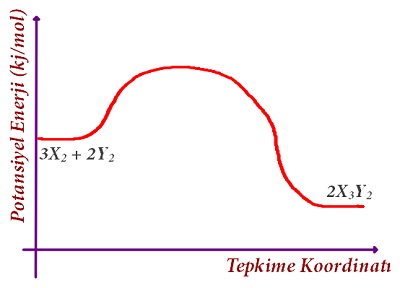
Yukarıdaki grafik, bir kimyasal tepkimeye aittir.
Buna göre bu grafik ile ilgili olarak aşağıdakilerden hangisi yanlıştır?
A) Endotermik bir tepkimeye aittir.
B) Tepkimenin denklemi şöyledir: 3X2 + 2Y2 → 2X3Y2 + ısı
C) Ürünlerin potansiyel enerjisi, girenlerden daha azdır.
D) Tepkime bir yanma tepkimesi olabilir.
E) Tepkime gerçekleşirken ortamın enerjisi artar.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Tepkimelerde Minimum Enerji Eğilimi ve Kararlılık
- Maddelerin tabiatta 2 eğilimi (isteği) vardır. Bunlar:
- Minimum enerji eğilimi: Maddeler, sahip oldukları enerjiden mümkün olduğunca kurtulmak ister.
- Maksimum düzensizlik eğilimi: Maddeler, mümkün olduğunca dağınık ve düzensiz halde olmak ister.
- Bu eğilimlerin detayları ilerleyen ünitelerin konusudur.
- Tepkimelerde taraflardan bahsediliyorsa, girenler bir taraf ürünler ise diğer taraf olarak düşünülür. Buna göre tepkimelerde;
- Normalde veya düşük sıcaklıkta
- ısının olduğu taraf daha kararlıdır.
- Yüksek sıcaklıkta
- ısının olmadığı taraf daha kararlıdır.
- Normalde veya düşük sıcaklıkta
Öğretici Örnek:
3X2 + 2Y2 → 2X3Y2 + ısı
- Kararlılık:
- Normalde, ürünler daha kararlıdır.
- Yüksek sıcaklıkta girenler daha kararlıdır.
A + B + ısı → C + D
- Kararlılık:
- Normalde, girenler daha kararlıdır.
- Yüksek sıcaklıkta ürünler daha kararlıdır.
- Hatırlatma: Tepkimenin ΔH değerinin negatif olması demek, ısının ürünler tarafında olması, pozitif olması demek ise girenler tarafında olması demektir.
Tepkimelerin Kendiliğinden Devam Etmesi
- Hiçbir tepkime kendiliğinden başlamaz.
- Bütün tepkimelerin başlaması için ortamdan enerji alması gerekir. (Hatta tepkimeyi başlatmak gerekli olan bu enerjinin özel bir de adı vardır: “Aktivasyon enerjisi“. Aktivasyon enerjisi bir sonraki ünitenin konusudur.)
- Ekzotermik tepkimeler başlatıldıktan sonra, kendiliğinden devam ederler.
- Endotermik tepkimelerde bu özellik yoktur.


Samed says:
Yapılan çalışmalar emek kokuyor gerçekten ellerinize sağlık
Gökalp AY says:
Teşekkür ederim Samed bey. Beğenmenize çok sevindim.
Emirhan says:
Mükemmel derecede açıklayıcı bir anlatımla hazırlanmış anlatım. Tebrik ve teşekkür ediyorum.
Ahmet buğra says:
Fizik ve biyolojide de böyle bir site yok mu harika çünkü .
Gökalp AY says:
Benim bildiğim bu formatta yok. Üzgünüm.