İçindekiler
Kimya kuralları, tepkime denklemlerinde, aşağıdaki gibi değişiklikler yapmamıza izin verir:
- Tepkimedeki kat sayıları, dilediğimiz gibi genişletebiliriz ya da sadeleştirebiliriz.
- Tepkimeyi ters çevirebiliriz
- İki veya daha fazla tepkimeyi alt alta toplayabiliriz
Tepkime denklemlerinde bu işlemleri yaparsak, tepkime ısısı (ΔHo), bu işlemlerden nasıl etkilenir? İşte bu sorunun cevabının Hess Yasası verir.
Hess Yasası
- Hess Yasası, Germain Henri Hess tarafından ortaya atılmıştır.
- Henri Hess, basamaklı tepkimelerle yaptığı çalışmalar sonucunda, bu yasayı keşfetmiştir.
- Hess Yasası’nın 3 Temel Kuralı vardır. Bunlar şunlardır:
Bu bir reklamdır:
1. Tepkimeler Genişletilirse
- Bir tepkimenin katsayıları, herhangi bir sayı ile çarpılır ya da bölünürse, tepkimenin ΔHo değeri de aynı sayı ile çarpılır ya da bölünür.
Öğretici Örnek:
Örnek olarak, suyun oluşumu (sentezi) tepkimesini alalım. Aşağıda, suyun oluşum tepkimesi ve standart tepkime ısısı değeri verilmiştir:
H2(g) + 1/2O2(g) → H2O(g) ΔHo = -241,8 kj/mol
Yukarıda verilen tepkimenin katsayılarını 2 ile çarparsak, ΔHo değerini de 2 ile çarpmamız gerekir:
2H2(g) + O2(g) → 2H2O(g) ΔHo = -483,6 kj/mol
Bu bir reklamdır:
2. Tepkimeler Ters Çevrilirse
- Bir tepkimede; ürünler ve girenler yer değiştirirse, tepkimenin ΔHo değeri işaret değiştirir.
Öğretici Örnek:
Örnek olarak, suyun oluşumu (sentezi) tepkimesini alalım. Aşağıda, suyun oluşum tepkimesi ve standart tepkime ısısı değeri verilmiştir:
H2(g) + 1/2O2(g) → H2O(g) ΔHo = –241,8 kj/mol
Yukarıda verilen tepkimeyi ters çevirirsek, ΔHo değeri işaret değiştirir.
H2O(g) → H2(g) + 1/2O2(g) ΔHo = +241,8 kj/mol
Bu bir reklamdır:
3. Tepkimeler Alt Alta Toplanırsa
- Tepkimeler; alt alta toplanırsa, tepkimelerin ΔHo değeri de toplanır.
- Bazı tepkimeler, tek seferde geçekleşmez.
- Böyle tepkimelere, “basamaklı tepkimeler” veya “kademeli tepkimeler” veya “mekanizmalı tepkimeler” denir.
- Basamaklı tepkimelerde, basamakların toplamı net tepkimeyi verir.
Önce, tepkimeler nasıl toplanır, onu öğrenelim; sonra, tepkimeler ile birlikte tepkime ısılarını (ΔHo) toplayalım.
Tepkimler Nasıl Toplanır?
- Girenler girenlerle toplanır, ürünler ürünlerle toplanır. Aşağıda bu kuralın bir örneği olarak, iki farklı tepkimenin toplamı verilmiştir.
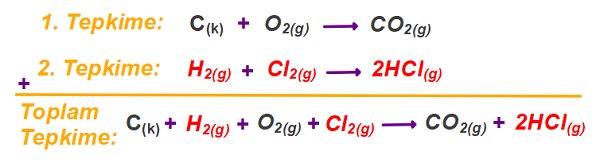
- Bir tepkimenin girenler tarafındaki maddeler, diğer tepkimenin ürünlerindeki maddeler ile sadeleşebilir. Fakat, sadeleştirebilmek için şu şartlar aranır:
- Maddelerin katsayıları eşit olmalı
- Maddelerin fiziksel halleri (katı-sıvı-gaz) aynı olmalı
- Aşağıda; toplanan iki tepkimeye bakarsak, birinci tepkimenin ürünlerinde 1 tane CO2, ikinci tepkimenin de girenlerinde 1 tane CO2 vardır ve bu iki madde toplama işleminde sadeleşir:

- Aynı maddeden, iki tepkimenin zıt taraflarında da var ise fakat; katsayıları eşit değilse, katsayıları arasındaki fark alınır ve toplam tepkimede, katsayısı çok olanın tarafına o maddeden o kadar tane yazılır.

- Yukarıdaki örnekte, CO2‘lerin katsayıları eşit ve zıt taraflarda oldukları için sadeleşmişlerdir.
- Fakat 1. tepkimenin girenlerinde 2 tane O2(g), 2. tepkimenin ürünlerinde ise 1 tane oksijen vardır.
- Yani; 1. tepkimede 1 tane O2(g) fazladır, bu yüzden toplam tepkimenin girenler tarafına 1 tane O2(g) yazılmıştır.
- Fakat 1. tepkimenin girenlerinde 2 tane O2(g), 2. tepkimenin ürünlerinde ise 1 tane oksijen vardır.
- Aynı tarafta olan maddelerin katsayıları toplanır ve bulunan sonuç toplam tepkimede, maddenin katsayısı olarak yazılır.
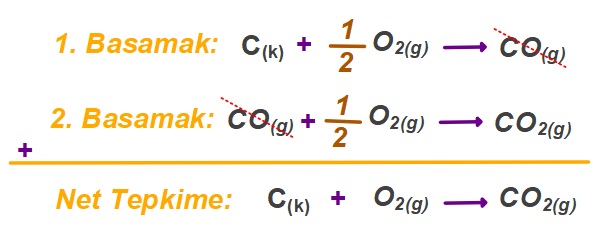
- Yukarıdaki tepkimelerde, CO gazları zıt tarafta olduğundan sadeleşmiş, O2 gazları aynı tarafta olduğundan katsayıları (1/2’ler) toplanmıştır ve net tepkimede, katsayı olarak O2‘nin önüne yazılmıştır (1/2 + 1/2 = 1).
Bu bir reklamdır:
Tepkime Isılarını Tepkimeler ile Birlikte Toplayabiliriz
- Örnek olarak, karbonun (C) katısının yanma tepkimesini ele alalım:
- Karbonun yanması tepkimesi iki basamakta gerçekleşmektedir.
- Aşağıda, bu basamaklar ve tepkime ısısı değerleri verilmiştir:

- Yukarıda, verilen basamakları toplarsak, C katısının yanmasına ait net tepkimeyi ve net tepkimenin tepkime ısısını bulmuş oluruz:

- Hess yasasına ve tepkimelerin toplanmasına dair öğrendiğimiz kuralları gelin örnekler üzerinde uygulayalım.
Örnek:
H2(g) + 1/2O2(g) → H2O(g) ΔHo = -241,8 kj/mol
C(k) + 1/2O2(g) → CO(g) ΔHo = -110,5 kj/mol
Yukarı verilen tepkimelerden yararlanarak aşağıdaki tepkimenin standart entalpi değişimini bulunuz.
C(k) + H2O(g) → CO(g) + H2(g) ΔHo = ? kj/mol
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
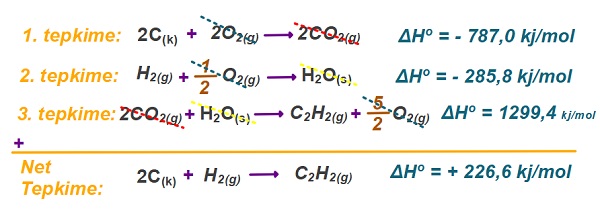
2C(k) + H2(g) → C2H2(g) ΔHo = ? kj/mol
Yukarıda verilen net tepkimenin basamakları şunlardır:
1. Basamak: C(k) + O2(g) → CO2(g) ΔHo = -393,5 kj/mol
2. Basamak: H2(g) + 1/2O2(g) → H2O(s) ΔHo = -285,8 kj/mol
3. Basamak: 2C2H2(g) + 5O2(g) → 4CO2(g) + H2O(s) ΔHo = -2598,8 kj/mol
Buna göre net tepkimenin tepkime ısısı kaçtır?
Örneğin çözümü:
Bu bir reklamdır:

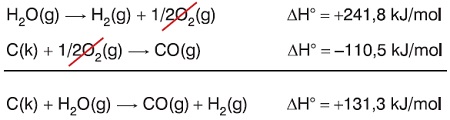

1 yorum: “4. Tepkime Isılarının Toplanabilirliği (Hess Yasası)”