İçindekiler
“Bağ enerjileri“, bir kimyasal tepkimenin, standart entalpisini (ΔHo) hesaplamanın bir diğer yoludur. Gelin, önce “bağ” ve “bağ enerjisi” kavramlarını hakkında bilgi edinelim.
Bağ (Etkileşim)
- “Bağ” demek, “etkileşim” demektir.
- Etkileşimler, kimyasal türleri bir arada tutan çekim kuvvetleridir.
- Bağ enerjileri konusunda, bizi ilgilendiren bağlar; kovalent bağlardır.
- İki ametal atomu arasında kurulan güçlü etkileşimlere kovalent bağ denir.
- Kovalent bağlar, moleküllerin oluşmasını sağlar.
Etkileşimler ile ilgili detaylı bilgi, Kimya 9 dersinde verilmişti. Hatırlamak isteyenler, aşağıdaki bağlantıya tıklayabilir.
Bağ Oluşumu Tepkimeleri
- Bağ oluşması olayı, ekzotermik (enerji veren) bir olaydır.
- İki atom, bir kovalent bağ oluşturduğunda, enerji açığa çıkar.
- Bu yüzden, bağ oluşumunu gösteren tepkimelerin ΔHo (tepkime ısısı) değeri sıfırdan küçüktür.
Aşağıdaki tepkimeler, kovalent bağların oluştuğu tepkimelere örnektir.
2H → H2 ΔHo = -436 kj/mol
2O → O2 ΔHo = -498 kj/mol
2Cl → Cl2 ΔHo = -242 kj/mol
Bağ Kopması Tepkimeleri
- Bağların kopması olayı, endotermik (enerji alan) bir olaydır.
- İki atom arasındaki kovalent bağı koparmak için enerji harcamak gerekir.
- Bu yüzden, bağ oluşumunu gösteren tepkimelerin ΔHo (tepkime ısısı) değeri sıfırdan büyüktür.
Aşağıdaki tepkimelerde, atomlar arasında kovalent bağlar kopmaktadır.
H2 → 2H ΔH = +436 kj/mol
O2 → 2O ΔH = +498 kj/mol
Cl2 → 2Cl ΔH = +242 kj/mol
Bu bir reklamdır:
Bağ (Etkileşim) Enerjisi
1 mol bağı koparmak için gerek enerjiye bağ enerjisi denir.
Bağ enerjileri genellikle, hazır verilir:
- Sorularda, bağ enerjileri, genellikle hazır olarak verilir.
Aşağıdaki tabloda, bir çok kovalent bağın bağ enerjisi verilmiştir.

Bağ enerjisi bazen, tepkimelerde gizlenir:
- Bağ enerjileri hazır verildiği gibi bazen de, kovalent bağın kopması tepkimesine bakarak biz buluruz.
- Standart koşullarda iken, bir bağın koptuğu tepkimenin tepkime ısısı (ΔHo) değeri, aynı zamanda o bağın bağ enerjisi değerine eşittir.
Aşağıda, bazı kovalent bağların kopması tepkimesi verilmiştir:
H—H bağının kopma tepkimesi:
H2 → 2H ΔH = +436 kj/mol
– Tepkimenin, tepkime ısısı değeri +436 kj/mol olarak verilmiştir.
– Bu değer, aynı zamanda H2 molekülündeki H—H bağının bağ enerjisidir.
O=O bağının kopma tepkimesi:
O2 → 2O ΔH = +498 kj/mol
Tepkimesinden anlıyoruz ki, O2 molekülündeki O=O bağının bağ enerjisi, +498 kj/mol’dür.
Cl—Cl bağının kopma tepkimesi:
Cl2 → 2Cl ΔH = +242 kj/mol
Tepkimesinden anlıyoruz ki, Cl2 molekülündeki Cl—Cl bağının bağ enerjisi, +242 kj/mol’dür.
Bağ Enerjileri ile Tepkime Isısını (ΔHo) Bulmak
ΔHo = Girenlerin bağ enerjisi – Ürünlerin bağ enerjisi
- Bağ enerjileri yardımı ile, bir kimyasal tepkimenin, standart tepkime ısısını (ΔHo) bulabiliriz.
- Bağ enerjilerinden tepkime ısısı bulunurken, katsayılar da hesaba katılarak, girenlerdeki bütün bağların enerjileri toplanır, ürünlerdeki bütün bağların enerjileri de toplanır.
- Daha sonra, girenlerin toplam bağ enerjisi, ürünlerden çıkarılır.
Bu bir reklamdır:
Öğretici Örnek:
H2(g) + Cl2(g) → 2HCl(g)
Aşağıda verilen standart bağ enerjileri yardımı ile, yukarıdaki tepkimenin standart tepkime entalpisini (ΔHo) hesaplayınız.
H—H: 436 kj/mol
Cl—Cl: 242 kj/mol
H—Cl: 432 kj/mol
Çözüm:
H2(g) + Cl2(g) → 2HCl(g)
tepkimesindeki bağları daha yakından görelim:![]()
Girenler kısmındaki bağlar:
– 1 tane H—H bağı
– 1 tane Cl—Cl bağı
Ürünler kısmındaki bağlar:
– 2 tane H—Cl bağı
ΔHo = Girenlerin bağ enerjisi – Ürünlerin bağ enerjisi
ΔHo = (H—H + Cl—Cl) – (2.H—Cl)
Soruda verilen bağ enerjilerini, formülde yerlerine yazalım:
ΔHo = (436 + 242) – (2 . 432)
ΔHo = 678 – 864
ΔHo = -186 kj/mol
Cevap: -186 kj/mol
Bu bir reklamdır:
Örnek:
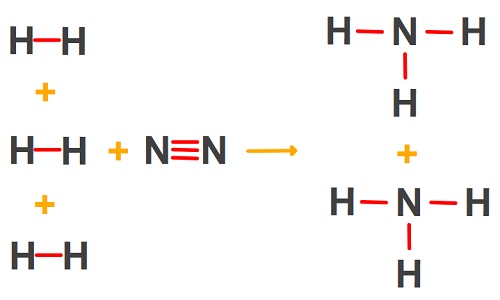
N2(g) + 3H2(g) → 2NH3(g)
Aşağıda verilen standart bağ enerjileri yardımı ile, yukarıdaki tepkimenin standart tepkime entalpisini (ΔHo) hesaplayınız.
H — H: 436 kj/mol
N — H: 391 kj/mol
N ≡ N: 946 kj/mol
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
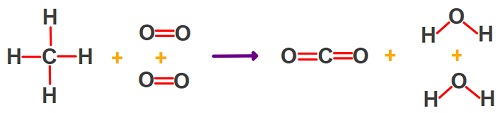
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) ΔHo = -1310 kj/mol
Bazı bağların, standart bağ enerjileri:
O = O : 391 kj/mol
C = O : 946 kj/mol
H — O : 464 kj/mol
Yukarıda ΔHo değeri -1310 kj/mol olan bir kimyasal tepkime ve bu tepkimedeki bazı bağların standart bağ enerjileri verilmiştir.
Buna göre, C-H bağının, standart bağ enerjisini hesaplayınız.


1 yorum: “3. Bağ Enerjileri”