İçindekiler
- Enerji
- Entalpi (H)
- Entalpi Değişimi (ΔH)
- Entalpi Değişimi (ΔH) İçin Bir Benzetme
- Oluşum Entalpisi (ΔHool)
- Standart Tepkime Entalpileri (ΔHo)
- Tepkime Isısının (ΔH) Diğer Adları
- Tepkime Isısı (ΔH) ile Kimyasal Hesaplamalar
- Tepkime Isısı (Tepkime Entalpisi – ΔH) Nelere Bağlıdır?
“Oluşum Entalpisi” kavramını anlayabilmek için, öncelikle “Entalpi” kavramını anlamak gerekir.
“Entalpi” kavramını anlamak için de, “enerji” kavramı hakkında bir fikrimizin olması gerekir. O zaman gelin, önce, enerji kavramını kısaca açıklayalım.
Enerji
- En basit tanımı ile enerji; iş yapabilme kapasitedir.
- Enerjinin; kütlesi, ağırlığı ya da hacmi yada bunun gibi özellikleri yoktur. Bu yüzden enerji elle tutulur, somut bir şey değildir.
- Enerjinin bir çok farklı formu vardır. Bunlar şunlardır:
- Isı enerjisi (Q)
- Bağ Enerjisi
- Entalpi (H)
- Potansiyel Enerji (Ep veya PE)
- Kinetik Enerji (Ek)
- İç Enerji (U)
- Elektrik Enerjisi
- Kimyasal Enerji
- Nükleer Enerji
- Ses enerjisi
- Işık enerjisi
- Manyetik Enerji
- Kimyasal tepkimeler, genellikle, ısı enerjisi, elektrik ya da ışık enerjisi ile gerçekleşir.
Entalpi (H)
- Entalpi, “ısı kapsamı” olarak da adlandırılır.
- Entalpi “H” sembolü ile gösterilen bir büyüklüktür.
- Entalpi (H), bir maddenin depoladığı her türden enerjinin toplamıdır.
- Bir maddenin entalpisini hesaplamak için; atomlarında, atomlarının çekirdeklerinde, elektronlarında, atomların arasındaki bağlarda,… depolanan bütün enerjiyi hesaplayıp, hepsini toplamak gerekir ki bu mümkün değildir.
- Yani; bir maddenin entalpisini (H) hesaplamak mümkün değildir.
Entalpi Değişimi (ΔH)
- Entalpi, her ne kadar ölçülemeyen bir büyüklük olsa da, entalpi değişimi (ΔH), hesaplanabilir.
- Entalpi değişimi “ΔH” ile gösterilir.
- Entalpi değişimi; bir maddenin aldığı ya da verdiği enerjidir.
- Yani, ΔH değeri; maddelerin sahip olduğu enerjiyi değil, enerjilerinin ne kadar arttığını ya da azaldığını gösterir.
Entalpi Değişimi (ΔH) İçin Bir Benzetme
Bu bir reklamdır:
Oluşum Entalpisi (ΔHool)
- 1 mol maddenin, standart koşullarda, elementlerinden oluşması esnasında alınan verilen enerjiye molar oluşum ısısı denir.
- Molar oluşum ısısına, standart koşullarda hesaplandığı için; “standart oluşum ısısı” veya “standart oluşum entalpisi” de denir.
- ΔH: Tepkime ısısı veya tepkime entalpisi demektir.
- ΔHo: Standart koşullarda hesaplanmış tepkime ısısı demektir.
- ΔHool: Standart koşullarda hesaplanan molar oluşum ısısı demektir.
- “ΔHool” ve “ΔHof” aynı şeylerdir.
Standart Koşullar veya Oda Koşulları
- Standart koşullar demek, 25oC sıcaklık ve 1 atm dış basınç demektir.
- Standart koşullara “Oda Koşulları” da denir.
Elementlerin Molar Oluşum Isıları (ΔHool)
- Elementler, en temel maddelerdir ve standart koşullarda, oluşum entalpileri sıfırdır.
- Elementler için: ΔHool = 0 kj/mol
- Elementler standart koşullarda değilse, oluşum ısıları sıfırdan farklıdır.
- Mesela; oksijen elementi (O2), standart koşullarda gaz halindedir. Bu yüzden, oksijen gazının ΔHool değeri sıfırdır:
- O2(g) için ΔHool = 0
- Fakat; oksijen elementinin sıvı ya da katı halinden bahsediyorsak, artık standart koşullardan çıkmışız demektir. Oksijen gazı, katı ya da sıvı hale geçerken enerji verir ve entalpisi azalır, bu yüzden, katı ve sıvı oksijenin oluşum ısıları sıfırdan küçüktür:
- O2(s) için ΔHol < 0
- O2(k) için ΔHol < 0
- Diğer elementlerin de tıpkı oksijen elementi gibi, standart koşullardaki fiziksel halleri için oluşum entalpileri sıfırdır. Mesela Fe (demir) elementinin oluşum ısıları şöyledir:
- Fe(k) = O (Tabiatta katı halde olduğu için)
- Fe(s) > O
- Fe(g) > 0
- Mesela; oksijen elementi (O2), standart koşullarda gaz halindedir. Bu yüzden, oksijen gazının ΔHool değeri sıfırdır:
Elementlerin Allotroplarının “Oluşum Isıları”
- Allotroplar, element atomlarının, faklı şekillerde dizilmesi ile oluşan farklı maddelerdir.
- Bazı allotrop örnekleri şunlardır:
- Oksijenin allotropları: O2 – O3
- Fosfor elementinin allotropları: Beyaz fosfor – Kırmızı fosfor
- Karbon elementinin allotropları: Grafit – Elmas – Fullerenler
- Kükürt elementinin allotropları: Rombik kükürt – Monoklin kükürt
- Allotropların, doğal olanlarının, standart oluşum entalpileri sıfır, diğerlerinin ise sıfırdan farklıdır.
– O2 (Oksijen) ve O3 (Ozon)
- O3 gazının standart oluşum entalpisi sıfırdan büyüktür:
- ΔHool[ozon gazı] > 0
- O2 gazı, doğal bir element olduğu için standart oluşum entalpisi sıfırdır:
- ΔHool[oksijen gazı] = 0
– Grafit ve Elmas
- Grafit ve elmas, karbon elementinin iki allotropudur.
- Grafitin, doğal bir element olduğu için, standart oluşum entalpisi sıfırdır:
- ΔHool[grafit] = 0
- Elmasın, standart oluşum entalpisi sıfırdan büyüktür:
- ΔHool[elmas] > 0
- Grafitin, doğal bir element olduğu için, standart oluşum entalpisi sıfırdır:
Bileşiklerin “Standart Oluşum Entalpileri” (ΔHool)
Bileşiklerin standart oluşum entalpileri; iki farklı şekilde karşımıza çıkar:
I) Bazen, bileşiklerin “standart oluşum entalpileri” hazır olarak verilir:
Aşağıdaki tabloda, birçok bileşiğin ve bazı elementlerin standart şartlarda molar oluşum entalpileri verilmiştir.

II) Bazen de bileşiklerin, elementlerinden oluştuğu tepkimelerine bakarak, biz buluruz:
- Girenler element ise, tepkimenin ΔHo değeri, ürünlerin oluşum ısısına eşittir.
- Bileşikler, elementlerin kimyasal tepkimler ile birleşmesi sonucu oluşur.
Aşağıda, bazı bileşiklerin, elementlerinden oluşum (sentez) tepkimeleri verilmiştir:
- CO2 (Karbon dioksit) gazının standart oluşum tepkimesi:
- C(k) + O2(g) → CO2(g)
- H2O (Dihidrojen monooksit) sıvısının standart oluşum tepkimesi:
- H2(g) + 1/2O2(g) → H2O(s)
- HCl (Hidroklorik asit) gazının standart oluşum tepkimesi:
- H2(g) + Cl2(g) → 2HCl(g)
- Bir bileşiğin, standart koşullarda gerçekleşen oluşum tepkimesinin ΔHo değerini biliyorsak, o bileşiğin standart oluşum entalpisini (ΔHool) biliyoruz demektir; bu iki değer birbirine eşittir. Aşağıda bu kuralın örnekleri verilmiştir:
- CO2 gazının standart oluşum tepkimesine bakarak, ΔHool değerine aşağıdaki gibi karar veririz:
C(k) + O2(g) → CO2(g) ΔHo = -393,5 kj/mol
tepkimesi verilir ise;
CO2(g) için ΔHool = -393,5 kj/mol
- H2O sıvısının standart oluşum tepkimesine bakarak, ΔHool değerine, aşağıdaki gibi karar veririz:
H2(g) + 1/2O2(g) → H2O(s) ΔHo = -285,8 kj/mol tepkimesi verilir ise;
H2O(s) için ΔHool = -285,8 kj/mol olur.
- HCl gazının standart oluşum tepkimesine bakarak, ΔHool değerine, aşağıdaki gibi karar veririz:
H2(g) + Cl2(g) → 2HCl(g) ΔHo = -184,6 kj/mol tepkimesi verilir ise;
2HCl(g) için ΔHool = -184,6 kj/mol olduğundan
HCl(g) için ΔHool = -184,6 / 2 = -92,3 kj/mol
- HCl örneğinden anlaşılıyor ki, oluşum tepkimesinde, bileşiğin katsayısı birden farklı ise, tepkimenin ΔHo değerini, bileşiğin katsayısına bölmemiz gerekiyor. Bu işlemi yaptığımızda ancak, bileşiğin “standart molar oluşum entalpisini” bulmuş oluyoruz.
Bu bir reklamdır:
Standart Tepkime Entalpileri (ΔHo)
- Bir tepkimenin, standart koşullardaki entalpi değişimi için şu isimler kullanılır:
- Standart Tepkime Entalpisi = Tepkime Isısı = ΔHo
- Bir tepkimenin endotermik mi yoksa ekzotermik mi olduğuna karar vermenin yollarından biri de, tepkimenin ΔHo (standart tepkime entalpisi) değerini hesaplamaktır.
- Bir tepkimenin, ΔHo değerini hesaplamak için, ürünlerdeki maddelerin, toplam ΔHool (standart oluşum entalpisi) değerinden, girenlerdeki maddelerin toplam değerleri çıkarılır.
Yani tepkimelerin, Standart Tepkime Entalpisi (ΔHo) formülü şöyledir:
ΔHo = Σ(ΔHool)ürünler – Σ(ΔHool)girenler
(Eşitlikteki “Σ” sembolü “toplam” anlamındadır.)
Yukarıdaki formül kısaca şöyle de yazılabilir:
ΔHo = Ürünler – Girenler
- Tepkimedeki maddelerin katsayıları birden farklı ise, “oluşum entalpileri”, katsayıları ile çarpılır.
- Ürünlerin ve girenlerin toplamı, bu şekilde hesaplanır.
Örnek:
A + 2B → 3C + D
Yukarıda verilen tepkimede, girenlerin ve ürünlerin standart oluşum entalpileri (ΔHool) aşağıda verilmiştir.
ΔHool(A) = 90 kkal/mol
ΔHool(B) = -30 kkal/mol
ΔHool(C) = -40 kkal/mol
ΔHool(D) = 70 kkal/mol
Buna göre bu tepkimenin standart entalpisi (ΔHo) kaçtır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
A + 2B → 3C + D ΔHo = -80 kj/mol
Yukarıda, denklemi ve tepkime ısısı verilen tepkimedeki maddelerin standart oluşum entalpileri (ΔHool) aşağıda verilmiştir.
ΔHool(A) = 90 kkal/mol
ΔHool(B) = -30 kkal/mol
ΔHool(D) = 70 kkal/mol
Buna göre; bu C maddesinin standart oluşum ısısı (ΔHool) kaçtır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Tepkimesindeki maddelerin standart oluşum entalpileri aşağıda verilmiştir.
ΔHool(CH4(g)) = -74,8 kj/mol
ΔHool(CO2(g)) = -393,5 kj/mol
ΔHool(H2O(g)) = -241,8 kj/mol
Buna göre, bu tepkimenin “standart tepkime ısısı” (ΔHo) kaçtır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:

Yukarıdaki grafik, standart koşullarda gerçekleşen bir kimyasal tepkimenin, Potansiyel Enerji – Tepkime Koordinatı (T. K.) grafiğidir.
Bu grafiğe göre, bu tepkimenin ΔHo değeri kaçtır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
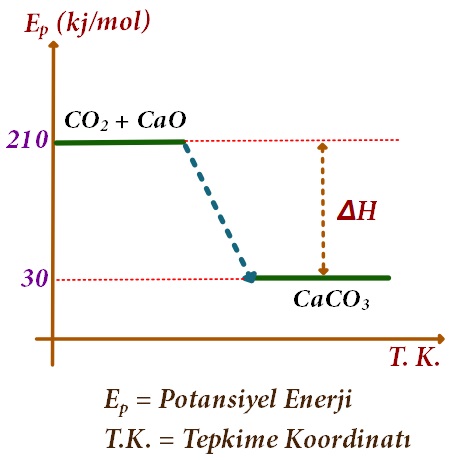
Yukarıda, standart şartlarda çizilmiş, Ep-T.K grafiği verilen tepkime için;
I) Tepkime endotermik bir tepkimedir.
II) Tepkimenin ΔHo değeri -180 kj/mol’dür.
III) Tepkime denklemi şöyledir:
CaO + CO2 → CaCO3 + 180 kj/mol
yargılarından hangileri doğrudur?
A) Yalnız II
B) Yalnız III
C) I ve III
D) II ve III
E) I, II ve III
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Tepkime Isısının (ΔH) Diğer Adları
- Tepkime ısısı (ΔH), tepkimenin türü ile aynı ismi alabilir. Mesela;
- Yanma tepkimelerinin ΔH değerine “Yanma Isısı“
- Nötürleşme tepkimelerinin ΔH değerine “Nötürleşme Isısı“
- Çözünme tepkimelerinin ΔH değerine “Çözünme Isısı” da denir.
- Erime tepkimelerinin ΔH değerine “Erime Isısı” da denir.
- Donma tepkimesinin ΔH değerine “Donma Isısı” denir.
- Buharlaşma tepkimesinin ΔH değerine “Buharlaşma Isısı” denir.
- 1 mol maddenin tepkimesi sırasında alınan/verilen enerji değeri (ΔH) kastediliyorsa “molar” kelimesi kullanılır:
- “Molar Yanma Isısı“: Bir maddenin 1 molünün yanması sırasında açığa çıkan enerjidir.
- “Molar Çözünme Isısı“: Bir maddenin 1 molünün suda çözünme sırasında alınan/verilen enerjidir.
- “Molar Erime Isısı“: Bir maddenin 1 molünün erimesi sırasında alınan/verilen enerjidir.
Örnek:
Aşağıda verilen tepkimelerin tepkime ısılarına (ΔH) verilebilecek adları belirtiniz.
I) 2Ca + O2 → 2CaO
II) H2O(s) → H2O(g)
III) NaOH + HCl → NaCl + H2O
IV) NaCl(k) → Na+(suda) + Cl–(suda)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Tepkime Isısı (ΔH) ile Kimyasal Hesaplamalar
- Tepkime ısısı, tepkimedeki maddeler, katsayılarına eşit mol sayısında iken tepkime verdiğinde alınan veya verilen ısıyı ifade eder.
Öğretici Örnek:
Örnek bir tepkime üzerinden, tepkime ısısını nasıl hesaba katacağımızı anlamaya çalışalım:
2Ca + O2 → 2CaO ΔH = -1200 kj/mol
Yukarıdaki tepkimede ΔH değerinin negatif olması, ısının ürünler kısmında olması demektir:
2Ca + O2 → 2CaO + 1200kj/mol
Bu tepkime bize şunları söylemeye çalışıyor:
– 2 mol Ca yandığında 1200 kj ısı oluşur.
– 1 mol O2 tepkimeye girdiğinde 1200 kj ısı oluşur.
– 2 mol CaO oluştuğunda 1200 kj ısı oluşur.
Bu bir reklamdır:
Tepkime Isısı (Tepkime Entalpisi – ΔH) Nelere Bağlıdır?
Bir tepkimenin, tepkime ısısı (ΔH) şu faktörlerden etkilenir:
- Ortamın ısısı:
- Bir tepkimedeki maddelerin fiziksel halleri değişirse, tepkimenin ΔH değeri de değişir.
- Ortamın ısısı değişirse katılar eriyebilir veya sıvılar kaynayabilir. Sonuçta tepkimedeki maddelerin fiziksel hali değişir.
- Tepkimedeki maddelerin fiziksel hallerini değiştirdiği için, ortamın ısısı, tepkime ısısını değiştirebilir.
- Ortamın basıncı:
- Tıpkı “ortamın ısısı” gibi, basınç da, tepkimedeki maddelerin fiziksel hallerini değiştirdiği için, tepkime ısısını değiştirebilir.
- Madde miktarı:
- Daha çok madde tepkimeye girerse; daha çok ısı alınır veya verilir.
- 1 ton kömür, 1 kilo kömürden daha fazla ısıtır.
Tepkimenin mekanizması (basamak sayısı) değişirse, tepkime ısısı değişmez.
Bu bir reklamdır:

Gedson says:
Allotropun entalpisi için yeterli bilgi yok
Gökalp AY says:
Allotropların oluşum ısısı hakkında bilinmesi gereken tek şey hangisinin sıfır olduğu hangisinin sıfır olmadığıdır. Bunun dışında TYT Kimyası için bilinmesi gereken başka bir bilgi yoktur. Ama allotroplar ile ilgili merak ettiğiniz başka bir şey varsa yardımcı olurum.
Koray says:
Standart koşullar 1 atm 0 C yazılmış bu konu icin 1 atm 25 C olmalıo kısımda ki hatayı düzeltirmisiniz
Gökalp AY says:
Teşekkür ederim düzeltme için 🙂