İçindekiler
Gazlar, sıvıların kaynaması ile oluşan maddelerdir. Atmosferimiz bir gaz karışımıdır. Yaşamak için muhtaç olduğumuz Oksijen elementi (O2), tabiatta gaz halinde bulanan bir maddedir.
Gazların Genel Özellikleri
- Gazların sabit bir hacmi yoktur; içinde bulundukları kabın hacmini kaplarlar.
- Gazların kimyasal türleri arasında büyük boşluklar vardır. Bu boşluklar nedeniyle, gazlar, basınç ile sıkıştırılarak hacmi küçültülebilen maddelerdir. Katı ve sıvılarda bu özellik yoktur.
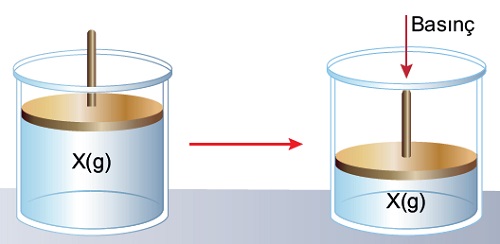
- Gazlar, soğutularak ve sıkıştırılarak sıvılaştırılabilir.
- Gazların karışımları her zaman homojendir.
- Bir maddenin en düşük öz kütleli hali, gaz halidir. (Maddenin en hafif hali gaz halidir.)
- Gazların kimyasal türleri arasında bir etkileşim yok kabul edilir.
- Gazların kimyasal türleri; titreşim, öteleme ve dönme hareketi yaparlar.
- Gazların kimyasal türleri, devamlı hareket halinde halinde oldukları için, kapların kenarlarına çarparak, gaz basıncını meydana getirirler.
- Gazlar, içinde bulundukları kapların her yerine eşit basınç yapar.
- Gazlar, maddenin en düzensiz hâlidir. Yani, kimyasal türlerinin yüksek enerjilerinden dolayı bulundukları ortamdan başka bir ortama kendiliğinden geçebilirler.
- Akışkandırlar. Bulundukları ortamın her yerine yayılırlar.
- Bir maddenin, enerjisinin en yüksek olduğu hali, gaz halidir. Çünkü madde, ısı enerjisi ala ala, katıdan gaza geçmiştir.
Gazları Tanımlayan Özellikler
Bir gazın, ölçülebilen dört temel özelliği vardır. Gazları tarif ederken, bu dört temel özelliği kullanırız. Bunlar şunlardır:
- Basınç (P)
- Miktar
- Hacim (V)
- Sıcaklık (T)
Gelin bu özellikleri yakından inceleyelim.
I) Basınç (P)
Birim yüzeye uygulanan kuvvete basınç denir. Basıncın sembolü P harfidir; birimi atm (atmosfer) veya mmHg (milimetre cıva)’dır.
Gaz tanecikleri, sahip oldukları enerjiden dolayı, devamlı hareket ederler. Devamlı hareket halinde olduklarından, bulundukları kabın iç yüzeyine devamlı çarparlar. Bu çarpmalar sayesinde, gaz kaba bir kuvvet uygulamış olur.
Gaz taneciklerinin birim yüzeye uyguladıkları bu kuvvete gaz basıncı denir. Kapalı bir kapta bulunan her gaz, kabına mutlaka bir basınç yapar.
Aşağıda, su (H2O) moleküllerinin, gaz halinde iken, nasıl hareket ettiği canlandırılmıştır:
Açık Hava Basıncı (P0)
Hava da bir gaz karışımıdır ve her gazın olduğu gibi havanın da bir basıncı vardır. Atmosferimizdeki havanın basıncına “açık hava basıncı” veya “atmosfer basıncı” denir. Açık Hava Basıncı, “P0” veya “Phava” sembolü ile ifade edilir.
İtalyan bilim insanı, E. Torricelli (E. Toriçelli) 1643 yılında yaptığı deneyle açık hava basıncını ölçmüştür. Torricelli, deneyini, Cıva (Hg) sıvısı ile, deniz seviyesinde ve 0 °C sıcaklıkta yapmıştır. Deney sonucunda, açık hava basıncını 760 mmHg (milimetre cıva) olarak hesaplamıştır. Bu basınca, daha sonra, 1 atm (atmosfer) denmiştir.
1 atm = 760 mmHg
1 atm = 76 cmHg
II) Miktar
Gazların miktarı genellikle mol sayısı olarak verilir ya da sorulur. Mol sayısı, gazların kimyasal türlerinin (atom ya da moleküllerinin) sayısıdır.
Mol sayısının sembolü “n” harfidir, birimi de “mol” dür.
Bir gazın 1 mol gelmesi için, kimyasal türlerinin sayısının, Avogadro Sayısı kadar olması gerekmektedir. Avogadro sayısı, pi sayısı gibi özel bir sayıdır ve değeri 6,02×1023‘tür. Avogadro Sayısı “NA” ile gösterilir.
Avogadro Sayısı = NA = 6,02×1023
1 mol He (Helyum) gazında, 6,02×1023 tane He atomu vardır.
1 mol N2 (Azot) gazında, 6,02×1023 tane N2 molekülü vardır.
1 mol NH3 (Amonyak) gazında, 6,02×1023 tane NH3 molekülü vardır.
Mol kavramı konusu, Kimya 10 dersinde daha detaylı olarak işlenecektir.
III) Hacim (V)
Bir maddenin, boşlukta kapladığı yere hacim denir. Hacmin sembolü V harfidir; birimi Litre (L) veya m3 tür.
Gazların hacimleri, kaplarına bağlıdır. Kabının hacmi kaç litre geliyorsa, gazın da hacmi o kadardır. Aynı gazı 1 litrelik bir kaba koyarsak hacmi 1 L olur, 10 Litrelik bir kaba koyarsak hacmi 10 L olur.
Belli koşullarda, belli miktardaki gazların hacimlerini ezbere bilmekte fayda vardır. Örneğin:
Standart koşullar: Basıncı 1 atm, sıcaklığı 25 oC olan gazlar standart koşullarda kabul edilir. Oda koşulları da denir.
Normal koşullar: Basıncı 1 atm, sıcaklığı 0 oC olan gazlar normal koşullarda kabul edilir.
– Standart koşullarda, 1 mol gaz, her zaman, 24,5 L hacim kaplarken
– Normal koşullarda, 1 mol gaz, her zaman, 22,4 L hacim kaplar.
IV) Sıcaklık (T)
Bir gazın davranışını etkileyen önemli özelliklerden biri de sıcaklıktır. Sıcaklık termometre ile ölçülür.
Kelvin cinsinden sıcaklığa mutlak sıcaklık denir ve T harfi ile gösterilir.
Celsius (oC) cinsinden sıcaklık, bizim, günlük hayatta kullandığımız sıcaklıktır ve t harfi ile gösterilir.
Gazlar ile ilgili hesaplar yaparken, sıcaklığını Kelvin cinsinden almamız gerekecektir. Celsius (oC) cinsinden verilen bir sıcaklığı, Kelvin’e çevirmek için aşağıdaki formül kullanılır:
Kelvin (K) = Celcius (oC) + 273
veya
T = t + 273
Sıcaklık, doğrudan, kimyasal türlerin hızı ile ilgilidir. Bir gaz veya bir madde ne kadar sıcaksa, kimyasal türleri de o kadar hızlıdır.
Bir madde ne kadar sıcaksa, maddedeki kimyasal türlerin ortalama kinetik enerjisi o kadar fazladır. Sıcaklıkları eşit olan maddelerde, kimyasal türlerin, ortalama kinetik enerjileri de eşittir.
Saf Maddelerin Hal Değişim Grafiği
Hal değişimleri, bir maddenin, ısı etkisiyle, katı-sıvı-gaz fazlarından birinde iken diğerine geçmesidir.
Saf bir madde, sabit dış basınç altında ve hal değişimi yaşarken, sıcaklığı sabit kalır. Yani, hal değişimine başlarken sıcaklığı kaç derece ise, hal değişimi bitene kadar sıcaklık o değerde kalır. Hal değişimi tamamen bittiğinde, sıcaklık değişmeye devam edebilir.
Saf maddelerin bu özelliği, onları karışımlardan ayırmamızı da sağlar. Sıcaklık-zaman grafiklerinde, saf maddelerin, hal değişimi esnasında, sıcaklık değerleri yatay bir grafik olarak verilmelidir.
Sıcaklık – Zaman Grafiği
Isıtılan saf bir katının sıcaklık-zaman grafiği:
Aşağıdaki grafik, saf bir maddenin, sabit dış basınç altında, katıdan gaza doğru giderken sıcaklığının zamanla nasıl değiştiğini gösterir:
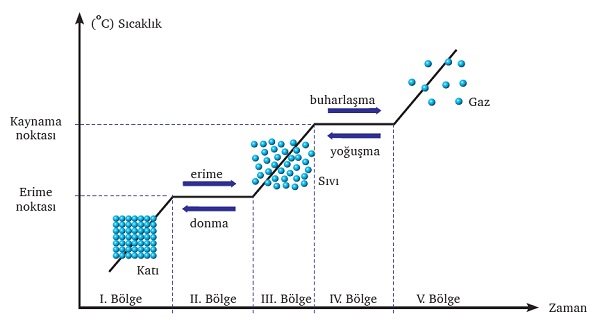
Grafikte sadece sıcaklık ve zaman arasındaki ilişki değil, aynı zamanda katı-sıvı-gaz hallerinde tanecik düzenleri ve hal değişimlerinin isimleri de verilmiştir.
Grafikte, dikkat ederseniz 5 adet bölge vardır. Katı halden başlayıp, gaz haline kadar giden bütün saf maddelerin sıcaklık-zaman grafiklerinde, bu 5 bölge mutlaka oluşur. Bu bölgelerin anlamaları şunlardır:
I. Bölge:
Katı maddeye ısı verdiğinde katının sıcaklığı artar. Sıcaklık arttıkça katı kimyasal türlerin kinetik enerjileri artarak titreşim hareketleri hızlanır. Bu bölgede hâl değişimi gerçekleşmediği için madde homojendir.
II. Bölge:
Düzenli biçimde ısı verilmeye devam edilirse verilen ısı, kimyasal türleri bir arada tutan etkileşimleri zayıflatır. Kimyasal türler daha serbest hareket ederek birbiri üzerinden kayar. Saf maddeler için bu değişimin meydana geldiği sıcaklık maddenin erime noktası olarak adlandırılır. Sıcaklık erime süresince sabittir. Bu bölgede bir miktar katı eridiği için ortamda katı-sıvı karışımı bulunur, madde heterojendir.
III. Bölge:
Katının tamamı eridikten sonra kaynama noktasına kadar sıcaklık tekrar yükselmeye başlar. Verilen ısı sıvının buharlaşmasını sağlarken sıcaklık yükselmeye devam eder. Bu bölgede madde homojendir.
IV. Bölge:
Kaynama noktasına gelince buharlaşma hızlanır. Sıvı tanecikleri arasındaki etkileşimler kopar. Tanecikler daha serbest, hızlı, bağımsız hareket eden gaz tanecikleri hâline gelir. Saf maddeler için bu değişimin gerçekleştiği sıcaklık maddenin kaynama noktası olarak adlandırılır. Sıcaklık kaynama süresince sabittir. Bu bölgede sıvı-gaz bir arada bulunur, madde heterojendir.
V. Bölge:
Sıvının tamamı buharlaştıktan sonra sıcaklık tekrar yükselmeye başlar. Verilen ısı, gazın sıcaklığını yükseltir. Bu bölgede madde homojendir.
Soğutulan saf bir gazın sıcaklık-zaman grafiği:
Yukarıdaki işlemi tersine çevirirsek, yani saf bir gazı soğutursak, bu defa madde gazdan katıya doğru hal değiştirecektir. Aşağıdaki grafik, tam da bu olayın sıcaklık-zaman grafiğidir:
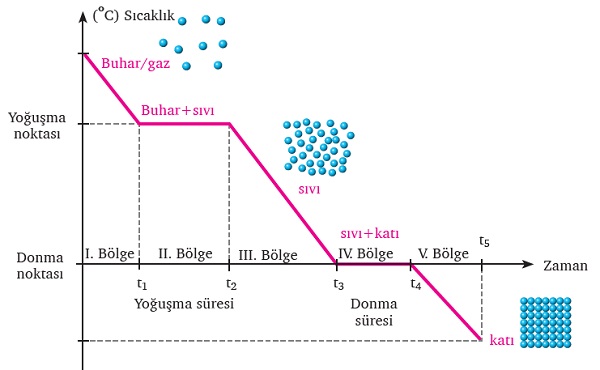
Bu grafikte, sıcaklığın zamanla düştüğüne ve saf maddenin, gaz halinden katıya doğru hal değiştirdiğine dikkat edin.
Grafikteki bölgeler ve anlamları şunlardır:
I. Bölge:
Gaz soğutulursa gaz taneciklerinin sıcaklığı düşer. Sıcaklık düştükçe gaz kimyasal türlerin kinetik enerjileri azalarak hareketleri yavaşlar. Bu bölgede hâl değişimi gerçekleşmediği için madde homojendir.
II. Bölge:
Düzenli biçimde soğutmaya devam edilirse kimyasal türler arasında etkileşimler oluşarak gaz sıvıya dönüşür. Saf maddeler için bu değişimin meydana geldiği sıcaklık yoğuşma noktası olarak adlandırılır ve kaynama sıcaklığına eşittir. Sıcaklık yoğuşma süresince sabittir. Bu bölgede gaz-sıvı karışımı olur, madde heterojendir.
III. Bölge:
Gazın tamamı yoğuştuktan sonra oluşan sıvının sıcaklığı tekrar düşmeye başlar. Bu düşme donma noktasına kadar devam eder. Bu bölgede madde tamamen sıvıdır ve homojendir.
IV. Bölge:
Sıvının kimyasal türleri arasındaki etkileşimler oluşarak türlerin hareketi kısıtlanır. Kimyasal türler, bulunduğu yerde titreşim hareketi yapar. Saf maddeler için bu değişimin gerçekleştiği sıcaklık maddenin donma noktası olarak adlandırılır ve erime sıcaklığına eşittir. Sıcaklık donma süresince sabittir. Bu bölgede sıvı-katı bir arada bulunur, madde heterojendir.
IV. Bölge:
Sıvının tamamı donduktan sonra sıcaklık tekrar düşmeye başlar. Bu bölgede madde tamamen katıdır ve homojendir.

2 yorum “4. Gazlar”