İçindekiler
Katılar, aşağıdaki özellikleri taşırlar:
- Kimyasal türleri en düzenli haldedir.
- Kimyasal türler arasındaki boşluk yok denecek kadar azdır.
- Maddenin en yoğun halidir. (Su, Bizmut, Antimon hariç)
- Kimyasal türler titreşim hareketi yapar.
- Sıkıştırılamazlar.
- Akışkan değildirler.
- Belli bir şekilleri ve hacimleri vardır.
Katıların Sınıflandırılması
- Katılar ikiye ayrılır:
- Amorf Katılar
- Kristal Katılar
- Kristal katılar da kendi içinde 4’e ayrılır:
- İyonik Katılar
- Moleküler Katılar
- Kovalent Katılar
- Metalik Katılar
- Yukarıda yaptığımız sınıflandırma, şöyle bir şema ile de gösterilebilir:

1. Amorf Katılar
- Alışık olduğumuz katıların aksine, amorf katılarda, kimyasal türler gelişigüzel dizilmişlerdir.
- Çevremizdeki bazı amorf katılar şunlardır:
- Cam
- Tereyağı
- Plastik
- Naylon
- Lastik
- Kauçuk
Camsı Geçiş Sıcaklığı
- Amorf katılar, kimyasal türlerindeki düzensizlik yüzünden, sabit bir erime sıcaklığına sahip değillerdir.
- Isıtıldıklarında önce yumuşarlar sonra zamanla sıvı hale geçerler.
- İşte, amorf katıların yumuşamaya başladığı bu sıcaklığa camsı geçiş sıcaklığı denir.
- Camı ısıttığımızda, belli bir sıcaklıkta yumuşamaya başlar ve sıcaklığı arttıkça daha yumuşak bir hale geçer.
- Camın, amorf bir katı olması, ısıtıldığında şekil alabilmesini sağlar.
Örnek:
Cam için aşağıda verilen bilgilerden hangisi doğru değildir?
Cevap
Örnek:
Aşağıda verilen maddelerden hangisinin bir özelliği de camsı geçiş sıcaklığına sahip olmasıdır?
Cevap
Kristal Katılar
- Kristal katıların kimyasal türleri, düzgün bir geometrik şekil oluşturacak şekilde dizilirler.
- Kristal katıların erime sıcaklığı sabittir. Belli bir sıcaklıkta erimeye başlarlar ve erime olayı bitene kadar sıcaklık aynı değerde kalmaya devam eder.
- Doğada gördüğümüz katıların çoğu kristal katılardır.
- Kristal katılar, 4 çeşittir:
- İyonik Katılar
- Moleküler Katılar
- Kovalent Katılar
- Metalik Katılar

1. İyonik Katılar
- İyonik bağlı bileşiklerin katılarıdır.
- İyonik katılarda, bütün iyonlar arasında iyonik bağlar (iyon-iyon etkileşimi) vardır.
- İyonik bağ, en güçlü etkileşimdir. Bu yüzden, iyonik katıların erime noktaları yüksektir.
- İyonik katılar sert ve kırılgandır.
- İletken değillerdir.
- Suda, iyonlarına ayrışarak çözünürler. Bu yüzden iyonal çözeltiler oluştururlar. İyonal çözeltilere, elektriği ilettikleri için elektrolit denir.

İyonik Katı Örnekleri:
- Metal-Ametal bileşikleri iyonik bileşiklerdir.
- İyonik bileşikler katı halde iken, iyonik katılar sınıfına girer.
- Bazı iyonik katılar şunlardır:
- NaCl(k) (Yemek tuzu – Sodyum klorür)
- MgCl2(k) (Magnezyum klorür)
- CaO(k) (Kalsiyum oksit – Sönmemiş kireç)
- CaCO3(k) (Kalsiyum karbonat – Kireç taşı)
- …
2. Moleküler Katılar
- Kovalent bağlı bileşiklerin katı halidir.
- Moleküler katılarda moleküller arasındaki çekim kuvvetleri; Dipol-dipol, London etkileşimleri ve Hidrojen bağları olabilir.
- Bu etkileşimler kovalent ve iyonik çekim kuvvetlerinden daha zayıftır. Bu nedenle moleküler katıların erime ve kaynama noktaları düşüktür.
- Parafin, naftalin gibi bazı moleküler katılar yumuşaktır.
- Isı ve elektriği iletmezler.
Moleküler Katı Örnekleri:
- İyot (I2)
- Kuru buz (CO2(k))
- Naftalin (C10H8)
- Buz (H2O(k))
- Katı NH3 (Amonyak)
- Katı HF (Hidrojen Florür)
3. Kovalent Katılar
- Kovalent katılarda, kovalent bağ, sadece moleküldeki atomlar arasında değil, moleküller arasında da kurulmuştur. Yani, katıdaki bütün atomlar birbirine kovalent bağ ile bağlanmıştır. Bu yüzden bu katılarda, ağ örgülü kovalent bağlar bulunur.
- Ağ örgülü kovalent bağların çok kuvvetli olmaları, bu katıların çok sert ve erime noktalarının çok yüksek olmalarını sağlar.
Kovalent Katı Örnekleri:
- Elmas (C)
- Grafit (C – Kurşun kalemin ucu)
- SiO2 (Silisyum dioksit – Kuvars)
- Si3N4 (Silisyum nitrür)
- SiC (Silisyum karbür)
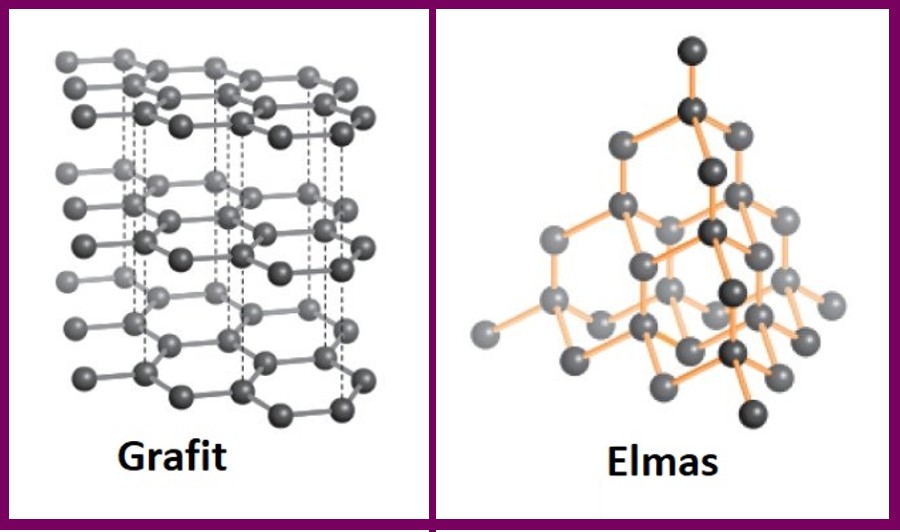
Elmas ve Grafit
- Aynı atomların farklı dizilmesi ile oluşan maddelere allotroplar denir.
- Elmas ve grafit tıpkı kömür gibi karbon atomlarından oluşur.
- Elmas, grafit ve kömürde, tek fark, karbon atomlarının dizilişidir.
- Grafit, kurşun kalemimizin ucudur.
- Elmas, doğada oluşan en sert kimyasaldır.
4. Metalik Katılar
- Metaller, metalik katılardır.
- Metal atomları arasındaki metalik bağ, metallerin katı halde olmasını sağlayan bağdır.
- Metalik bağ sayesinde, metaller:
- Isıyı ve elektrik akımını iletir.
- Tel ve levha haline gelebilir.
- Yüzeyleri parlaktır.
Metalik Katı Örnekleri:
- Çinko (Zn)
- Gümüş (Ag)
- Bakır (Cu)
- Potasyum (K)
- Sodyum (Na)



1 yorum: “2. Katılar”