İçindekiler
Kimyanın Temel Kanunları, çevremizdeki kimyasal olayların kurallarıdır; bize bu olayların nasıl gerçekleştiği hakkında bilgiler verir.
- Çevremizdeki her olayın bir kuralı veya kanunu vardır.
- Araba kullanabilmek için, arabanın nasıl hareket ettirildiğine dair kuralları bilmemiz gerekir.
- Çamaşır makinesinin çalıştırılma kanunlarını bilirsek, çamaşırlarımızı makinede yıkayabiliriz.
- Kısacası, olayların kanunlarını bilmek, bize o olaylar üzerinde kontrol gücü kazandırır.
“Pers kralı olmaktansa bir doğa yasası bulmayı yeğlerim.” (Democritus)
- Kimyasal tepkimelerin gerçekleşme kanunlarını öğrendikten sonra; plastiklerden bombalara, ilaçlardan deterjanlara kadar bir çok madde üretebildik.
- Kimyanın 3 temel kanunu vardır. Bunlar şunlardır:
- Kütlenin Korunumu Kanunu
- Sabit Oranlar Kanunu
- Katlı Oranlar Kanunu
Kanunlara geçmeden önce, karşımıza çok çıkacak bir kavram olan “kütle” kavramını hatırlayalım.
Kütle (m)
- Değişmeyen madde miktarına kütle denir.
- Her maddenin mutlaka bir kütlesi vardır.
- Kütle ağırlık ile çok karıştırılır, fakat bu ikisi farklı şeylerdir.
- Kütlenin sembolü, “m” harfidir.
- Kütlenin birimi gram ve katlarıdır.
- gram: g
- kilogram (kilo): kg
- 1 kg = 1000 g
- 1 ton = 1000 kg
- Kütle, eşit kollu terazi ile ölçülür. Fakat artık, dijital hassas teraziler ile de ölçülebilmektedir. Aşağıda eşit kollu ve hassas teraziler verilmiştir.
Kütle Cümle İçinde Nasıl Kullanılır?
- Aşağıda gördüğünüz ifadeler; maddelerin kütleleri verilirken kullanılan ifadelerdir:
- 5 kg patates
- 200 gram tuzsuz çekirdek
- Yarım kilo ıspanak (0,5 kg ıspanak)
- m = 400 g
- mkarpuz = 6 kilogram
- mx = 58 gram
- mtuz = 150 g
- mH2O = 36 gram
- 2 ton fındık
- 2 gram altın
- m = 0,2 kg
1. Kütlenin Korunumu Kanunu – 1774

- Kanun kime aittir?
- Kütlenin Kronumu Kanunu, Antoine L. Lavoisier (Antonyo Lavozye) tarafından ortaya atılmıştır.
- Kanun ne diyor?
- Bir fiziksel veya kimyasal tepkimede, tepkimeye katılan maddelerin toplam kütlesi oluşan ürünlerin toplam kütlesine eşittir.
mgirenler = mürünler
- Bir fiziksel veya kimyasal tepkimede, tepkimeye katılan maddelerin toplam kütlesi oluşan ürünlerin toplam kütlesine eşittir.
- Kanun nerede geçerlidir?
- Bu kanun, bütün fiziksel ve kimyasal tepkimelerde geçerlidir.
- Kütlenin Korunumu Kanunu, bize, şunu demek istiyor:
- Tepkimelerde, atomlar yok olamaz veya yoktan var olamaz; sadece, dizilişleri değişir.
Sınıftaki öğrencileri birer atom olarak düşünelim. Kimyasal ya da fiziksel tepkimeler, sınıfın oturma düzeninin değişmesi gibidir. Toplam öğrenci sayısı değişmez. Fiziksel ve kimyasal tepkimeye katılan atomları da sınıfın öğrencileri gibi düşünün. Tepkime bittiğinde, atomların dizilişinden başka değişen bir şey olmayacaktır.
- Tepkimelerde, toplam atom sayısı değişmediğinden, toplam kütle de değişmeyecektir. Çünkü;
- Aynı atomlar, farklı dizildiler diye kütleleri değişmez.
- Bu yüzden bütün fiziksel ve kimyasal tepkimeler, kaç gram ile başlamışsa o kadar gram ile biter.
Bu bir reklamdır:
Tepkime Nasıl Bir Şeydir?
Tepkimeler, ilerleyen başlıklarda detaylı olarak görülecektir. Fakat, Kütlenin Korunumu Kanunu anlamak için, tepkimeleri, en azından kabaca tanımak gerekir. O yüzden burada kısa bir tepkime tanıtımı yapmamız gerekiyor.
- Tepkime demek “olay” veya “reaksiyon” demektir.
- Bütün tepkimeler, fiziksel ya da kimyasal bir olaydır.
- Kimyacılar, olayları, kimya dilinde anlatırlar.
- Kimya dilinde, bir olayın anlatılması için tepkime denklemleri kullanılır.
- Tepkime denklemlerinde, her zaman bir tepkime oku (→) vardır.
- Bu okun sağında ve solunda maddeler vardır.
- Tepkime okunun sağında ve solunda birden çok madde varsa, aralarına + işareti konulur. Aşağıda bir kimyasal tepkimesinin denklemi verilmiştir:
HCl + NaOH → NaCl + H2O - Tepkimelerde, okun sol tarafındaki maddelere girenler, sağ tarafındaki maddelere ürünler denir.
Girenler → Ürünler
- Girenler, tepkimeyi gerçekleştiren maddelerdir.
- Ürünler, tepkime bittikten sonraki maddelerdir.
- Bütün tepkimelerde, giren maddeler ürünlere dönüşür.
Örnek:
A + B → C + D
Yukarıdaki tepkimede, tepkimeye girenleri ve ürünleri belirtiniz.
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
A + B → C + D
Yukarıdaki kimyasal tepkimeye 23 gram A maddesi ile 35 gram B maddesi katılmıştır.
Tepkime sonunda 5 gram D maddesi oluştuğuna göre, bu tepkimede kaç gram C oluşmuştur?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Mg + 1/2O2 → MgO
Yukarıdaki tepkime denkleminde, Magnezyum (Mg) metali, havadaki oksijen (O2) gazı ile yanarak, MgO (Magnezyum oksit) bileşiğine dönüşüyor.
Tepkimede 12 gram magnezyumun yanmasından 20 gram magnezyum oksit bileşiği elde ediliyor. Buna göre, bu tepkimde kaç gram oksijen gazı harcanmıştır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Demir (Fe) ile kükürt (S) elementleri aşağıdaki tepkimeye göre FeS (Demir II Sülfür) bileşiğini oluşturur.
Fe + S → Fes
Buna göre, bu tepkimede 21 gram demir ile 12 gram kükürt elementinin tam tepkimesinden en fazla kaç gram demir II sülfür bileşiği oluşur?
Cevap
Örneğin çözümü:
Meraklısına Tepkime Vidyosu
Fe + S → FeS
Yukarıdaki tepkimenin nasıl gerçekleştiğini merak ediyorsanız, aşağıdaki vidyoyu izleyebilirsiniz. Vidyoda, demir ve kükürt tozları karıştırılıyor, karışıma sıcak cam çubuk (cam baget) batırılıyor ve FeS oluşuyor.
Tepkimesi
2. Sabit Oranlar Kanunu – 1799

Gençler; iki şeyin “oranı” demek o iki şeyi birbirine “böleceksiniz” demektir.
- Kanun kime aittir?
- Sabit Oranlar Kanunu, Joseph Proust (Josef Prust) tarafından ortaya atılmıştır.
- Kanun ne diyor?
- Bir bileşikte, bileşiği oluşturan elementlerin kütleleri arasında sabit bir oran vardır.
- Kanun nerede geçerlidir?
- Bu kanun, bütün bileşiklerde geçerlidir.
- Sevgili öğrencilerim, bütün bileşikler sabit oranlar kanununa göre oluşur. Bu yüzden bir soruda bileşik varsa, o soruda sabit oranlar kanunu var demektir.
- Elementlerin sembolleri olur, bileşiklerin formülleri olur. Elementleri sembollerinden, bileşikleri formüllerinden tanırız.
- Bileşiklerde en az 2 tane faklı element birleşmiş olmalıdır. Yani bileşik formüllerinde en az 2 tane elementin sembolü olur. Aşağıda bazı bileşiklerin formülleri verilmiştir:
- H2O : Su
- NaCl : Yemek tuzu veya sodyum klorür
- FeS : Demir-II-sülfür
- CO2 : Karbon dioksit
- Sabit oranlar kanunu, bize, bileşiklerin rastgele oluşmadığını söylüyor. Bileşiğin oluşması için, elementlerin belli bir kütle oranını her zaman koruması gerekir diyor.
- Bileşiklerdeki sabit oran asla değişmez ama genişleyebilir. Çünkü; genişletmek veya sadeleştirmek, oranı değiştirmez.
Elementleri ve bileşikleri Kimya 9 dersinde görmüştük. Hatırlamak için aşağıdaki derslere göz atabilirsiniz:
Öğretici Örnek:
Formülü AB olan bir bileşik olsun ve bileşikteki A elementi ve B elementi arasındaki kütlece sabit oran şöyle olsun:

- Demek ki AB bileşiğinde, A ve B elementleri arasındaki sabit oran; 1 gram A elementi için 2 gram B elementiymiş. Yani bu bileşikte 1 gram A elementi varsa 2 gram B elementi vardır.
- A ve B elementleri arasındaki 1/2 oranını ikiyle genişletirsek orandaki sayılar şöyle olur:

- Demek ki; 2 gram A için 4 gram B elementi gerekirmiş.
- Yanı oranı koruyarak; 10 gram A ile 20 gram B elementi birleşir de diyebiliriz.
Bu bir reklamdır:
Bileşiklerin Sabit Oranının Yorumlanması
- Bazı sorularda, bileşiğe ait sabit oran biz buluruz, bazı sorularda da hazır verilir.
- Bir bileşiğin sabit oranı elimize geçtiğinde, o bileşik ile ilgili bütün kütle (gram) sorularını çözebiliriz.
- Sabit oran:
- Elementlerin birinin kütlesi verildiğinde, diğerini bizim bulabilmemizi sağlar.
- Bileşiğin kütlesi verildiğinde, bileşikteki elementlerin ayrı ayrı kütlelerini bulmamızı sağlar.
- Bileşikteki elementlerin birinin kütlesi verildiğinde bileşiğin kütlesini bulmamızı sağlar.
Nasıl mı? Örneğe dikkat edelim.
Öğretici Örnek:
Mesela; X2Y formülüne sahip bir bileşik olsun. Bileşikteki X elementi ile Y elementi arasındaki kütlece sabit oran şöyle olsun:
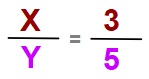
X2Y bileşiği için yukarıda verilen orana bakarak şunları söyleyebiliriz (Tabi bu hesapları orantı kurarak yapıyoruz):
- Bileşikteki X elementi 3 gram ise;
- Y elementi 5 gramdır.
- Bu durumda bileşik toplam 8 gram olur.
- Bileşikteki X elementi 30 gram ise (Oranın 10 katı);
- Y elementi 50 gramdır.
- Bileşik toplam 80 gram olur.
- Bileşikteki X elementi 15 gram ise (Oranın 5 katı);
- Y elementi 25 gramdır.
- Bileşik toplam 40 gram olur.
- Bileşikteki X elementi 1,5 gram ise (Oranın 0,5 katı);
- Y elementi 2,5 gramdır.
- Bileşik toplam 4 gram olur.
- X2Y bileşiği elde etmek için 3 gram X elementi kullanıyorsak;
- Y elementi mutlaka 5 gram olmalıdır.
- 8 gram X2Y bileşiği elde etmek istersek;
- 3 gram X ve
- 5 gram Y elementini tepkimeye sokmalıyız.
- 8 gram X2Y bileşiğinin;
- 3 gramı X elementi,
- 5 gramı Y elementidir.
- 16 gram X2Y bileşiğinin (Oranın 2 katı);
- 6 gramı X elementi,
- 10 gramı Y elementidir.
- 24 gram X2Y bileşiğinin (Oranın 3 katı);
- 9 gramı X elementi,
- 15 gramı Y elementidir.
- 2,4 gram X2Y bileşiğinin (Oranın 0,3 katı);
- 0,9 gramı X elementi,
- 1,5 gramı Y elementidir.
- …
Bileşikteki Sabit Oran Nasıl Hesaplanır?
- Bileşiğin formülü ve formüldeki atomların ağırlıkları verilirse, bileşiğin sabit oranı hesaplanabilir.
- Bileşik formülündeki atomların ağırlıkları, sorunun sonunda ve parantez içinde verilir.
Örnek:
CO2 (Karbon dioksit) bileşiğinde, C (Karbon) ve O (Oksijen) arasındaki sabit oran kaçtır? (C:12, O:16)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
CO2 (Karbon dioksit) bileşiğinde, C (Karbon) elementinin kütlesinin, bileşiğin toplam kütlesine oranı kaçtır? (C:12, O:16)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
36 gram H2O bileşiğinde 4 gram hidrojen (H) vardır.
Bu durumda bu bileşikteki elementlerin sabit oranı kaçtır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Fe2O3 bileşiğinde, kütlece %30 oksijen atomu bulunmaktadır.
Buna göre Fe2O3 bileşiğindeki mFe / mO oranını bulunuz.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
H2O üretmek için hidrojen (H) ve oksijen (O) gazları tepkimeye sokuluyor. Tepkimede 30 gram H elementi kullanılıyor.
Artan olmaması için, oksijenden kaç gram kullanılmalıdır? (H:1, O:16)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
MgO bileşiğinin kütlece %40’ı oksijendir. Buna göre:
a) 18 gram Magnezyum ile kaç gram Oksijenin tepkimeye gireceğini hesaplayınız.
b) 75 g MgO bileşiğinde kaç gram Magnezyum ve Oksijen olur?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
NH3 (Amonyak) bileşiğinde, elementlerin kütlece birleşme oranı H/N = 3/14 tür.
Buna göre, eşit miktardaki azot (N) ve hidrojenden (H) 85 gram Amonyak elde edildiğine göre hangi elementten kaç gram artar?
Cevap
Örneğin çözümü:
Katlı Oranlar Kanunu – 1804

- Kanun kime aittir?
- Katlı Oranlar Kanunu, John Dalton (Con Dalton) tarafından ortaya atılmıştır.
- Kanun ne diyor?
- Aynı iki elementten oluşan, iki farklı bileşikte, elementlerin birinin miktarı eşitken, diğer elementin miktarları arasında katlı bir oran vardır.
- Kanun nerede geçerlidir?
- Bu kanun, bileşik çiftlerinde geçerlidir. Kanuna uymaları için, bileşik çiftlerinin şu özellikleri taşıması gerekir:
- Bileşik çifti, aynı elementlerden oluşmuş olmalıdır.
- Bileşikler 2 elementli bileşikler olmalıdır.
- Bileşiklerin basit (kaba veya sadeleşmiş de denir) formülleri mutlaka farklı olmalıdır (Katlı oran hiç bir zaman 1 çıkamaz.).
- Bu kanun, bileşik çiftlerinde geçerlidir. Kanuna uymaları için, bileşik çiftlerinin şu özellikleri taşıması gerekir:
Örnek:
I) H2O ve CO2
II) H2SO4 ve H2SO3
III) C2H4 ve C3H6
IV) CH4 ve C3H8
Yukarıdaki bileşik çiftlerinden hangileri, Katlı Oranlar Yasasına uyar?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Katlı Oranın Hesaplanması
Katlı Oranlar Yasasına uyan her bileşik çifti arasında bir katlı oran vardır. Peki bu oran nasıl hesaplanır?
- Sevgili öğrencim, Katlı Oran, iki bileşikte de bulunan aynı element için hesaplanır.
- Bileşiklerdeki bir elementin katlı oranı, diğer element sadeleştirilerek hesaplanır.
- Sadeleştirmemiz gereken elementin, her iki bileşikteki sayılarını eşitlemek yeterli oluyor. Gelin yapalım.
Örnek:
CH4 ve C3H8 bileşiklerinde, Karbonlar (C) arasındaki katlı oran kaçtır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
| I. Bileşik | II. Bileşik | |
| Bileşiğin formülü | N2O3 | NO2 |
Yukarıdaki tabloda verilen bileşikler için;
a) Aynı miktarda Oksijen (O) ile birleşen Azotlar (N) arasındaki katlı oran nedir?
b) Aynı miktarda Azot (N) ile birleşen Oksijenler (O) arasındaki katlı oran nedir?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Kütlelerden Katlı Oranı Bulmak
- Katlı Oranlar Yasasında, katlı oranı bulmak için bileşik çiftinin formüllerini bilmek şart değildir.
- Bileşiklerdeki elementlerin kütleleri verilirse de katlı oranı hesaplayabiliriz.
- Bunun için tıpkı atom sayıları için yaptığımız gibi, bir elementin her iki bileşikteki kütlesini eşitleyip diğer elementin katlı oranını buluruz.
Örnek:
Karbon (C) ve Hidrojenden (H) oluşmuş iki farklı bileşik için şu bilgiler veriliyor:
I. Bileşikte, 24 gram C ve 8 gram H vardır.
II. Bileşikte, 36 gram C ve 4 gram H vardır.
Bu bilgilere göre, I. bileşikteki Hidrojenin, II. bileşikteki Hidrojene katlı oranı kaçtır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
24 gram C ve 4 gram H elementleri tamamen birleşerek C2H4 bileşiğini oluşturmaktadır.
Aynı elementlerin oluşturduğu başka bir bileşikte 12 gram C ile 3 gram H elementi birleştiğine göre bu bileşiğin formülü aşağıdakilerden hangisi olur?
A) CH4
B) C3H8
C) C2H6
D) C4H8
E) C3H6
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:

Kükürt (S) ve Oksijen (O) elementlerinin oluşturduğu faklı iki bileşikte, elementlerin birleşen kütleleri grafikte verilmiştir. Grafiğe göre;
a) Aynı miktar Oksijen ile birleşen Kükürt miktarları arasındaki katlı oran nedir?
b) 8 gram Kükürt içeren I. ve II. bileşiklerin kütlelerini hesaplayınız.
Cevap
Örneğin çözümü:
Bu bir reklamdır:




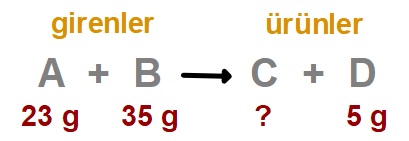
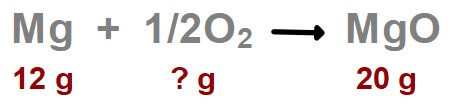


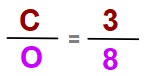

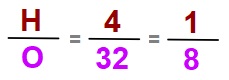



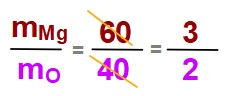





Arda (Hawk) says:
Adam beleş site yapmış daha ne olsun kıymetini bilin <3 Muzaffer Hoca
Adana says:
AJahjskajasdkjjfjaoıajsjdj