İçindekiler
- “Etkileşim” bağ demektir.
- “Çözücü ve Çözünen Etkileşimleri” ise, şekerli su gibi, birbirinde çözünmüş iki maddenin, kimyasal türleri arasında kurulan bağlar demektir.
- Çözeltilerde, çözücü-çözünen arasındaki kurulan etkileşimler “Zayıf Etkileşimlerdir”.
Ünitenin bu bölümünde, çözeltilerin kimyasal türleri arasında kurulan zayıf etkileşimlerden bahsedilecektir.
Bu bölümü anlayabilmek için, Kimya 9 dersine ait olan “Kimyasal Türler Arası Etkileşimler” ünitesinde gördüğümüz;
konularını biliyor olmak gerekir. Aksi taktirde, burada kullandığımız bazı kavramlar kafanızı karıştırabilir.
Zayıf Etkileşimleri Kısaca Hatırlayalım
- Hidrojen Bağı
- Van der Waals Kuvvetleri
- İyon-dipol etkileşimi
- Dipol-dipol etkileşimi
- Dipol-indüklenmiş dipol etkileşimi
- İyon-indüklenmiş dipol etkileşimi
- İndüklenmiş dipol – indüklenmiş dipol etkileşimi (London Kuvvetleri)
- Zayıf etkileşimler olmasaydı, maddeler; katı ya da sıvı halde olamazdı.
- Zayıf etkileşimler olmasaydı maddeler birbirinde çözünemezdi.
- Çünkü; zayıf etkileşimler, maddelerin kimyasal türlerini birbirine bağlar ve bir arada durmalarını sağlar.
Bu bir reklamdır:
Çözeltileri Hatırlayalım
- Çözeltiler, bir maddenin başka bir maddenin her yerine dağılması ile oluşur.
- Bir maddenin diğer maddenin yer yerine dağılmasına çözünme denir.
- Çözünme varsa, bir çözelti oluşmuş demektir.
- Çözeltiler saf olmayan maddelerdir.
- Çözeltiler; homojen karışımlar olarak da adlandırılır.
- Çözeltilerde, miktarı daha çok olan madde çözücü, diğeri çözünendir.
- Belirli ayırt edici özellikleri yoktur.
- Bileşenleri, özelliklerini kaybetmezler.
Çözünme Olayı Fizikseldir
- Çözünme olayında, kırılan ve oluşan bağlar, zayıf etkileşimlerdir.
- Zayıf etkileşimlere fiziksel bağlar da denir.
- Bu yüzden çözünme olayı, fiziksel bir olaydır.
Çözeltiler ve Zayıf Etkileşimler
- Katı veya sıvı haldeki çözeltiler de, bütün katı ve sıvı maddeler gibi, varlıklarını zayıf etkileşimlere borçludur.
- Bu çözeltilerde de, çözünen madde ile çözücünün kimyasal türleri arasında, zayıf etkileşimler kurulur.
Aşağıdaki vidyoda, suda yemek tuzunun çözünmesi canlandırılmıştır:
Aşağıdaki vidyoda, su molekülleri arasında, metanol (soldaki kap) ve etanol (sağdaki kap) moleküllerinin nasıl dağıldığını görüyorsunuz:
Solvatasyon ve Hidratasyon
Aşağıda, hidratlaşmış Na+ ve Cl– iyonlarını görüyorsunuz:

- Çözünen maddenin kimyasal türlerinin etrafının, çözücü tarafından sarılmasına solvatasyon denir.
- Solvatasyon olayında, çözünen madde ile çözücü arasında zayıf etkileşimler kurulur.
- Çözünen maddenin kimyasal türlerinin su molekülleri tarafından sarılmasına hidratasyon ya da hidratlaşma denir.
- Çözücü ile çözünen molekülleri ile kurulan zayıf etkileşimler, kesikli çizgiler ile gösterilmiştir.
Bu bir reklamdır:
Hangi Çözeltilerde Hangi Zayıf Etkileşimler Kurulur?
İyon-Dipol Etkileşimleri ile Oluşan Çözeltiler
- İyonlar ile polar moleküller arasında “iyon-dipol” etkileşimleri kurulur.
- Asitler, bazlar ve tuzlar; suda iyonlarına ayrışarak çözünürler.
- Asit, baz ya da tuzların sulu çözeltilerinde “iyon-dipol” etkileşimleri kurulur.
Dipol-Dipol Etkileşimleri ile Oluşan Çözeltiler
- Polar maddeler arasında oluşan çözeltilerde, çözücü-çözünen arasında dipol-dipol etkileşimleri kurulur.
- “Benzer benzerde iyi çözünür.” prensibi gereği, bu çözeltiler ile çokça karşılaşılır.
- H2O ve H2S arasındaki böyle bir çözelti oluşturur.
Öğretici Örnek:
NaCl bileşiği suda çözünürken, Na+ ve Cl– iyonlarına ayrışarak çözünür. Su molekülleri, bu iyonları teker teker kristallerinden koparır ve etrafını sararak çözer.
Sonuçta, bu iki iyon ile su molekülleri arasında, ayrı ayrı zayıf etkileşimler kurulur. Böylece tuzlu su çözeltisi oluşur.
Yemek tuzu çözeltisinde, tuz iyonları ile su molekülleri arasında iyon-dipol etkileşimleri kurulur.
Tuzun Suda Çözünmesi
Oluşan iyon-dipol etkileşimleri aşağıdaki şekilde, kesik çizgiler ile gösterilmiştir:

Bu bir reklamdır:
Dipol-İndüklenmiş Dipol Etkileşimleri ile Oluşan Çözeltiler
- Polar moleküllere dipoller, apolar moleküller ise indüklenmiş-dipoller de denebilir.
- “Dipol-İndüklenmiş dipol” etkileşimleri; polar bir madde ile apolar bir maddenin oluşturduğu çözeltilerde kurulur.
- “Benzer benzerde iyi çözünür.” kuralı gereği, polar maddeler apolar maddeleri çözmeyi pek sevmezler.
- Bu yüzden böyle çözeltiler ile pek karşılaşılmaz.
İyon-İndüklenmiş Dipol Etkileşimleri ile Oluşan Çözeltiler
- Apolar kimyasal türler ile iyonlar arasında kurulur.
- İyonik bağ kuvveti, iyon-indüklenmiş dipol kuvvetinden daha güçlüdür.
- Bu yüzden, apolar maddelerde iyonal çözünme pek olmaz.
London Etkileşimleri ile Oluşan Çözeltiler
- London etkileşimleri, aslında, “indüklenmiş dipol-indüklenmiş dipol” etkileşimleridir.
- Apolar moleküller, indüklenmiş dipoller oluştururlar.
- Apolar bir çözücüde apolar bir madde çözünürse, bu çözeltilerde, çözücü ile çözünen maddelerin kimyasal türleri arasında, London etkileşimleri kurulur.
- “Benzer benzerde iyi çözünür.” kuralına göre, apolar maddeler apolar maddelerde iyi çözünür.
- Apolar CCl4 (Karbon tetraklorür) sıvısı içinde, apolar I2 (İyot) katısı çözünürse, oluşan çözeltide, CCl4 molekülleri ile I2 molekülleri arasında London kuvvetleri oluşur.
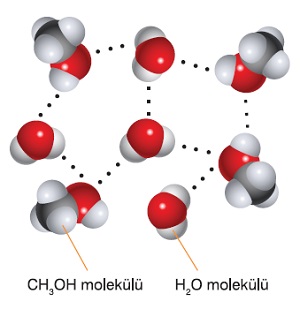
Hidrojen Bağları ile Oluşan Çözeltiler
- F, O, N atomların herhangi biriyle kovalent bağ kuran H atomu, F, O, N atomları içeren moleküllerle H bağı kurabilir.
- Çözücü ile çözünen arasında H-bağı kuruluyorsa, bu maddeler birbirinde çok çözünürler.
- Alkol bileşiklerinin de hidrojen bağı kurma yeteneği vardır, su moleküllerinin de.
- Bu yüzden alkol çözeltilerinde, kimyasal türler arasında hidrojen bağları oluşur.
Aşağıdaki şekilde, hidrojen bağları, kesikli çizgilerle gösterilmiştir:
Bu bir reklamdır:

