Sıvı Çözeltiler ve Çözünürlük → 3. Bölüm
İçindekiler
- 3.Bölüm: Koligatif Özellikler
- Koligatif Özellikler
- Başlıca Koligatif Özellikler
- Başlıca Koligatif Özellikler
- Başlıca Koligatif Özellikler
- Başlıca Koligatif Özellikler
- Başlıca Koligatif Özellikler
- Başlıca Koligatif Özellikler
- Ozmoz ve Ters Ozmoz
- Başlıca Koligatif Özellikler
- Başlıca Koligatif Özellikler
- Başlıca Koligatif Özellikler
- Başlıca Koligatif Özellikler
DERS
AYT Kimya
Kimya 11
KONU
ÜNİTE III
SIVI ÇÖZELTİLER VE ÇÖZÜNÜRLÜK
III. Bölüm
3.Bölüm: Koligatif Özellikler
Dersin Özellikleri:
- Seviye: Hiç Bilmeyenler İçin
- Gerekli Bilgiler:
- Sıvı Çözeltiler ve Çözünürlük – 2. Bölüm
- Öğretmen:
- Muzaffer KAYA
Anlatılacak Başlıklar*:
- Koligatif Özellik Ne Demektir?
- Başlıca Koligatif Özellikler Nelerdir?
- Buhar Basıncı
- Kaynama Noktası
- Donma Noktası
- Ozmotik Basınç
* Konu anlatımı, örneklerle zenginleştirilmiştir.
Koligatif Özellikler
Koligatif Özellik Ne Demektir?
- Koligatif özellik:
- Çözeltilerin derişimine bağlı olarak değişen özelliklerdir.
Başlıca koligatif özellikler:
- Buhar Basıncı
- Kaynama Noktası
- Donma Noktası
- Ozmotik Basınç
Örnek:
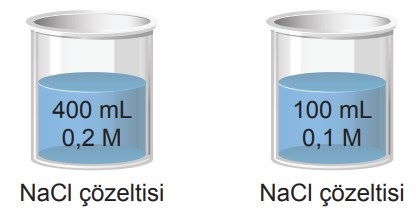
Yukarıdaki çözeltiler aynı ortamdadır.
Bu çözeltilerin hangi özellikleri aynıdır?
A) Buhar Basınçları
B) Kaynama Noktaları
C) Donma Noktaları
D) Ozmotik Basınçları
E) Çözünmüş iyon türleri
Başlıca Koligatif Özellikler
1. Buhar Basıncı (Pb)
- Buhar:
- Sıvılar her sıcaklıkta, yüzeyinden buharlaşır.
- Sıvıyı yüzeyinden terk eden moleküllere buhar denir.
- (Denge) Buhar basıncı:
- Kapalı bir kapta, sabit sıcaklıkta yeterince beklemiş bir sıvının buharının yaptığı basınçtır.
- Buhar basıncı alçalması (Raoult Yasası):
- Saf bir sıvı, çözelti oluşturunca buhar basıncı düşer.
- Yeni buhar basıncı Rault Yasası ile hesaplanır:
Pb = X . P0b
Formülde:
- Pb: Sıvının çözeltide iken buhar basıncı
- P0b: Sıvının saf iken buhar basıncı
- X: Sıvının çözeltideki mol kesri
Örnek:
40 oC’de, 144 gram suda 80 gram NaOH tamamen çözülüyor.
Buna göre oluşan çözeltinin buhar basıncı kaç cmHg’dır?
(40 oC’de saf suyun buhar basıncı 40 cmHg’dır. Na: 23 g/mol, H: 1 g/mol, O: 16 g/mol)
Başlıca Koligatif Özellikler
2. Kaynama Noktası (KN)
- Kaynama:
- Sıvı halden buhar haline geçme olayıdır.
- Kaynama Noktası:
- Sıvının buhar basıncının dış basınca eşit olduğu sıcaklıktır.
- Kaynama Noktası Yükselmesi (Ebülyoskopi):
- Saf bir sıvıda bir tuz çözülürse, kaynama noktası artar.
- Kaynama noktasındaki artış şöyle hesaplanır:

Formülde:
- ΔTk: Sıvının kaynama noktasındaki artış.
- Kk: Ebülyoskopi sabiti
- m: Çözeltinin molalitesi
- i: van Hoff faktörü (çözünenin formülündeki iyon sayısı)
- Mesela NaCl bileşiği için:
- i = 2
- Mesela Ca(NO3)2 bileşiği için:
- i = 3
- Mesela NaCl bileşiği için:
Örnek:
Normal koşullarda, 5000 g suya 290 gram yemek tuzu (NaCl) katılarak tamamen çözülüyor.
Buna göre, oluşan tuz çözeltisinin kaynama noktasını hesaplayınız. (Su için Kk = 0,51 oC/m, Na: 23 g/mol, Cl: 35 g/mol)
Başlıca Koligatif Özellikler
3. Donma Noktası (DN)
- Donma:
- Sıvı halden katı hale geçme olayıdır.
- Donma Noktası:
- Sıvının katı hale geçtiği sıcaklıktır.
- Donma Noktası Alçalması (Kriyoskopi):
- Saf bir sıvıda bir tuz çözülürse, donma noktası düşer.
- Donma noktasındaki düşüş şöyle hesaplanır:

Formülde:
- ΔTd: Sıvının donma noktasındaki düşüş.
- Kd: Kriyoskopi sabiti
- m: Çözeltinin molalitesi
- i: van Hoff faktörü (çözünenin formülündeki iyon sayısı)
Örnek:
Etilen glikol, (C2H4(OH)2) arabaların sularına katılan antifriz sıvısıdır. Normal koşullarda, 2500 g suya 620 gram etilen glikol katılarak tamamen çözülüyor.
Buna göre, oluşan çözeltinin donma noktasını hesaplayınız. (Su için Kd = 1,86 oC/m, C: 12 g/mol, H: 1 g/mol, O: 16 g/mol)
Başlıca Koligatif Özellikler
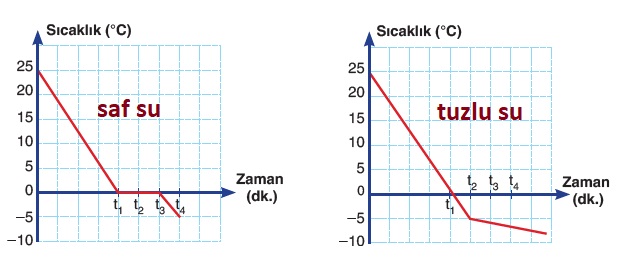
Ebülyoskopi Olayı
- Saf suyun ve doymamış tuzlu suyun kaynama grafikleri:

Kriyoskopi Olayı
- Saf suyun ve doymamış tuzlu suyun donma grafikleri:
Başlıca Koligatif Özellikler
4. Ozmotik Basınç
- Ozmoz:
- Bir maddenin çok yoğun olduğu ortamdan az yoğun olduğu ortama kendiliğinden akmasıdır. (kardeş payı)
- Ozmoz olayı:
- Su, seyreltik çözeltiden derişik çözeltiye doğru kendiliğinden akar.
- Ozmotik basınç:
- Ozmoz olayı sonucu bir seviye farkı oluşur.
- Oluşan bu seviye farkından kaynaklanan sıvı basıncı ozmotik basınçtır.
- Derişim arttıkça ozmotik basınç artar.
- Membran, suyu geçiren tuzu geçirmeyen, yarı geçirgen bir zardır, ozmoz olayı için kullanılır.

Başlıca Koligatif Özellikler
4. Ozmotik Basınç
- Ters Ozmoz:
- Ozmoz olayının tam tersidir. (üvey kardeş payı)
- Kendiliğinden gerçekleşmez, enerji harcanarak gerçekleştirilir.
- Basınç zoru ile gerçekleşir.
- Uygulanan basıncın ozmotik basınçtan yüksek olması gerekir.
- Ters ozmoz; tuzlu deniz suyundan içme suyu eldesinde kullanılır.

Ozmoz ve Ters Ozmoz
Başlıca Koligatif Özellikler
- Erime ve kaynama noktası ile çözeltide bulunan kimyasal türlerin toplam derişimi doğru orantılıdır.
Örnek:

Kaplardaki çözeltiler için
I. Kaynama noktaları
II. Aynı sıcaklıktaki buhar basınçları
III. Çözünen maddenin mol sayıları
niceliklerinden hangisi veya hangileri eşit olur?
A) Yalnız I
B) I ve II
C) I ve III
D) II ve III
E) I , II ve III
Başlıca Koligatif Özellikler
Örnek:
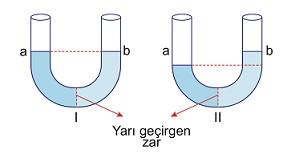
Şekil I’de yarı geçirgen zarla ayrılmış U borusunun a ve b kollarına farklı derişimlerde tuzlu su konulmuştur. Bir süre bekledikten sonra şekil II’deki görüntü oluşmaktadır.
Buna göre şekil I ile ilgili,
I. Osmoz olayı gerçekleşir.
II. b koluna konulan çözelti daha derişiktir.
III. b kolundaki osmotik basınç a kolundakinden daha fazladır.
yargılarından hangileri doğrudur?
A) Yalnız I
B) I ve II
C) II ve III
D) II ve III
E) I, II ve III
Başlıca Koligatif Özellikler
Örnek:
t °C’ta 6,4 gram CH3OH (metil alkol) sıvısı 14,4 gram su ile karıştırılıyor.
Bu sıcaklıkta karışımın buhar basıncı kaç mmHg olur? (C :12, O :16, H :1, P°metil : 80 mmHg, P°su : 24 mmHg)
A) 27,2
B) 32,4
C) 35,2
D) 48,6
E) 68,8
Örnek:
Koligatif özelliklerle ilgili olarak
I. Uçucu olmayan çözünen, saf çözücüye ilave edildiğinde kaynama noktası yükselir.
II. Çözeltideki taneciklerin atom, iyon ya da molekül sayılarına bağlı olarak değişen özelliklere koligatif özellik denir.
III. Çözücü ve çözünen arasındaki çekim gücü arttıkça buhar basıncı azalır.
yargılarından hangileri doğrudur?
A) Yalnız I
B) Yalnız II
C) I ve II
D) II ve III
E) I, II ve III
Başlıca Koligatif Özellikler
Örnek:
Aynı ortamda hazırlanan;
I. 0,6 M KBr
II. 0,5 M Ca(OH)2
III. 0,2 M AlCl3
sulu çözeltilerinin buhar basınçları büyükten küçüğe doğru nasıl sıralanır?
A) I > II > III
B) I > III > II
C) III > II > I
D) III > I > II
E) II > I > III
Örnek:
Hipertonik (hücreden daha derişik) bir çözeltiye bırakılan bir hücrede;
I. Hücre dışına osmoz olur.
II. Hücre plazmolize uğrar (su kaybeder).
III. Hücre içine osmoz olur.
olaylarından hangileri gerçekleşebilir?
A) Yalnız I
B) Yalnız III
C) I ve II
D) II ve III
E) I, II ve III

Sıvı Çözeltiler ve Çözünürlük
III. Bölüm
(Koligatif Özellikler)
Bitti 🙁