İçindekiler
- Denge Tepkimesinin Temel Farkı
- Denge Tepkimesinde Tepkime Oku Farklıdır
- Denge Tepkimelerinin Genel Özellikleri
- Denge Anı
- Fiziksel ve Kimyasal Denge
- Homojen ve Heterojen Denge
- Derişimler Cinsinden Denge Sabiti (Kc)
- Kısmi Basınçlar Cinsinden Denge Sabiti (Kp)
- Kc İle Kp Arasındaki İlişki
- Herhangi Bir Anda Tepkime Yönünün Belirlenmesi – Yalancı Denge Sabiti (Qc)
- Tepkime Denklemi ile Denge Sabiti Arasındaki İlişki
- Soru Tipleri
“Kimyasal Denge” konusu, denge tepkimelerini anlamamızı sağlayan bir konudur.
“Denge Tepkimeleri”, bir çeşit tepkime türü değildir. Tepkimelerin gerçekleşme tarzı ile ilgili bir özelliktir. Yani, her kimyasal tepkime, aynı zamanda bir denge tepkimesi olabilir.
Denge Tepkimesinin Temel Farkı
- Denge tepkimeleri; iki yönde de gerçekleşen tepkimelerdir.
- Bir tepkimenin, iki yönde gerçekleşmesi demek; hem ileri yönde hem de geri yönde gerçekleşmesi demektir.
- Yani; denge tepkimelerinde, girenler ürünlere dönüşürken, aynı anda ürünler de girenlere dönüşür; tepkime çift yönlü gerçekleşir.
BENZETME!
Bir denge tepkimesini anlamak için şöyle bir benzetme yapabiliriz:
Annemizin bize kazak ördüğünü, kardeşimizin de örülen kazağı bir yandan söktüğünü düşünün. Yani bir yandan kazağımız oluşurken ve annemizin yumağındaki ip azalırken, diğer yandan kazağımız sökülmekte ve yumaktan eksilmiş olan ip tekrar geri gelmektedir. İşte bunun gibi, denge tepkimeleri de, bir yandan ürünleri oluştururken, bir yandan da ürünlerin, tepkimeye girerek, girenleri geri oluşturduğu tepkimelerdir.
Denge Tepkimesinde Tepkime Oku Farklıdır
- Bugüne kadar gördüğümüz tepkime denklemlerinde tek yönlü ok kullandık ve tepkimelerin tek yönde gerçekleştiğini kabul ettik.
- Fakat; bir çok kimyasal tepkime, denge tepkimesidir ve çift yönlü gerçekleşir.
- Denge tepkimelerinde tek yönlü ok kullanılmaz.
- Bir kimyasal tepkimenin, denge tepkimesi olduğunu veya tepkimenin dengede olduğunu göstermek için, aşağıda verilen çift yönlü tepkime oklarından herhangi biri kullanılır:
⇄
↔
⇌
- Aşağıda; bazı denge tepkimelerine ait tepkime denklemleri verilmiştir:
- N2(g) + 3H2(g) ⇌ 2NH3(g)
- Ag+(suda) + Cl–(suda) ⇌ AgCl(k)
- 4NO2 + O2 ⇌ 2N2O5
Denge Tepkimelerinin Genel Özellikleri
Denge tepkimelerinin temel özellikler şöyle sıralanabilir:
- Denge tepkimeleri çift yönlü gerçekleşir. Yani; bir denge tepkimesinde hem ileri tepkime gerçekleşir hem de geri tepkime gerçekleşir.
- Denge tepkimeleri hem ileri hem de geri yönde gerçekleştiği için, “tersinir tepkimeler” olarak da adlandırılır.
- Bir tepkimenin, denge kurabilmesi için, kapalı bir sistemde, yani kapalı bir kabın içince gerçekleşmesi gerekir. Açık kaplardaki tepkimelerde denge kurulamaz.
- Denge tepkimelerinde, tepkimeye giren maddeler hiç bir zaman bitmez. Yani, denge tepkimelerinde, tepkime verimi hiç bir zaman %100 olmaz.
- Doğadaki tepkimelerin çoğu tersinir tepkimelerdir.
Öğretici Örnek:
Örnek bir denge tepkimesi ve anlamı şöyledir:
Denge tepkimesi:
H2O(s) ⇌ H2O(g)
- Yukarıdaki tepkime denklemi, suyun buharlaşmasına ait bir denge tepkimesine aittir.
- Tepkimedeki çift yönlü ok, bu tepkimenin tersinir yani hem ileri hem de geri yönde gerçekleştiğini ifade eder:
- İleri tepkimede su, su buharına dönüşür:
H2O(s) → H2O(g) - Geri tepkimede, su buharı suya dönüşür:
H2O(g) → H2O(s)
- İleri tepkimede su, su buharına dönüşür:
- Yani, bu tepkimede, sıvı su (H2O(s)), bir yandan su buharına (H2O(g)) dönüşürken, aynı anda oluşan su buharları da geri dönerek sıvı suya dönüşmektedir.
Denge Anı
- Denge tepkimelerinde, başlangıçta, ileri tepkime daha hızlı, geri tepkime daha yavaştır.
- Zamanla, ileri tepkime yavaşlar; geri tepkime hızlanır.
- Belli bir anda, her iki yöndeki tepkimenin de hızı eşitlenir.
- Bu eşitliğin sağlandığı ana, denge anı denir.
- Aşağıdaki grafikte, bir tepkimenin başlangıçtan itibaren dengeye ulaşmasına kadar geçen sürede, tepkime hızlarının nasıl değiştiği gösterilmiştir.
- Grafikte “tdenge“, denge anını göstermektedir.
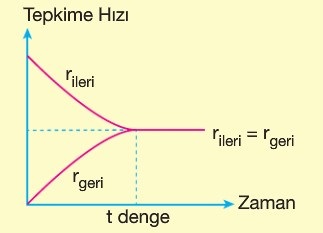
Denge anının temel özellikleri şunlardır:
- Denge anında, ileri tepkimenin hızı ile geri tepkimenin hızı eşitlenmiştir:
- rileri = rgeri
- Denge anında, tepkime dengeye ulaşır ve dışarıdan bir etki gelmediği sürece, tepkime dengesini korur.
- Dengedeki bir tepkime, karşıdan bakıldığında durmuş gibidir.
- Denge kurulduktan sonra, tepkimede, gözle görünen bir olay gerçekleşmez. Ama aslında; tepkime her iki yönde de eşit hızda gerçekleşmeye devam ediyordur.
- Yani; denge anında; makro (görülebilen) olaylar durur, mikro (görülemeyen) olaylar devam eder.
Fiziksel ve Kimyasal Denge
- Denge tepkimesi, fiziksel bir tepkime ise, kurulan denge fiziksel dengedir.
- Fiziksel tepkimeleri hatırlayalım;
- Suda çözünme tepkimeleri
- Çökelme tepkimeleri
- Hal değişim tepkimeleri (erime, donma, kaynama, yoğunlaşma…)
- Denge tepkimesi, kimyasal bir tepkime ise, kurulan denge kimyasal dengedir.
- Kimyasal tepkimeleri hatırlayalım:
- Asit-baz tepkimeleri
- Yanma tepkimeleri
- Metal-asit tepkimeleri
- …
Aşağıda, fiziksel ve kimyasal dengeye örnekler verilmiştir:
- Kimyasal denge örnekleri:
- N2(g) + 3H2(g) ⇌ 2NH3(g)
- 4NO2 + O2 ⇌ 2N2O5
- Fiziksel denge örnekleri:
- H2O(s) ⇌ H2O(g)
- Ag+(suda) + Cl–(suda) ⇌ AgCl(k)
- NaCl(k) ⇌ Na+(suda) + Cl–(suda)
Homojen ve Heterojen Denge
- Dengedeki bir tepkimede, ürünler ve girenler hep birlikte, homojen bir karışım oluşturuyorsa, tepkimeye, “homojen denge tepkimesi” denir.
- Dengedeki bir tepkimede, ürünler ve girenler hep birlikte, heterojen bir karışım oluşturuyorsa, tepkimeye, “heterojen denge tepkimesi” denir.
Homojen ve heterojen denge tepkimelerine karar verirken şu kurallar hatırlanır:
- Gazlar, her zaman homojen bir karışım oluştururlar. Bu yüzden, gazlar arasında gerçekleşen denge tepkimeleri, her zaman homojen denge tepkimeleridir.
- Suda çözünen maddelerin verdiği denge tepkimeleri, homojen denge tepkimeleridir. Bu tepkimelerde, H2O(S) bileşiğinin de olması homojenliği bozmaz.
- Bu saydıklarımızın dışındaki denge tepkimeleri, heterojen denge tepkimeleridir.
Homojen Denge Örnekleri
Aşağıda verilen denge tepkimeleri, homojen denge tepkimeleridir.
- N2(g) + 3H2(g) ⇌ 2NH3(g)
- 4NO2(g) + O2(g) ⇌ 2N2O5(g)
Heterojen Denge Örnekleri
Aşağıda verilen denge tepkimeleri, heterojen denge tepkimeleridir.
- Ag+(suda) + Cl–(suda) ⇌ AgCl(k)
- NaCl(k) ⇌ Na+(suda) + Cl–(suda)
- CaCO3(k) ⇌ CaO(k) + CO2(g)
- H2O(s) ⇌ H2O(g)
Derişimler Cinsinden Denge Sabiti (Kc)
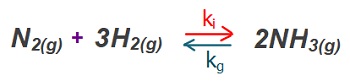
- Her denge tepkimesinin, bir denge sabiti vardır.
- Bir denge tepkimesinin, tepkimedeki maddelerin derişimleri yardımı ile hesaplanan denge sabitine “Kc” denir.
- “Kc“, “Derişimler Cinsinden Denge Sabiti” olarak adlandırılır.
- Kc‘yi hesaplamanın iki yolu vardır:
- İleri ve geri tepkimenin hız sabitlerinden
- Denge bağıntısı ile
1. Hız Sabitleri Yardımı ile Kc’yi Hesaplamak
- Denge tepkimelerinde;
- İleri yöndeki tepkimenin hız sabiti ki
- Geri yöndeki tepkimenin hız sabiti ise kg ile gösterilir.
- Hız sabitleri ile Kc sabiti şöyle hesaplanır:

2. Denge Bağıntısı İle Kc’yi Hesaplamak
- Kc’yi hesaplamak için, ikinci yol, tepkimenin “Denge Bağıntısını” yazmaktır.
- Denge bağıntısı, hız bağıntılarından türemiş bir eşitliktir.
- Denge bağıntısı da, hız bağıntısında olduğu gibi, tepkimeden tepkimeye değişebilmektedir.
- Denge anında, tepkimedeki bütün maddelerin derişimleri sabitlenir.
- Bu yüzden, ürünlerin derişimlerinin, girenlerin derişimlerine oranı da sabit kalacaktır.
- İşte bu orana, denge sabiti (Kc) denir.
- Kc, denge bozulmadığı müddetçe sabit kalır.
- Denge bağıntısı için şablon şöyledir:

- Bağıntıda görülen köşeli parantezler Molarite demektir. Yani;
- [N2] ifadesi N2 maddesinin Molaritesi demektir.
- [NH3] ifadesi NH3 maddesinin Molaritesi demektir.
- [Na+] ifadesi Na+ maddesinin Molaritesi demektir.
- Kc bağıntısını yazmak için yapmamız gereken tek şey; herkesin katsayısını üstüne yazarak, ürünlerin derişimlerinin çarpımını, girenlerin derişimlerinin çarpımına bölmektir.
- Denge bağıntısı, hız bağıntısından elde edildiği için, hız bağıntısına giremeyen maddeler, yani katı ve sıvı haldeki maddeler, denge bağıntısına da giremez.
Örnek:
I) N2(g) + 3H2(g) ⇌ 2NH3(g)
II) 4NO2(g) + O2(g) ⇌ 2N2O5(g)
III) Ag+(suda) + Cl–(suda) ⇌ AgCl(k)
IV) CaCO3(k) ⇌ CaO(k) + CO2(g)
Yukarıda verilen tepkimelerin denge bağıntılarını yazınız.
Cevap
Örneğin çözümü:
Örnek:
N2(g) + 3H2(g) ⇌ 2NH3(g) tepkimesi dengede iken, kapta 4M N2 gazı, 1M H2 gazı ve 3M NH3 gazı vardır.
Buna göre, bu koşullarda, bu tepkimenin Kc değeri kaçtır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
H2(g) + Cl2(g) ⇌ 2HCl(g) Kc = 4
Yukarıdaki tepkime, 20oC’de 2’şer Molar H2 ve Cl2 gazları ile başlamıştır.
Buna göre, bu tepkimedeki maddelerin denge anındaki derişimlerini hesaplayınız.
Cevap
Örneğin çözümü:
Kc Bağıntısının Türetilmesi
- Hız bağıntılarından yola çıkarak, denge bağıntısı yazmayı, aşağıdaki denge tepkimesinin bağıntısını yazarak anlamaya çalışalım:
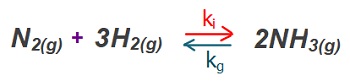
- Bir denge tepkimesinin Kc değeri şuna eşittir:

- Bir denge tepkimesinde, ileri yön demek, denklemin yazıldığı yön demektir.
- Yukarıdaki denklemde, ileri tepkime ve hız bağıntısı şöyledir:
- İleri tepkimenin denklemi şöyledir:

- İleri tepkimenin hız bağıntısı:
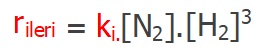
(ki = ileri tepkimenin hız sabitidir.)
- İleri tepkimenin denklemi şöyledir:
- Geri tepkime ve hız bağıntısı da şöyle bulunur:
- Geri tepkimenin denklemi şöyledir:

- Geri tepkimenin hız bağıntısı:

(kg = Geri tepkimenin hız sabitidir.)
- Geri tepkimenin denklemi şöyledir:
- Tepkime, dengeye ulaştığında; ileri ve geri tepkimelerin hızları eşit olur:
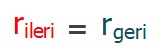
- Her iki hız bağıntısının eşitini yerine yazarsak:
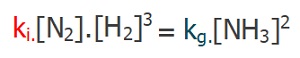
- Hız sabitlerini bir tarafa toplarsak:
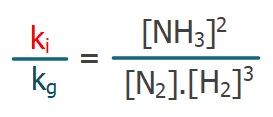
- Bu eşitliğin her iki tarafı da Kc değerini verir:

veya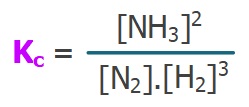
- Her iki hız bağıntısının eşitini yerine yazarsak:
Kısmi Basınçlar Cinsinden Denge Sabiti (Kp)
Denge anında ve sonrasında, tepkimedeki bütün madde miktarları sabitlenir demiştik. Buradan anlıyoruz ki; denge tepkimesinde, gaz halinde bulunan madde ve maddeler varsa, bu maddelerin kısmi basınçları da sabitlenir. Kp sabiti, denge kurulduktan sonra, bu gazların kısmi basınçları yardımı ile hesaplanan denge sabitidir.
- Kp; tepkimedeki gazların kısmi basınçları (P) ile hesaplanan bir denge sabitidir.
- Kp bağıntısına, gaz olmayan maddeler giremez.
- Kp bağıntısı aşağıdaki şablon ile hesaplanır:

Örnek:
I) 2NH3(g) ⇌ N2(g) + 3H2(g)
II) 4NO2(g) + O2(g) ⇌ 2N2O5(g)
III) CaCO3(k) ⇌ CaO(k) + CO2(g)
IV) 2A(suda) + 3B(g) ⇌ 2C(suda) + D(s)
Yukarıda verilen tepkimelerin, kısmi basınçlar cinsinden denge bağıntılarını (Kp) yazınız.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Kc İle Kp Arasındaki İlişki
Gaz fazında gerçekleşen tepkimelerde, Kp ve Kc sabitleri arasında, aşağıdaki gibi bir eşitlik vardır:
Kp = Kc . (R.T)Δn
Formüldeki sembollerin anlamı şöyledir:
- Kp : Kısmi basınçlar cinsinden denge sabiti
- Kc : Derişimler cinsinden denge sabiti
- R : İdeal gaz sabiti

- T: Mutlak sıcaklık
- T = t + 273
- Δn = Ürünlerdeki gazların toplam katsayısı – Girenlerdeki gazların toplam katsayısı
Örnek:
I) N2(g) + 3H2(g) ⇌ 2NH3(g)
II) C3H8(g) + 5O2(g) ⇌ 3CO2(g) + 4H2O(g)
III) H2(g) + Cl2(g) ⇌ 2HCl(g)
Yukarda verilen tepkimelerin Kp ve Kc değerleri arasındaki eşitliği bulunuz.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Herhangi Bir Anda Tepkime Yönünün Belirlenmesi – Yalancı Denge Sabiti (Qc)
- Bir denge tepkimesinin, herhangi bir anda, dengede olup olmadığını bilemiyorsak, bunu anlamanın bir yolu vardır.
- Bunun için, yapmamız gereken; o anda, tepkimedeki maddelerin derişimlerini hesaplamak ve denge bağıntısında bu derişimleri yerine yazmaktır.
- Kısaca, Kc bağıntısına göre, dengenin kurulduğundan emin olmadığımız bir anda hesaplanan değere Qc denir.
- Yani; tepkimenin dengeye ulaştığından emin değilsek hesapladığımız sabite Qc, eminsek Kc diyoruz.
- İkisini de Kc bağıntısı ile hesaplıyoruz.
- Tepkime başladıktan sonraki her hangi bir anda hesaplanan Qc değeri, tepkimenin denge sabiti ile yani Kc ile karşılaştırılır.
- Bu karşılaştırma ile denge durumu hakkında, bir yorum yapılabilir.
- Aşağıda bu işin nasıl olduğu verilmiştir:
- Qc = Kc olursa: Tepkime dengededir.
- Qc > Kc olursa: Tepkime ürünlere fazla gitmiştir; geri yönde, yani girenler yönünde (geri yönde) ilerleyerek dengeye ulaşır.
- Qc < Kc olursa: Tepkime, yeterince ürün oluşturamamıştır ve ürünler lehine (ileri yönde) devam ederek dengeye ulaşır.
Örnek:
N2O4(g) ⇌ 2NO2(g)
Yukarıda verilen tepkimenin, belirli bir sıcaklıkta, Kc değeri 5,1 olarak veriliyor. Aynı sıcaklıkta, tepkime kabına, 2M N2O4 gazı ile 4M NO2 gazı konuluyor.
Buna göre, bu tepkimenin yönü için ne söylenebilir?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Tepkime Denklemi ile Denge Sabiti Arasındaki İlişki
- Bir denge tepkimesini ters çevirirsek, ya da genişletirsek… denge sabiti bu işlemlerden etkilenir. Nasıl mı? Şöyle:
- Bir tepkimenin katsayıları herhangi bir sayı ile genişletilirse, bu sayı ile Kc değerinin üssü alınır.
Aşağıda örnekle, bu kuralı anlamaya çalışalım:- N2(g) + 3H2(g) ⇌ 2NH3(g) Kc = 5
tepkimesinin katsayıları 2 ile genişletilirse, Kc değerinin 2. üssü (karesi) alınır:
2N2(g) + 6H2(g) ⇌ 4NH3(g) Kc = 52 = 25
- N2(g) + 3H2(g) ⇌ 2NH3(g) Kc = 5
- Bir denge tepkimesi, ters çevrilirse, denge sabitinde, pay ile payda yer değiştirir, yani, denge sabitinin çarpmaya göre tersi alınır.
Aşağıdaki örnekle, bu kuralı anlamaya alışalım:- N2(g) + 3H2(g) ⇌ 2NH3(g) Kc = 5
tepkimesi ters çevrilirse, Kc değerinin çarpmaya göre tersi alınır:
2NH3(g) ⇌ N2(g) + 3H2(g) Kc = 1/5
- N2(g) + 3H2(g) ⇌ 2NH3(g) Kc = 5
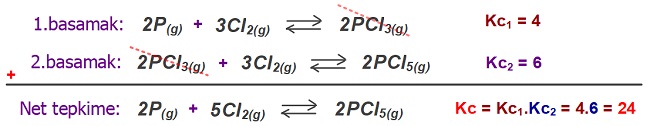
- Tepkimeler toplanırsa, Kc değerleri çarpılır.
Aşağıdaki örnekle, bu kuralı anlamaya alışalım:
Örnek:
N2(g) + 3H2(g) ⇌ 2NH3(g) Kc = 16
Yukarıda verilen tepkime ile aynı koşullarda gerçekleşen aşağıdaki tepkimenin Kc değerini hesaplayınız.
NH3(g) ⇌ 1/2N2(g) + 3/2H2(g)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Soru Tipleri
Örnek:
H2(g) + Cl2(g) ⇌ 2HCl(g)
Belli bir sıcaklıkta, 1L’lik bir kapta, yukarıdaki tepkimeye göre, 0,1 mol H2 gazı ile 0,1 mol Cl2 ve 0,6 mol HCl maddeleri dengededir.
Buna göre, bu tepkimenin Kc değeri kaçtır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
2SO2(g) + O2(g) ⇌ 2SO3(g)
Belirli bir sıcaklıkta, yukarıdaki denge tepkimesine göre; 0,4 atm basınçlı SO2, 0,2 atm O2 ve 0,8 atm SO3 gazları dengededir.
Buna göre, bu şartlarda, bu tepkimenin Kp değeri kaçtır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
PCl3(g) + Cl2(g) ⇌ PCl5(g)
Belirli bir sıcaklıkta, 2 L’lik kapalı bir kaba, yukarıdaki tepkime için, 1,4 mol PCl3 ve 1,4 mol Cl2 gazları konuluyor. Tepkime dengeye ulaştığında, kapta 0,6 mol PCl5 gazı ölçülüyor.
Buna göre bu koşullarda, bu tepkimenin Kc değeri kaçtır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
N2(g) + 3H2(g) ⇌ 2NH3(g) Kc
Yukarıda verilen denge tepkimesinin Kc değerinin birimini nedir?
Cevap
Örneğin çözümü:
Örnek:
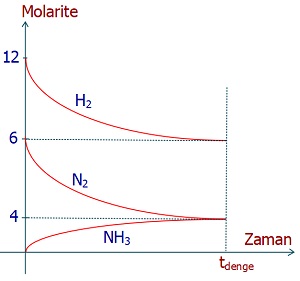
Yukardaki grafik, belli bir sıcaklıkta gerçekleşen, aşağıdaki denge tepkimesine aittir:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Buna göre, bu sıcaklıkta, bu tepkimenin denge sabiti Kc kaçtır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:


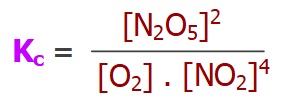
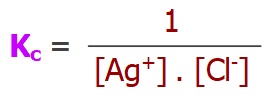


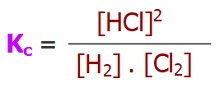

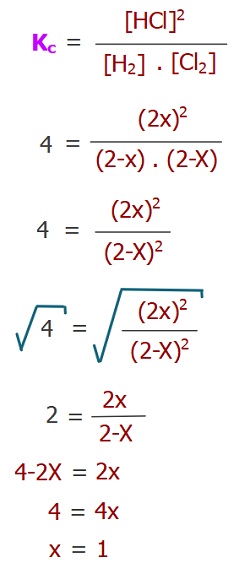

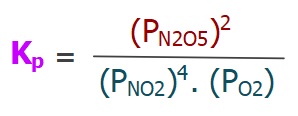
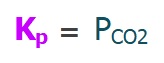


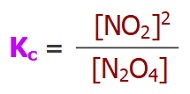
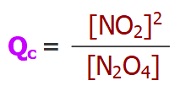







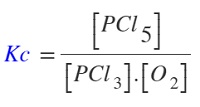
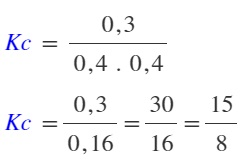


Sılanur says:
ellerinize emeğinize sağlık çok çok güzel olmuş. cidden teşekkürler ihtiyacım olan şeyi anladım.❤️❤️
rahman akı says:
katılıyorum