İçindekiler
- Suyun Oto-İyonizasyonu
- Brønsted-Lowry Asitleri ve Bazları
- Konjuge Asit-Baz Çifti
- Asit ve Baz Gibi Davranan İyonlar (Hidroliz)
- Kuvvetli Asitler ve Bazlar
- Zayıf Asitler ve Bazlar
- Tampon Çözeltiler
- Tuzların Asidik Bazik Karakterleri
- Titrasyon
- Çözünme-Çökelme Dengeleri
- Tuzların Çözünürlüğüne Etki Eden Faktörler
Bir çok kimyasal tepkime, suyun içinde gerçekleşir. Bu tepkimelere denge tepkimeleri de dahildir. “Sulu Çözelti Dengeleri” dendiğinde kastedilen şey, suyun içinde gerçekleşen denge tepkimeleridir.
“Sulu Çözelti Dengeleri“ne geçemeden önce, suyun kendisi hakkında bilmemiz gereken bazı şeyler var. Gelin, bunları öğrenelim.
Suyun Oto-İyonizasyonu
H2O(s) ⇌ H+(suda) + OH–(suda)
- Yukarıdaki tepkime, suyun oto-iyonizasyon tepkimesidir.
- Bu tepkimede, su, molekülleri H+ ve OH– iyonlarına ayrışır.
- Bu olay, yaklaşık, 10 milyon su molekülünden 1 tanesinde gerçekleşir.
- Suyun oto-iyonizasyon tepkimesi şöyle de gösterilir:
2H2O(s) ⇌ H3O+(suda) + OH–(suda)
- OH– iyonuna “hidroksil” veya “hidroksit” denir.
- H3O+ iyonu, “Hidronyum” adında bir kök iyondur ve H+ yerine kullanılabilir.
Ksu (Suyun Oto-İyonizsayon Sabiti)
- Her denge tepkimesi gibi, suyun oto-iyonizasyon tepkimesinin de bir denge sabiti vardır.
- Suyun oto-iyonizasyon tepkimesinin denge sabitine “Ksu” denir.
- Ksu sonuçta bir denge sabitidir ve denge sabitleri ile ilgili bütün kurallar Ksu için de geçerlidir.
- Denge bağıntısında katı ve sıvılar yer almadığı için, suyun oto-iyonizasyonu tepkimesine bakarak, Ksu bağıntısını şöyle yazarız:
H2O(s) ⇌ H+(suda) + OH–(suda)
Ksu = [H+][OH–]
- Ksu değeri, standart koşullarda 10-14 olarak hesaplanmıştır.
(Standart koşullara oda koşulları da denir ve bu koşullarda, sıcaklık 25oC, basınç 1 atm’dir.) - Standart koşullardaki bir saf suda her zaman:
- H+ ve OH– iyonlarının sayısı, mol sayısı ve derişimi eşittir.
- [H+] = 10-7M
- [OH–] = 10-7M
- [H+][OH–] = 10-7.10-7 = 10-14
- Ksu = 10-14
- Standart koşullardaki bütün sulu çözeltilerde her zaman:
- Ksu = [H+][OH–] = 10-14
Örnek:
Standart koşullardaki saf su için aşağıdakilerden hangisi doğru değildir?
A) Sıcaklığı 25oC’dir.
B) Bütün su molekülleri, [H+] ve [OH–] iyonlarına ayrışmıştır.
C) [H+] ve [OH–] iyonlarının derişimi 10-7‘şer Molardır.
D) Oto-iyonizsayon dengesinin denge sabiti Ksu = 10-14 ‘tür.
E) [H+] ve [OH–] iyonlarının derişimlerinin çarpımına Ksu denir.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
25oC’de, bir tuz ruhu çözeltisindeki H+ derişimi, 2.10-2 M olarak hesaplanıyor.
Buna göre, bu çözeltideki OH– derişimi kaç molardır?
A) 5.10-13
B) 5.1013
C) 10-14
D) 10-7
E) 10-13
Cevap
Örneğin çözümü:
Bu bir reklamdır:
pH ve pOH Kavramı

- pH kavramı, bir sulu çözeltideki H+ iyonlarının molaritesini ifade etmenin başka bir yoludur.
- pH değeri, sulu çözeltideki H+ iyonlarının derişimi yardımı ile hesaplanır.
- pOH kavramı da aynı şekilde, OH– iyonlarının derişimini vermenin başka bir yoldur.
- pOH değeri, sulu çözeltideki OH– iyonlarının derişimi yardımı ile hesaplanır.
pH ve pOH Nasıl Hesaplanır?
- pH şöyle hesaplanır:
- pH = -log[H+]
- pOH şöyle hesaplanır:
- pOH = -log[OH–]
- pH ve pOH değerlerinden H+ ve OH– derişimini bulmanın pratik bir yolu:
- [H+] = 10-pH
- [OH–] = 10-pOH
- Saf suda veya bütün sulu çözeltilerde, mutlaka hem H+ hem de OH– iyonu vardır.
- Bu yüzden, bütün sulu çözeltilerin bir pH değerleri bir de pOH değerleri vardır.
Saf Suda pH ve pOH Değerleri
- Standart koşullardaki saf suda, aşağıdaki bilgileri vermiştik:
- Ksu = [H+][OH–] = 10-14
- [H+] = 10-7M
- [OH–] = 10-7M
- Saf suyun pH değeri:
- pH = -log[H+]
- pH = -log10-7
- pH = 7
- Saf suyun pOH değeri:
- pOH = -log[OH–]
- pOH = -log10-7
- pOH = 7
pH ve pOH Arasındaki İlişki
- Standart koşullarda, pH ve pOH toplamı her zaman 14 eder.
pH + pOH = 14
- İspatı: Standart koşullarda, saf su ve bütün sulu çözeltiler için Ksu değeri aynıdır ve 10-14‘e eşittir.
- O zaman, bu koşullardaki Ksu değeri ile şöyle bir hesap yapabiliriz:
Ksu = [H+][OH–]
Ksu değerini yerine kolayım:
10-14 = [H+][OH–]
Her iki tarafın da -log değerini alalım:
-log(10-14) = -log([H+][OH–])
14 = – log[H+] – log[OH–]
14 = pH + pOH
- O zaman, bu koşullardaki Ksu değeri ile şöyle bir hesap yapabiliriz:
Asit ve Baz Çözeltilerinde pH ve pOH Değerleri

Asit çözeltileri için şu bilgiler her zaman doğrudur:
- Bir sulu çözeltinin asit çözeltisi veya asidik bir çözelti olmasının tek sebebi çözeltideki H+ sayısının OH– sayısından fazla olmasıdır.
- Bu durumda, standart koşullardaki bir asit çözeltisi için şu bilgiler her zaman doğrudur:
- [H+] > [OH–]
- [H+] > 10-7M
- [OH–] < 10-7M
- pH < 7
- pOH > 7
- [H+].[OH–] = 10-14
- pH + pOH = 14
Baz çözeltileri için şu bilgiler her zaman doğrudur:
- Bir sulu çözeltinin baz çözeltisi veya bazik bir çözelti olmasının tek sebebi çözeltideki OH– sayısının H+ sayısından fazla olmasıdır. Bu durumda, standart koşullardaki bir baz çözeltisi için şu bilgiler her zaman doğrudur:
- [OH–] > [H+]
- [OH–] > 10-7M
- [H+] < 10-7M
- pOH < 7
- pH > 7
- [H+].[OH–] = 10-14
- pH + pOH = 14
Bir asit ile bir baz birlikte çözülerek, nötür bir çözelti elde edilebilir. Nötür çözeltilerin pH ve pOH değerleri, H+ ve OH– derişimleri saf sudaki gibidir.
Bu bir reklamdır:
Brønsted-Lowry Asitleri ve Bazları

- Asit-bazlar ile ilgili ilk tanımı, 1884 yılında, İsveçli kimyacı Stante Arrhenius yapmıştır.
Arrhenius Asit-Baz Tanımı
- Arrhenius’a göre asit ve bazlar şöyledir:
- Asit: Suya H+ iyonu verebilen bileşiklere asit denir.
- Baz: Suya OH– iyonu verebilen bileşiklere baz denir.
Örnek:
Arrhenius’a göre, suya H+ iyonu verebilen maddeler asit, OH– iyonu verebilen maddeler ise bazdır.
I) HCl(s) → H+(suda) + Cl–(suda)
II) NaOH(k) → Na+(suda) + OH–(suda)
III) HClO4(s) → H+(suda) + ClO4–(suda)
IV) Ca(OH)2(k) → Ca2+(suda) + 2OH–(suda)
Buna göre, yukarıda verilen çözünme tepkimelere bakarak, aşağıdakilerden hangisini söylemek doğru olmaz?
A) HCl bir asittir.
B) NaOH suda iyonlarına ayrışarak çözünmüştür.
C) HClO4 bir bazdır.
D) Ca(OH)2 katısı bir baz bileşiğidir.
E) Asitler ve bazların sulu çözeltileri elektrik akımını iletir.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
- Arrhenius asit baz tanımı, bir çok maddenin asidik ve bazik karakterini belirlemede eksik kalmıştır.
Brønsted-Lowry Asit-Baz Tanımı
- Brønsted-Lowry asit-baz tanımı şöyledir:
- Asit: Suya H+ iyonu verebilen bileşiklere asit dendiği gibi, OH– iyonunu alabilen bileşiklere de asit denir.
- Baz: Suya OH– iyonu verebilen bileşiklere baz dendiği gibi, H+ iyonu alabilen bileşiklere de baz denir.
Öğretici Örnek:
Brønsted-Lowry tanımına göre aşağıdaki tepkimeyi inceleyelim:
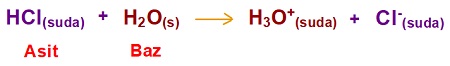
- Tepkimede, HCl bileşiği, bir proton (H+ iyonu) vermiş ve Cl– iyonuna dönüşmüştür. Bu yüzden HCl bileşiği bir asittir.
- H2O bileşiği, bir proton (H+ iyonu) almış ve H3O+ iyonuna dönüşmüştür. Bu yüzden H2O bileşiği, bu tepkimede bazik özellik göstermiştir.
Bu bir reklamdır:
Öğretici Örnek:
Brønsted-Lowry tanımına göre aşağıdaki tepkimeye de bakalım:
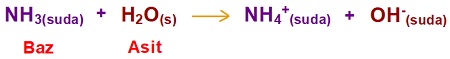
- Tepkimede, NH3 bileşiği, bir proton (H+ iyonu) almış ve NH4+ iyonuna dönüşmüştür. Bu yüzden NH3 bileşiği bir bazdır.
- H2O bileşiği, bir proton (H+ iyonu) vermiş ve OH– iyonuna dönüşmüştür. Bu yüzden H2O bileşiği, bu tepkimede asidik özellik göstermiştir.
Dikkatiniz çekmiştir, H2O bileşiği asitler çözeltilerinde baz gibi, baz çözeltilerinde ise asit gibi davranıyor.
H2O bileşiği gibi, hem asidik hem de bazik özellik gösteren maddelere amfoter maddeler denir.
Konjuge Asit-Baz Çifti
- Konjuge asit-baz çiftleri, genellikle bir asit ya da bazın suda çözünme tepkimesinde aranır. Bu tür tepkimelerde:
- Girenlerdeki asitten ürünlerdeki bir baz oluşur.
- Girenlerdeki bazdan ise ürünlerdeki bir asit oluşur.
- İşte bu şekilde oluşan asit ile oluşturan baza konjuge asit-baz çifti denir.
- Bu şekilde oluşan baz ile oluşturan aside, konjuge asit-baz çifti denir.
- Konjuge asit-baz çiftlerinin biri girenlerde diğeri de ürünlerdedir.
- Konjuge asit-baz çiftlerini tanımanın bir yolu da şudur:
- Konjuge asit-baz çiftlerinin formülleri birbirine çok yakındır.
- Aralarındaki fark, H atomudur.
- Birinde bir tane H atomu ya fazladır ya da eksiktir.
- Konjuge Asit-Baz Çifti örnekleri:
- HCl ile Cl–
- H2O ile H+
- NH3 ile NH4+
- H2O ile OH–
Öğretici Örnek:
Aşağıdaki tepkimede, konjuge asit-baz çiftleri gösterilmiştir:

Bu bir reklamdır:
- Konjuge asit-baz çiftlerini tanımanın diğer yolu da şudur:
- Brønsted-Lowry tanımına göre tepkimenin girenlerindeki asit ve baz tespit edilir.
- Aynı şekilde tepkime tersinden düşünülür ve ürünlerdeki asit ve baz bulunur.
- Sonra; girenlerdeki asit ile ürünlerdeki baz; girenlerdeki baz ile ürünlerdeki asit eşleştirilir.
Öğretici Örnek:
Aşağıdaki tepkimede, konjuge asit-baz çiftleri gösterilmiştir:

Aşağıda, bazı konjuge asit-baz çiftleri verilmiştir:
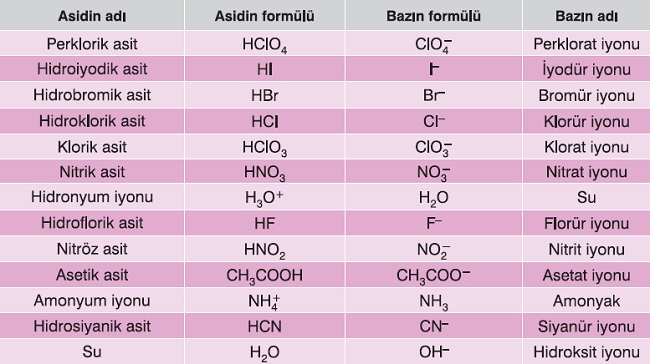
Asit ve Baz Gibi Davranan İyonlar (Hidroliz)

- Yukarıda görüldüğü gibi, bazı iyonlar, suda bir asit ya da bazmış gibi çözünebilirler.
- Bu iyonlar, suya; asit ve bazların yaptığı gibi, H+ (H3O+) veya OH– iyonları verirler.
- Bir iyonun suda, bir asit ya da baz gibi çözünmesine hidroliz denir.
- Hidroliz tepkimeleri, denge tepkimeleridir.
- Hidroliz tepkimelerinin denge sabilerine Khidroliz denir ve kısaca Kh şeklinde gösterilir.
- Brønsted-Lowry tanımına göre düşünürsek, hidroliz olayında:
- H+ alan veya OH– veren iyonlar bazdır.
- H+ veren veya OH– alan iyonlar ise asittir.
Öğretici Örnek:

Yukarıdaki tepkimede, NH4+ (Amonyum) iyonu, suya bir H+ iyonu vermiş ve NH3 iyonuna dönüşmüştür. Bu yüzden NH4+ iyonu asidik bir iyondur.
Bu bir reklamdır:
Öğretici Örnek:
Aşağıda, asidik özellik gösteren bir iyonun tepkimesi verilmiştir:

Yukarıdaki tepkimede, CH3COO– (Asetat) iyonu, sudan bir tane H+ iyonu almış ve CH3COOH (Asetik asit) bileşiğine dönüşmüştür. H+ iyonu aldığı için asetat iyonu bir bazdır.
Kuvvetli Asitler ve Bazlar
- Kuvvetli asit ve bazlar, suda %100 iyonlarına ayrışırlar.
- Zayıf asit ve bazlarda ise durum böyle değildir.
- Kuvvetli asit ve bazların suda çözünme tepkimeleri tek yönlüdür, yani; denge tepkimesi değildir.
Aşağıda bazı kuvvetli asit ve bazların suda çözünme tepkimeleri verilmiştir:
HCl(s) → H+(suda) + Cl–(suda)
NaOH(k) → Na+(suda) + OH–(suda)
HClO4(s) → H+(suda) + ClO4–(suda)
Ca(OH)2(k) → Ca2+(suda) + 2OH–(suda)
Kuvvetli Asitler
Kuvvetli asitler, aşağıda listelenen asitlerdir:
- HCl : Hidroklorik asit (Hidrojen klorür)
- HBr : Hidrobromik asit (Hidrojen bromür)
- HI: Hidroiyodik asit (Hidrojen iyodür)
- HNO3 : Nitrik asit (Kezzap)
- H2SO4 : Sülfürik asit (Akü asidi veya zaç yağı)
- HClO4 : Perklorat asidi
Bu listenin dışında kalan asitler zayıf asitlerdir.
Kuvvetli Bazlar
- 1A ve 2A grubu metallerinin oluşturduğu bazların bir kaç istisna hariç kuvvetli bazlardır.
- 1A Metelleri: Li, Na, K, Rb, Cs, Fr
- 2A Metalleri: Be, Mg, Ca, Sr, Ba, Ra
- Bazı kuvvetli bazlar şunlardır:
- LiOH: Lityum hidroksit
- NaOH: Sodyum hidroksit
- KOH: Potasyum hidroksit
- Ca(OH)2: Kalsiyum hidroksit
- Ba(OH)2: Baryum hidroksit
Kuvvetli Asit ve Baz Çözeltilerinde pH ve pOH
- Kuvvetli asit ve bazlar, suda %100 iyonlarına ayrışırlar. Yani, çözünme tepkimeleri tek yönlüdür.
- Kuvvetli asit-baz çözeltilerindeki H+ veya OH– iyonlarının derişimleri tespit etmenin iki yolu vardır. Bunlar:
- Çözünme tepkimesi yardımı ile iyon derişimi
- Formülü yardımı ile iyon derişimi
1. Çözünme Tepkimesi İle İyon Derişimini Bulma
- Suda gerçekleşen her tepkime gibi, kuvvetli bir asit ya da bazın çözünme tepkimesinde de katsayıların oranı, derişim oranlarını verir.
Öğretici Örnek:
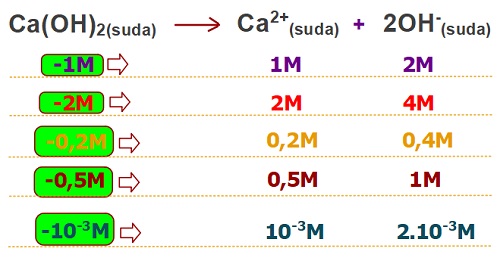
Örnek olarak, bir kuvvetli baz olan Ca(OH)2 bazının çözünme tepkimesini ele alalım:
Ca(OH)2(suda) → Ca2+(suda) + 2OH–(suda)
- Tepkimeye baktığımızda;
- Ca(OH)2 bileşiğinin katsayısı 1
- Ca2+ iyonunun katsayısı 1
- OH– iyonunun katsayısı 2
- Katsayıların kendisi değil, aralarındaki oran önemlidir. Yani; bu katsayılar bize şunu demek istiyor:
- Çözünen Ca(OH)2 derişimi ile suya verdiği Ca+2 iyonu derişimi eşittir.
- Suya verilen OH– iyon derişimi, çözünen Ca(OH)2 derişiminin 2 katıdır.
- Suya verilen OH– derişimi, Ca2+ derişiminin 2 katıdır.
Aşağıda, farklı derişimlerinde, Ca(OH)2(suda) çözeltisindeki iyonların derişimleri verilmiştir. Maddelerin derişimlerinin, katsayıları ile doğru orantılı olduğuna dikkat ediniz:
Bu bir reklamdır:
2. Formülüne Bakarak İyon Derişimi Bulma
- Kuvvetli bir asit veya baz çözeltisinin derişimi biliniyorsa, formüle bakarak, çözeltideki iyon derişimini görebiliriz.
- Formüldeki bir iyonun sayısı ile çözünen bileşiğin (çözeltinin) derişimi çarpılarak, o iyonun derişimi bulunabilir.
Öğretici Örnek:
- Ba(OH)2 kuvvetli bir bazdır.
- Formülünde, 1 tane Ba(OH)2 bileşiğinde, 1 tane Ba2+ iyonu ve 2 tane OH– iyonu vardır. Bu yüzden:
- Çözeltideki Ba2+ iyonu derişimi, çözeltinin derimi ile aynıdır.
- Çözeltideki OH– iyonlarının derişimini bulmak için, çözelti derişimi 2 ile çarpılır.
- Ba(OH)2 çözeltisi için şu hesaplamalar her zaman doğrudur:
- 1MBa(OH)2 çözeltisinde:
- 1x2 = 2M OH– iyonu vardır.
- 1x1 = 1M Ba2+ iyonu vadır.
- 3MBa(OH)2 çözeltisinde:
- 3x2 = 6M OH– iyonu vardır.
- 3x1 = 3M Ba2+ iyonu vadır.
- 2.10-2MBa(OH)2 çözeltisinde:
- 2.10-2 x 1 = 4.10-2M Ba2+ iyonu vardır.
- 2.10-2 x 2 = 4.10-2M OH– iyonu vardır.
- 1MBa(OH)2 çözeltisinde:
Bu bir reklamdır:
- Kuvvetli asit ve bazların sulu çözeltilerinde, H+ veya OH– iyonlarının derişimini bulduktan sonra bu çözeltilerin pH ve pOH değerleri hesaplanabilir.
Örnek:
0,1M HCl çözeltisinin, standart koşullardaki pH değerini hesaplayınız.
A) 1
B) 2
C) 3
D) 4
E) 5
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
5.10-3M Ba(OH)2 çözeltisinin, standart koşullardaki pH değerini hesaplayınız.
A) 9
B) 10
C) 11
D) 12
E) 13
Cevap
Örneğin çözümü:
Zayıf Asitler ve Bazlar
- Zayıf asit ve bazları tanımanın yolu, kuvvetli asit ve bazları bilmekten geçer.
- Çünkü, yüzlerce zayıf asit ve baz varken, kuvvetli olanların sayısı çok azdır.
- Bir asit veya baz, biraz önce verdiğimiz kuvvetli asit ve bazlar listesinde yoksa, zayıftır diyebiliriz.
- Bazı zayıf asitler:
- CH3COOH: Asetik asit (sirke asidi)
- H2CO3: Karbonik asit
- H3PO4: Fosforik asit
- HCOOH: Formik asit
- Bazı zayıf bazlar:
- NH3: Amonyak
- C2H5NH2: Etilamin
- Zayıf asit ve bazların kuvvetli asitlerden en önemli farkı, suda çözünürken, çok düşük bir oranda iyonlarına ayrışabilmeleri, daha çok moleküler olarak çözünmeleridir.
Zayıf Asit-Bazların Suda İyonlaşma Dengeleri
- Bir çok zayıf asit ve baz, suda çok iyi çözünür, fakat; kuvvetli asit-bazların aksine, suda daha çok moleküler olarak çözünürler.
- Bir fikir vermesi açısından şöyle bir oran verelim:
- Suda çözünen her 100 zayıf asit/baz molekülünden yaklaşık 99 tanesi moleküler olarak, 1 tanesi iyonlarına ayrışarak çözünür.
- Bu yüzden, zayıf asit ve bazların, suda iyonlarına ayrışma tepkimesi, molekülleri ile iyonları arsında kurulan bir denge tepkimesidir.
- Bir fikir vermesi açısından şöyle bir oran verelim:
Öğretici Örnek:
- Bir zayıf baz olan NH3 bazının suda çözünme tepkimesi şöyledir:
- NH3(suda) + H2O(s) ⇌ NH4+(suda) + OH–(suda)
- Zayıf bir asit olan CH3COOH asidinin suda çözünme tepkimesi şöyledir:
- CH3COOH(suda) + H2O(s) ⇌ CH3COO–(suda) + H3O+(suda)
- Aynı tepkime şöyle de yazılabilir:
- CH3COOH(suda) ⇌ CH3COO–(suda) + H+(suda)
Bu bir reklamdır:
Ka Sabiti (Asitlik Sabiti)
- Zayıf bir asidin, suda iyonlaşma dengesine ait, derişimler cinsinden denge sabitine Ka denir.
- Ka sabiti de bir çeşit Kc sabitidir.
- Ka bağıntısı, Kc bağıntısının kurallarına göre yazılır.

Ka bağıntısında da tıpkı Kc bağıntısında olduğu gibi, katı ve sıvılar yer alamaz.
Bazı Zayıf Asitlerin Ka Değerleri
- Zayıf asitler suya çok düşük oranda iyon verirler.
- Bu yüzden Ka sabitleri, küçük sayılardır.
Aşağıda, bazı asitlerin, 25oC’deki Ka değerleri verilmiştir.
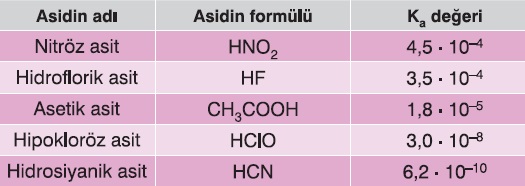
Bazı Zayıf Asitlerin Ka Bağıntıları
- Aşağıda, bir zayıf asit olan HF asidinin, suda iyonlarına ayrışma dengesi ve Ka sabitinin bağıntısı verilmiştir:
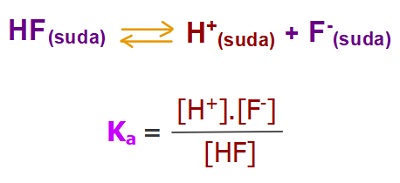
- Aşağıda, bir zayıf asit olan CH3COOH (asetik asit) asidinin, suda iyonlarına ayrışma dengesi ve Ka sabitinin bağıntısı verilmiştir:

Kb (Bazlık Sabiti)
- Zayıf bir bazın, suda iyonlaşma tepkimesine ait, derişimler cinsinden denge sabitine Kb denir.
- Kb sabiti de bir çeşit Kc sabitidir.
- Kb bağıntısı, Kc bağıntısının kurallarına göre yazılır.

Kb bağıntısında da tıpkı Kc bağıntısında olduğu gibi, katı ve sıvılar yer alamaz.
Bazı Zayıf Bazların Kb Değerleri
- Zayıf bazların moleküllerinin, iyonlarına ayrışma oranı çok düşüktür. Bu yüzden Kb sabitleri, küçük sayılardır.
Aşağıda bazı zayıf bazların, 25oC’deki Kb değerleri verilmiştir:

Bazı Zayıf Bazların Kb Bağıntıları
- Aşağıda, bir zayıf baz olan NH3 bazının, suda iyonlarına ayrışma dengesi ve Kb sabitinin bağıntısı verilmiştir:

- Aşağıda, bir zayıf baz olan C2H3NH2 (etil amin) bazının, suda iyonlarına ayrışma dengesi ve Kb sabitinin bağıntısı verilmiştir:
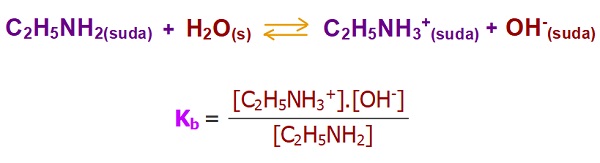
Bu bir reklamdır:
Zayıf Asit-Bazlarda İyonlaşma Yüzdesi
- Zayıf asitler ve bazların suda iyi çözünseler de çok az iyonlaştığını öğrenmiştik.
- Suda çözünen zayıf asit ya da baz moleküllerinin genelde %1 gibi çok az bir kısmı iyonlarına ayrışmayı tercih eder, diğerleri molekül halinde çözünür.
- Suda çözünen bir zayıf asit veya bazın, iyonlarına ayrışma yüzdesine iyonlaşma yüzdesi denir.
- İyonlaşma yüzdesini hesaplamak için;
- çözeltinin derişimi ve
- zayıf asit veya bazın suya verdiği H+ veya OH– iyonlarının derişimi yeterlidir.
- Buna göre; zayıf asit veya bazların iyonlaşma yüzdesi şöyle hesaplanır:

- Çözeltilerdeki, H+ ve OH– derişimi bilinmiyorsa, Ka ve Kb sabitleri yardımı ile bu iyonların derişimleri hesaplanabilir. Bu şekilde, asit ve bazların iyonlaşma yüzdeleri bulunabilir.
- İyonlaşma yüzdeleri bilinen asit veya bazların, Ka ve Kb sabitleri de hesaplanabilir.
Aşağıdaki örnekte de göreceksiniz, iyonlaşma yüzdesi hesaplarken, bu formüle ihtiyacımız yok aslında, basit bir orantı ile hesaplamak da gayet mümkün.
Örnek:
Standart koşullarda HF asidinin Ka sabiti 4.10-5 olarak veriliyor.
Buna göre bu koşullarda 0,1M HF asidinin iyonlaşma yüzdesi kaçtır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Belli bir sıcaklıkta, 0,2M NH3 bazının sulu çözeltisinde, iyonlaşma yüzdesi %0,5 olarak ölçülüyor.
Buna göre bu koşullarda, NH3 bazının Kb sabiti kaçtır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Zayıf Asit-Bazlarda pH ve pOH
HF(suda) ⇌ H+(suda) + F–(suda)
NH3(suda) + H2O(s) ⇌ NH4+(suda) + OH–(suda)
- Zayıf asit veya baz bileşiğinin sudaki iyonlaşma tepkimesine bakılır.
- Yukarıdakiler gibi; asit veya baz, suya 1 tane H+ veya 1 tane OH– iyonu veriyorsa (katsayı yoksa 1’dir), aşağıdaki formüller kullanılır.
- Tek hidrojenli, zayıf asit çözeltisindeki H+ molaritesi şu formülle bulunabilir:

- Tek hidroksilli, zayıf baz çözeltisindeki OH+ molaritesi şu formülle bulunabilir:
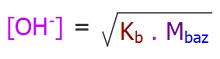
- Tek hidrojenli, zayıf asit çözeltisindeki H+ molaritesi şu formülle bulunabilir:
- Formüllerdeki;
- Ka: Asitlik sabiti
- Masit: Asit çözeltisinin Molaritesi
- Kb: Bazlık sabiti
- Mbaz: Baz çözeltisinin Molaritesidir.
Örnek:
Standart koşullarda, 0,25M HF çözeltisinin pH değerini hesaplayınız. (Standart koşullarda HF için Ka = 4.10-4)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Standart koşullarda, 0,4M NH3 çözeltisinin pH değerini hesaplayınız. (Standart koşullarda NH3 için Kb = 10-5, log(2) = 0,3)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Tampon Çözeltiler
- Bir zayıf asit ile bu asidin tuzu, beraber çözünürlerse, asidik bir tampon çözelti oluşur.
- Asidik bir tampon çözeltisinde, H+ iyonlarının derişimi şu formülle bulunur:

- Asidik bir tampon çözeltisinde, H+ iyonlarının derişimi şu formülle bulunur:
- Bir zayıf baz ile, bu bazın tuzu, beraber çözünürlerse, bazik bir tampon çözelti oluşur.
- Bazik bir tampon çözeltisinde, OH– iyonlarının derişimi şu formülle bulunur:
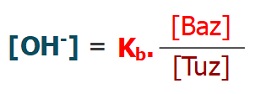
- Bazik bir tampon çözeltisinde, OH– iyonlarının derişimi şu formülle bulunur:
- Zayıf asilerin tuzunu tanımak için tuzun formülüne bakılır.
- Tuzun formülü ile asidin formülünde ortak bir iyon varsa, o tuz ve o asidin tuzdur, ikisi birlikte çözünürse asidik bir tampon çözelti oluşur.
- Zayıf bazların tuzunu tanımak için tuzun formülüne bakılır.
- Tuzun formülü ile bazın formülünde ortak bir iyon varsa, o tuz ve o bazın tuzdur, ikisi birlikte çözünürse bazik bir tampon çözelti oluşur.
Tampon Çözelti Örnekleri
Bazik Tampon Çözelti Örnekleri (Zayıf baz ile tuzu):
– NH3 (Amonyak) ve NH4Cl (Amonyum klorür) çözeltisi
– CH3NH2 (Metil amin) ve CH3NH3Cl (Metil amonyum klorür) çözeltisi
– CH3CH2NH2 (Etil amin) ve CH3CH2NH3Cl (Etil amonyum klorür) çözeltisi
Asidik Tampon Çözelti Örnekleri (Zayıf asit ile tuzu):
– HF (Hidroflorik asit) ile NaF ( Sodyum florür) çözeltisi
– CH3COOH (Asetik asit) ile CH3COONa (Sodyum asetat) çözeltisi
– HNO2 (Nitröz asidi) ile NaNO2 (Sodyum nitrit) çözeltisi
– HCN (Hidrojen siyanür) ile NaCN (Sodyum siyanür) çözeltisi
– H2CO3 (Karbonik asit) ile NaHCO3 (Sodyum bikarbonat) çözeltisi
Bu bir reklamdır:
Tampon Çözeltilerin Özellikleri
- Tampon çözeltilerin en önemli özelliği, pH’larının dirençli olmasıdır. Yani, bir tampon çözeltiye, dışarıdan başka bir asit ya da baz eklerseniz, eklediğiniz madde, belli bir miktarı geçene kadar, tampon çözeltinin pH değeri değişmez.
Tampon Çözeltilerin Canlılar İçin Önemi
- Kanımız, pH değeri ortalama 7.35 ile 7.45 arasında olan, bir çeşit tampon çözeltidir. Bir tampon çözelti olduğu için, kanımızın pH değeri, yediğimiz/içtiğimiz besinlerden hemen etkilenmez. Bu da sağlığımız için önemlidir.
- Hücrelerimizin stoplazma sıvısı da bir çeşit tampon çözeltidir. Çünkü, hücrede gerçekleşen bir çok metabolik olayda, pH değerinin belli bir değerde kalması önemlidir.
- Vücudumuzdaki enzimler, ortamın pH deperi 6,2 ile 8,0 arasında iken daha sağlıklı çalışırlar. Bu yüzden, tampon çözeltiler, sağlığımız için çok önemlidir.
Örnek:
0,2 mol HCN ve 0,4 mol NaCN içeren 2 L’lik bir çözeltinin pH değeri kaçtır? (HCN için Ka = 2.10-5)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Standart şartlarda, 0,02M NH3 ile 0,1M NH4Cl içeren bir çözeltinin pH değeri kaçtır? (NH3 için Kb = 5.10-6)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Tuzların Asidik Bazik Karakterleri
- Asitlere, tuzların annesi, bazlara da tuzların babası diyebiliriz çünkü; her tuz bileşiği, bir asit ile bir bazın tepkimesinden meydana gelir.
- Nasıl ki, annenin genleri daha baskın ise çocuk anneye, babanın genleri daha baskınsa da çocuk babaya benzer. Aynen bunun gibi;
- Kuvvetli bir asit ile zayıf bir bazdan oluşan tuzlar asidik karakter taşırlar. Böyle tuzlara, asidik tuzlar denir. Asidik tuzların, sulu çözeltilerinin pH değeri 7’nin altındadır, yani asidiktir.
- Kuvvetli bir baz ile zayıf bir asitten oluşan tuzlar, bazik karakter taşırlar. Böyle tuzlara, bazik tuzlar denir. Bazik tuzların, sulu çözeltilerinin pH değeri 7’den büyüktür, yani baziktir.
- Kuvvetli bir asit ile kuvvetli bir bazdan oluşan tuzlara nötür karakterlidir. Böyle tuzlara nötür tuzlar denir. Nötür tuzların sulu çözeltilerinde pH değeri 7’dir.
- Tuzların katyonu (“+” yüklü iyonu) bazdan, anyonu (“-” yüklü iyonu) asitten gelir.
- NaCl oluşum tepkimesini hatırlayalım:
- NaOH + HCl → NaCl + H2O
- NaCl tuzu için:
- Katyonu, Na+ : NaOH bazından gelir
- Anyonu Cl– : HCl asidinden gelir.
- NaCl oluşum tepkimesini hatırlayalım:
Asidik Tuzlar
- Kuvvetli bir asit ile zayıf bir bazın tepkimesinden oluşan tuzlardır.
- Asidik tuzların, bazdan gelen iyonları hidrolize uğrar.
Öğretici Örnek:
Bir asidik tuz olan NH4Cl nasıl oluşur bakalım.
Tuzun asit ve bazı:
HCl (Hidroklorik asit): Kuvvetli asittir
NH3 (Amonyak): Zayıf bazdır
Bu ikisinin tepkimesinden, asidik bir tuz oluşur:
NH3(suda) + HCl(suda) → NH4Cl(suda) + H2O(s)
Tepkimede oluşan NH4Cl (Amonyum klorür) tuzu, asidik bir tuzdur. Tuzun;
– NH4+ iyonu NH3 bazından
– Cl– iyonu HCl asidinden gelmiştir.
Bu bir reklamdır:
NH4Cl Tuzunu Suya Atarsak
- NH4Cl (Amonyum klorür) tuzu, suda oldukça iyi çözünen bir tuzdur.
- Tabiattaki her tuz gibi katıdır ve suya attığımızda, her tuz gibi, suda iyonlarına ayrışarak çözünecektir. Görelim:
NH4Cl(k) → NH4+(suda) + Cl–(suda)
- Burada, NH4+ (Amonyum) iyonunda dikkat etmemiz gerekiyor.
- Çünkü, önceki başlıklardan hatırlayalım, NH4+ iyonu, hidrolize uğrayan ve suya H3O+ iyonu verebilen bir iyondur. Görelim:
NH4+(suda) + H2O(s) ⇄ NH3(suda) + H3O+(suda)
- Suya H3O+ iyonu verdiği için, NH4Cl tuzu asidik bir tuzdur.
- Bütün asidik tuzların, zayıf bazdan gelen katyonları, asit gibi davranır ve suya H+ veya H3O+ iyonu verir.
NaHSO4 Tuzunu Suya Atarsak
- NaHSO4 (Sodyum bisülfat) tuzu, suda oldukça iyi çözünen bir tuzdur.
- Her tuz gibi katıdır ve suya attığımızda, her tuz gibi, suda iyonlarına ayrışarak çözünecektir. Görelim:
NaHSO4(k) → Na+(suda) + HSO4– (suda)
- Burada HSO4– (Bisülfat) iyonunda dikkat etmemiz gerekiyor. Çünkü; bu iyon, hidrolize uğrar.
- HSO4– iyonu, asit gibi davranan ve suya H+ iyonu verebilen bir iyondur. Görelim:
HSO4–(suda) + H2O(s) ⇄ SO42-(suda) + H3O+(suda)
- Suya H3O+ iyonu verdiği için, NaHSO4 tuzu asidik bir tuzdur.
Bazik Tuzlar
- Kuvvetli bir baz ile zayıf bir asidin tepkimesinden oluşan tuzlardır.
- Bazik tuzların asitten gelen iyonları hidrolize uğrar.
Öğretici Örnek:
Bir bazik tuz olan CH3COONa tuzu nasıl oluşur bakalım.
Tuzun asit ve bazı:
CH3COOH (Asetik asit): Zayıf asittir
NaOH (Sodyum hidroksit): Kuvvetli bazdır
Bu ikisinin tepkimesinden, asidik bir tuz oluşur:
NaOH(suda) + CH3COOH(suda) → CH3COONa(suda) + H2O(s)
Tepkimede oluşan CH3COONa (Sodyum asetat) tuzu, asidik bir tuzdur. Tuzun;
– CH3COO– iyonu, CH3COOH asidinden
– Na+ iyonu, NaOH bazından gelmiştir.
Bu bir reklamdır:
CH3COONa Tuzunu Suya Atarsak
- CH3COONa (Sodyum asetat) tuzu, suda oldukça iyi çözünen bir tuzdur.
- Her tuz gibi katıdır ve suya attığımızda, her tuz gibi, suda iyonlarına ayrışarak çözünecektir. Görelim:
CH3COONa(k) → CH3COO–(suda) + Na+(suda)
- Burada CH3COO– (Asetat) iyonunda dikkat etmemiz gerekiyor. Çünkü; bu iyon, hidrolize uğrar.
- CH3COO– iyonu, baz gibi davranan ve sudan H+ iyonu alabilen bir iyondur. Görelim:
CH3COO–(suda) + H2O(s) ⇄ CH3COOH(suda) + OH–(suda)
- Suya, OH– iyonu verebildiği için, CH3COONa tuzu bazik bir tuzdur.
- Bütün bazik tuzların, zayıf asitten gelen anyonları, baz gibi davranır ve sudan H+ iyonunu alır.
Nötür Tuzlar
- Kuvvetli bir asit ile kuvvetli bir bazın tepkimesinden oluşan tuzlara nötür tuzlar denir.
- Nötür tuzlar, suda çözündüklerinde hidrolize uğramazlar.
Öğretici Örnek:
Bir nötür tuz olan NaCl tuzu nasıl oluşur bakalım:
Tuzun asit ve bazı:
HCl (Hidroklorik asit): Kuvvetli asittir
NaOH (Sodyum hidroksit): Kuvvetli bazdır
Bu ikisinin tepkimesinden, nötür bir tuz oluşur:
NaOH(suda) + HCl(suda) → NaCl(suda) + H2O(s)
Tepkimede oluşan NaCl (Sodyum klörür) tuzu, nötür bir tuzdur. Tuzun;
– Na+ iyonu, NaOH bazından gelmiştir.
– Cl– iyonu, HCl asidinden gelmiştir.
Nötür tuzların suya verdikleri iyonlar, asit veya baz gibi davranmazlar:
NaCl(suda) → Na+(suda) + Cl–(suda)
Bu bir reklamdır:
Titrasyon
- Titrasyon olayı, en basit ifadesiyle, asit ve baz çözeltilerini birbirine karıştırmak demektir.
- Titrasyonda amaç, derişim hesaplamaktır. Yani; derişimini bilmediğimiz bir asit çözeltisinin derişimini, titrasyon ile hesaplarız. Aynı şekilde, derişimini bilmediğimiz bir baz çözeltisinin derişimini de titrasyon ile hesaplarız.
- Derişimi belli olmayan bir asit çözeltisinin derişimini, bu asit çözeltisinin üzerine, derişimini belli olan bir baz çözeltisi ekleyerek bulabiliriz. Aynı şekilde, bir baz çözeltisinin derişimini de, derişimi belli bir baz çözeltisi ile bulabiliriz. Bu işlemlere titrasyon denir.
- Titrasyon işlemi; nötürleşme anında kesilir.
- Nötürleşme anına “eş değerlik noktası” veya “dönüm noktası” denir.
- Eşdeğerlik noktasında, titre edilen çözeltide pH değeri 7 olur.
- pH değeri 7 olan bir çözeltide; H+ sayısı ve OH– sayısı eşit demektir.
Titrasyon İşlemi
Önce titrasyon işlemini canlı olarak görelim:
Aşağıda, derişimi bilinmeyen bir Asetik asit (CH3COOH) çözeltisi, derişimi bilinen bir Amonyak (NH3) çözeltisi ile titre ediliyor:
Titrasyon işlemi, aşağıdaki düzenekle gerçekleşir:

Şekilde görüldüğü gibi, derişimi hesaplanacak olan çözelti, erlenmayere konulur.
- Erlenmayere konulan ve derişimini bilmediğimiz çözeltiye analit denir.
- Titrasyonda amaç analitin derişimini bulmaktır.
- Dönüm noktasını kaçırmamak için analit çözeltisine bir indikatör de katılır.
- Bürete konulan ve derişimini bildiğimiz çözeltiye titrant denir.
- Titrant, derişimi bilinen çözeltidir.
- Titrasyon işlemi şu şekilde uygulanır:
- Titrasyona başlamadan önce, büretteki çözeltinin hacmi not edilir.
- Büretin musluğu açılarak, titrant yavaş yavaş analit çözeltiye dökülür.
- Renk değişimi anında musluk kapatılır ve titrasyon bitirilir.
- Titrasyon bittikten sonra, büretteki titrant çözeltinin hacmine bakılır.
- Büretteki, başlangıç hacmi ile son hacim arasındaki fark, harcanan titrant hacmini verir. Bu değer, titrasyon formülünde kullanılarak, analitin derişimi hesaplanır.
Titrasyon Formülü
- Titrasyon işleminde, eş değerlik noktasına gelindiğinde, indikatör, renk değiştirir ve erlenmayerdeki çözelti nötürlenmiş olur.
- Eş değerlik noktasında, erlenmayerdeki çözeltide eşit sayıda H+ ve OH– iyonu var demektir.
- Yani; renk değişiminin gerçekleştiği anda aşağıdaki eşitlik kurulmuş olur:
nH+ = nOH–
- Aynı eşitlik şu şekilde de yazılabilir:
Masit.Vasit.tasit = Mbaz.Vbaz.tbaz
- Formüllerdeki sembollerin anlamları şöyledir:
- M: Molerite
- V: Çözeltilerin hacimleridir.
- t: Tesir değerliğidir.
- Tesir değerliği; asitlerin formüllerindeki H+ sayısı, bazların formülündeki OH– sayısıdır.
Öğretici Örnek:
Aşağıda, bazı asit ve bazların tesir değerlikleri verilmiştir.
- HCl (Hidroklorik asit) asidi:
- Tesir değerliği: 1
- H2SO4 (Sülfürik asit) asidi:
- Tesir değerliği: 2
- H3PO4 (Fosforik asit) asidi:
- Tesir değerliği: 3
- NaOH (Sodyum hidroksit) bazı:
- Tesir değerliği: 1
- Ca(OH)2 (Kalsiyum hidroksit) bazı:
- Tesir değerliği: 2
- NH3 (Amonyak) bazının:
- Tesir değerliği: 1
Bu bir reklamdır:
Örnek:
Derişimi bilinmeyen 200 mL HCl çözeltisi, 0,2M Ca(OH)2 çözeltisi ile titre ediliyor. Titrasyon işleminde 50 mL Ca(OH)2 kullanıldığında, HCl çözeltisinin rengi değişiyor.
Buna göre, HCl çözeltisinin derimi kaç Molardır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
İndikatör Nedir?
- Ortamın pH değerine göre renk değiştiren kimyasal maddelere indikatör denir.
- En yaygın indikatörlerden biri turnusol kağıdıdır.
- Turnusol kağıdı, asidik ortamda kırmızı, bazik ortamda mavi renk alan bir indikatördür. (Asitler kızartır, bazlar morartır.)
- Fenolftalein, titrasyon işleminde sık kullanılan bir indikatördür.
- Fenolftalein, bazik ortamda pembe renk verir; asidik ortamda ise renksizdir.
Titrasyon Grafiği
- Titrasyon işleminde, asit üzerine baz döküyorsak, asit çözeltisinin pH değeri zamanla yükselecektir.
- Bu işlem sırasında pH-Eklenen Baz Hacmi grafiği şöyle olacaktır:

- Titrasyon işleminde, baz üzerine asit döküyorsak, baz çözeltisinin pH değeri zamanla düşecektir.
- Bu işlem sırasında pH-Eklenen Asit Hacmi grafiği şöyle olacaktır:

Çözünme-Çökelme Dengeleri
- Tuzlar, suda iyonlarına ayrışarak çözünen katılardır.
- Eğer suya, çözebileceğinden daha fazla tuz katarsak; tuzun bir miktarı suda çözünerek suyu doyurur, geriye kalan miktarı ise katı halde suyun dibinde kalır.
- Bu şekildeki doymuş çözeltilerde, dipte kalan katı ile çözünen iyonlar arasında bir çözünme-çökelme dengesi kurulur.
- Aşağıda, çözebileceğinden daha fazla AgCl (Gümüş klorür) tuzu içeren bir sulu çözeltide oluşan denge tepkimesini görüyorsunuz:
AgCl(k) ⇄ Ag+(suda) + Cl–(suda)
Molarite Cinsinden Çözünürlük
- Bir tuzun, doymuş çözeltisinin Molaritesine o tuzun “molar çözünürlüğü” denir.
- Yani bir tuz, suda en fazla kaç Molara kadar çözünebiliyorsa, çözünürlüğü o kadar Molardır.
- Molar çözünürlük genellikle “S” harfi ile sembolize edilir.
- Molar çözünürlüğe, sadece “çözünürlük” de denir.
- Molar çözünürlüğü, 0,1M değerinden daha az olan tuzlara, “az çözünen tuzlar” denir.
- Az çözünen tuzlar, suyu hemen doyuracakları için, bu tuzların çözünme-çökelme dengesi suya az bir miktar tuz katmakla kurulabilir.
Örnek:
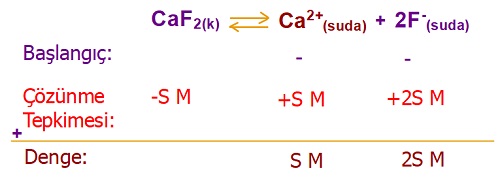
Belli bir sıcaklıkta, CaF2 tuzunun çözünürlüğü, 0,01M olarak ölçülmüştür.
Buna göre, aynı sıcaklıkta, 10 Litre doymuş CaF2 çözeltisinde, en fazla kaç gram CaF2 tuzu çözünebilir? (Ca: 40 g/mol, F: 19 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Belli bir sıcaklıkta, CaF2 tuzunun çözünürlüğü, 0,01M olarak ölçülmüştür.
Buna göre, aynı sıcaklıkta, doymuş CaF2 çözeltisinde, hangi iyonlar vardır ve derişimleri kaçtır?
Cevap
Örneğin çözümü:
Kçç (Çözünürlük Çarpımı)
- Kçç; çözünürlük çarpımı olarak adlandırılan bir çeşit denge sabitidir.
- Kçç; sadece tuzlar ve diğer iyonik bileşikler için kullanılan bir çeşit Kc (derişimler cinsinden denge sabiti) sabitidir.
- Kçç bağıntısı da tıpkı Kc bağıntısı gibi yazılır:

- Kçç bağıntısında da katı ve sıvılar yer almaz.
Öğretici Örnek:
Aşağıda suda az çözünen bazı tuzların çözünme dengeleri ve Kçç bağıntıları verilmiştir.
- Katı oldukları için, tepkimelerin girenlerini, denge bağıntısına yazmıyoruz:
CaF2 tuzuna ait çözünme dengesi tepkimesi ve Kçç bağıntısı şöyledir:
- Tepkime:
- CaF2(k) ⇄ Ca2+(suda) + 2F–(suda)
- Kçç bağıntısı:
- Kçç = [Ca2+][F–]2
AgCl tuzuna ait çözünme dengesi tepkimesi ve Kçç bağıntısı şöyledir:
- Çözünme dengesi:
- AgCl(k) ⇄ Ag+(suda) + Cl–(suda)
- Kçç bağıntısı:
- Kçç = [Ag+][Cl–]
Mg3(PO4)2 tuzuna ait çözünme dengesi tepkimesi ve Kçç bağıntısı şöyledir:
- Çözünme dengesi:
- Mg3(PO4)2(k) ⇄ 3Mg2+(suda) + 2PO43-(suda)
- Kçç bağıntısı:
- Kçç = [Mg2+]3[PO43-]2
Al(OH)3 tuzuna ait çözünme dengesi tepkimesi ve Kçç bağıntısı şöyledir:
- Çözünme dengesi:
- Al(OH)3(k) ⇄ Al3+(suda) + 3OH–(suda)
- Kçç bağıntısı:
- Kçç = [Al3+][OH–]3
Bu bir reklamdır:
Kçç Bağıntısı Örnekleri
Aşağıdaki iki tabloda, bazı tuz ve iyonik bileşikler, Kçç değerleri ile birlikte verilmiştir.

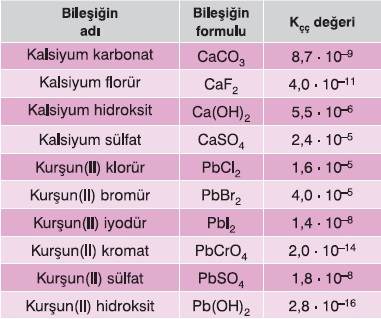
Kçç – Çözünürlük İlişkisi
- Kçç sabiti, bütün denge sabitleri gibi, denge anındaki derişimlerle hesaplanır.
- Bir tuzun, suda çözünme tepkimesi denge halinde ise, doymuş bir çözelti oluşmuş demektir.
- Doymuş çözeltideki derişimi, tuz için özel bir derişimdir, çünkü bu derişim aynı zamanda tuzun çözünürlüğüdür (S).
- Yani, Kçç bağıntısı, tuzun çözünürlük değeri ile hesaplanır.
- Bu yüzden Kçç bağıntısına “çözünürlük çarpımı” denir.
Kçç değerinden çözünürlük, çözünürlük değerinden Kçç hesaplanabilir.
Örnek:
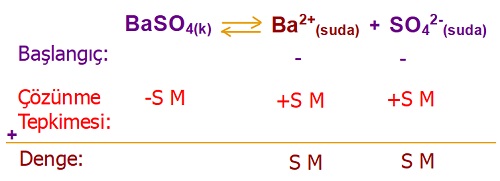
25oC’ BaSO4 tuzunun Kçç değeri 10-10 olarak verilmiştir.
Buna göre bu sıcaklıkta, BaSO4 tuzunun çözünürlüğünü hesaplayınız.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
25oC’ CaF2 tuzunun Kçç değeri 32.10-12 olarak verilmiştir.
Buna göre bu sıcaklıkta, CaF2 tuzunun çözünürlüğünü hesaplayınız.
Cevap
Örneğin çözümü:
Bu bir reklamdır:
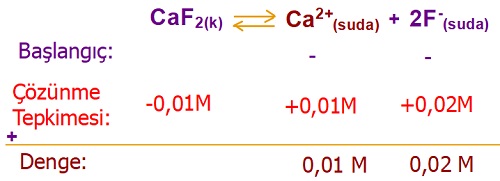
Örnek:
Belli bir sıcaklıkta, CaF2 tuzunun çözünürlüğü, 0,01M olarak ölçülmüştür.
Buna göre, aynı sıcaklıkta, CaF2 tuzunun çözünürlük çarpımını kaçtır?
Cevap
Örneğin çözümü:
Tuzların Çözünürlüğüne Etki Eden Faktörler
- Çözünürlük, ayırt edici bir özelliktir.
- Yani, her maddenin çözünürlük değeri farklıdır ve bir maddenin çözünürlük değeri o maddenin parmak izi gibidir.
- Tuzların çözünürlüğü de, belli koşullarda sabittir ve her tuz için ayırt edicidir.
- Bir tuzun çözünürlüğü iki şekilde değişir. Bunlar:
- Sıcaklık
- Ortak iyon
Kçç bir çeşit denge sabiti olduğundan, bütün denge sabitleri gibi sadece sıcaklık ile değişir.
1. Çözünürlüğe Sıcaklık Etkisi
- Çözünürlük; denge anına ait bir değer olduğu için, çözünürlüğe sıcaklık etkisi, aslında; dengeye sıcaklık etkisi ile aynı şeydir.
- Dengeye sıcaklık etkisi, Le Chatelier Prensibi ile açıkladığımız bir konuydu. Kısaca tekrar hatırlayalım.
- Sıcaklık arttırıldığında, denge tepkimesine ısı verilmiş olur.
- Isısı artan denge, Le Chatelier Prensibine göre; ısıyı azaltacak yöne kayar; ısısı azalan denge tepkimesi de ısıyı arttıracak yöne kayar.
- Endotermik çözünen tuzların denge tepkimesinde ısı, girenlerdedir; ekzotermik tuzlarda ise ısı ürünlerdedir.
Öğretici Örnek:
- Bir endotermik çözünme dengesi örneği şöyledir:
- AgCl(k) + ısı ⇄ Ag+(suda) + Cl–(suda)
- Yukarıdaki tuzun çözünme tepkimesi endotermiktir.
- Bu tuzun, dibinde katısı bulunan doymuş çözeltisi (denge anı) ısıtılırsa:
- Denge ürünlere kayar.
- Ürünlerin derişimi artar.
- Tuzun çözünürlüğü artar.
- Dipteki katı miktarı azalır.
- Tuzun Kçç değeri büyür.
- Bu tuzun, dibinde katısı olmayan doymuş çözeltisi ısıtılırsa:
- Ürünlerin derişimi değişmez.
- Tuzun çözünürlüğü artar.
- Doymamış bir çözelti oluşur.
- Tuzun Kçç değeri büyür.
- Bu tuzun doymuş çözeltisi soğutulursa (dibinde katısı olsun olmasın):
- Tuzun çözünürlüğü azalır.
- Kçç değeri küçülür.
- Aşırı doymuş bir çözelti oluşur.
- Çözünen iyonların bir kısmı zamanla kristallenir ve katı hale geçer.
- Dipteki katı tuzun (girenlerin) miktarı artar.
- Dipte katı yoksa da bir miktar katı oluşur.
- Çözünen iyonların derişimi azalır.
Aşağıda, çözünme dengesi endotermik olan AgCl tuzunun farklı sıcaklıklardaki, çözünürlük ve Kçç değerleri verilmiştir: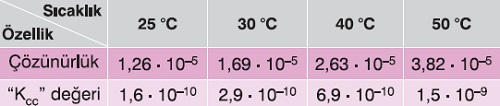
Bu bir reklamdır:
Öğretici Örnek:
- Ekzotermik çözünme tepkimesi dengesi şuna benzer:
- Ce2(SO4)3(k) ⇄ 2Ce3+(suda) + 3SO42-(suda) + ısı
- Yukarıdaki tuzun çözünme tepkimesi ekzotermiktir.
- Bu tuzun doymuş çözeltisi ısıtılırsa (dibinde katısı olsun olmasın):
- Tuzun çözünürlüğü azalır.
- Kçç değeri küçülür.
- Aşırı doymuş bir çözelti oluşur.
- Çözünen iyonların bir kısmı zamanla kristallenir ve katı hale geçer.
- Dipteki katı tuzun (girenlerin) miktarı artar.
- Dipte katı yoksa da bir miktar katı oluşur.
- Çözünen iyonların derişimi azalır.
- Bu tuzun, dibinde katısı bulunan doymuş çözeltisi (denge anı) soğutulursa:
- Denge ürünlere kayar.
- Ürünlerin derişimi artar.
- Tuzun çözünürlüğü artar.
- Dipteki katı miktarı azalır.
- Tuzun Kçç değeri büyür.
- Bu tuzun, dibinde katısı olmayan doymuş çözeltisi soğutulursa:
- Ürünlerin derişimi değişmez.
- Tuzun çözünürlüğü artar.
- Doymamış bir çözelti oluşur.
- Tuzun Kçç değeri büyür.
Bu bir reklamdır:
2. Çözünürlüğe Ortak İyon Etkisi
- Adından da anlaşılacağı gibi, ortak iyon sorularında, suda çözünen iki tane tuz vardır ve bu tuzların formüllerinin yarısı aynıdır.
- Yani; iyonlarından biri ortaktır.
- “Ortak iyon” yine Le Chatelier Prensibine göre, çözünürlüğü her zaman düşürür.
- Ortak iyon Kçç değerini değiştirmez.
Öğretici Örnek:
AgCl(k) ⇄ Ag+(suda) + Cl–(suda)
- Yukarda, çözünme dengesi verilen AgCl tuzunun çözeltisi doymuşken, yani tepkime dengedeyken, çözeltiye Cl– iyonu katarsak:
- Cl– derişimi artar ve denge Cl– derişimini azaltmak için girenlere kayar.
- Bu da çözünürlüğün düşmesi demektir.
Bu bir reklamdır:
- Ortak iyon sorularında genellikle şu durumlara dikkat edilir:
- Suda çözünen tuzlardan biri suda çok az çözünüyordur ve Kçç değeri verilir ya da sorulur.
- Diğer tuz, suda iyi çözünen bir tuzdur ve tamamen çözünür.
- Ortak iyon sorularında, hesap yaparken hep bir “ihmal” yapmamız gerekir.
- İhmal kuralını zayıf asit ve bazlardan hatırlıyoruz. Burada yapacağımız ihmal de aynı mantıkla yapılır.
Örnek:
AgCl tuzunun Kçç değeri, 10-12 olduğu şartlarda aşağıdaki soruları cevaplayınız.
a) AgCl tuzunun, saf sudaki çözünürlüğü kaçtır?
b) AgCl tuzunun 0,1M NaCl çözeltisindeki çözünürlüğü kaçtır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:



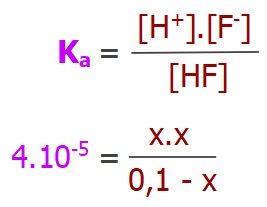

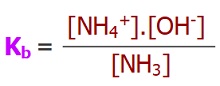



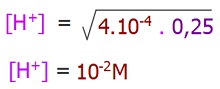

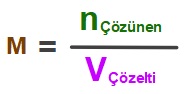


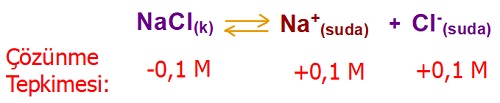


eslm says:
çok teşekkür ederim <33