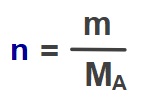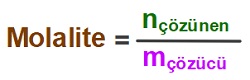İçindekiler
- Bir çözeltinin, çözünen madde oranı değiştikçe değişen özelliklerine koligatif özellikler denir.
- Mesela, suda ne kadar çok tuz çözersek, suyun kaynama noktası o kadar yüksek olur.
- Bu yüzden kaynama noktası bir koligatif özelliktir.
- Çözeltilerde, çözünen madde oranına derişim dendiğini daha önce öğrenmiştik. Demek ki; koligatif özellikler, derişime bağlı özelliklerdir.
- Sulu çözeltilerin aşağıdaki özellikleri, koligatif özelliklerdir:
- Buhar Basıncını
- Kaynama Noktasını
- Donma Noktasını
- Yoğunluk (Öz kütle) (Fizik dersinde anlatılacaktır: Karışımların Yoğunluğu)
Gelin, koligatif özellikleri yakından görelim.
Buhar Basıncı Alçalması (Raoult Yasası)
Buhar Basıncını Hatırlayalım
- Her sıvının, kendine ait bir buhar basıncı vardır.
- Sıvıların buhar basıncı sıcaklık arttıkça artar ve kaynama noktasında dış basınca eşit olur.
- Sabit bir sıcaklıkta, saf suda, her hangi bir madde çözersek:
- çözünen madde sudan daha uçucu bir madde değilse, suyun buhar basıncı azalır.
- Katılar genellikle uçucu olmadıkları için, suda tuz gibi bir katı çözmek, suyun buhar basıncını düşürür.
Mol Kesrini Hatırlayalım
- Bir çözeltideki bir A maddesinin “mol kesri (XA)” şöyle bulunuyordu:
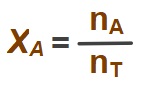
- Formüldeki:
- nT ifadesi: çözeltide bulunan bütün maddelerin toplam mol sayısıdır,
- nA ifadesi: çözeltideki A maddesinin toplam mol sayısıdır.
Buhar Basıncı Değişiminin Hesaplanması
- Sıvı çözeltinin buhar basıncını Raoult Yasası ile hesaplayabiliriz.
Raoult Yasası
- Tuzlu su gibi, sıvı bir çözeltinin buhar basıncını hesaplarken kullanılan formüle Raoult Yasası denir.
- Raoult Yasası şu formüldür.

Formüldeki sembollerin anlamı şöyledir:
- Pçözücü: Çözeltideki çözücü sıvının yeni buhar basıncı.
- Poçözücü: Çözeltideki çözücü sıvının saf iken buhar basıncı
- Xçözücü: Çözücü sıvının çözeltideki mol kesridir.
Örnek:
40 oC’de, 144 gram suda 80 gram NaOH tamamen çözülüyor.
Buna göre oluşan çözeltinin buhar basıncı kaç cmHg’dır? (40 oC’de saf suyun buhar basıncı 40 cmHg’dır. Na: 23 g/mol, H: 1 g/mol, O: 16 g/mol)
Cevap
Örneğin çözümü:
Donma Noktası Alçalması (Kriyoskopi)

- Saf suyun normal koşullarda donma noktası 0 oC’dir.
- Fakat; suda bir miktar tuz çözersek, aynı koşullarda donma noktası sıfırın altına düşecektir.
- Çünkü; tuz gibi uçucu olmayan bir katıyı çözünce sıvıların donma noktası düşer.
- Bu yüzden, donlanmayı önlemek için kışın yollara tuz atılır.
Aşağıda, saf suyun ve tuzlu suyun aynı ortamdaki donma olaylarına ait grafiker verilmiştir:
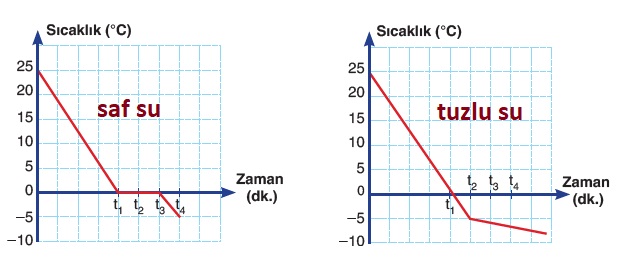
Yukarıdaki grafiklerde görüldüğü gibi, suda tuz çözersek, donma sıcaklığı sıfırın altına düşmektedir. Peki kaç derece düşmektedir? Gelin bu sorunun cevabını arayalım.
Donma Noktasındaki Düşüş Miktarı
- Donma noktasındaki düşüşün kaç derece olduğunu bulmak için aşağıdaki formülü kullanırız:

Formüldeki sembollerin anlamış şudur:
- ΔTd : Çözücünün donma noktasındaki düşüşün kaç derece olduğunu gösterir.
- m : Çözeltinin molalitesidir.
- i : van’t Hoff Faktörüdür.
- Kd : Kriyoskopi sabitidir. Her çözücü için farklı bir değer alır. Değeri su için şöyledir: 1,86 oC/m
Bazı Çözücülerin Kd Değerleri
Aşağıdaki tabloda, bazı çözücülerin normal donma noktaları ve Kd değerleri verilmiştir:

Van’t Hoff Faktörü (i)
- Bir bileşiğin suya verdiği iyon sayısına van’t Hoff Faktörü denir.
- Van’t Hoff Faktörü “i” harfi ile gösterilir.
- Bileşik suda iyonlarına ayrışmıyorsa Van’t Hoff faktörü 1 alınır.
- Alkol
- Şeker
- Etilen glikol gibi suda iyonlarına ayrışmadan çözünen (moleküler çözünen) maddelerin van’t Hoff Faktörü 1’dir.
- Asitler, bazlar ve tuzlar suda iyonlarına ayrışarak çözünür. Bu bileşiklerin formüllerindeki toplam iyon sayısı, Van’t Hoff fakötrü olarak alınır:
- NaCl tuzu suda:
- Na+ ve Cl– diye iki parçaya ayrıldığı için van’t Hoff Faktörü 2’dir.
- CaCl2 tuzu suya:
- 1 tane Ca2+ ve 2 tane de Cl– iyonu olmak üzere toplam 3 tane iyon verir. Bu yüzden bu tuzun van’t Hoff Faktörü 3’tür.
- Al2(SO4)3 tuzu suya:
- 2 tane Al3+, 3 tane SO42- iyonu olmak üzere toplam 5 tane iyon verir. Bu yüzden Van’t Hoff faktörü 5’tir.
- NaCl tuzu suda:
Örnek:
Etilen glikol, (C2H4(OH)2) arabaların sularına katılan antifriz sıvısıdır. Normal koşullarda, 2500 g suya 620 gram etilen glikol katılarak tamamen çözülüyor.
Buna göre, oluşan çözeltinin donma noktasını hesaplayınız. (Su için Kd = 1,86 oC/m, C: 12 g/mol, H: 1 g/mol, O: 16 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Normal koşullarda, 5000 g suya 290 gram yemek tuzu (NaCl) katılarak tamamen çözülüyor.
Buna göre, oluşan çözeltinin donma noktasını hesaplayınız. (Su için Kd = 1,86 oC/m, Na: 23 g/mol, Cl: 35 g/mol)
Cevap
Örneğin çözümü:
Kaynama Noktası Yükselmesi (Ebülyoskopi)
- Saf suyun normal koşullarda kaynama noktası 100 oC’dir.
- Fakat; suda bir miktar tuz çözersek, aynı koşullarda kaynama noktası 100 oC’nin üzerine çıkacaktır.
- Çünkü; tuz gibi uçucu olmayan bir katıyı çözünce sıvıların kaynama noktası yükselir.
Aşağıda, saf suyun ve tuzlu suyun aynı ortamdaki kaynama olaylarına ait grafiker verilmiştir:

- Tıpkı donma noktasındaki alçalma gibi, kaynama noktasındaki yükselme de hesap edilebilir.
- Bunun yapmamız gereken tek şey aşağıdaki formülü doğru kullanmaktır:

Formüldeki sembollerin anlamış şudur:
- ΔTk : Çözücünün kaynama noktasındaki yükselişin kaç derece olduğunu gösterir.
- m : Çözeltinin molalitesidir.
- i : van’t Hoff Faktörüdür.
- Kk : Ebülyoskopi sabitidir. Her çözücü için farklı bir değer alır. Değeri su için şöyledir: 0,51 oC/m
Bazı Çözücülerin Kk Değerleri
Aşağıdaki tabloda, bazı çözücülerin normal kaynama noktaları ve Kk değerleri verilmiştir:

Bu bir reklamdır:
Örnek:
Normal koşullarda, 5000 g suya 290 gram yemek tuzu (NaCl) katılarak tamamen çözülüyor.
Buna göre, oluşan tuz çözeltisinin kaynama noktasını hesaplayınız. (Su için Kk = 0,51 oC/m, Na: 23 g/mol, Cl: 35 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Ozmotik Basınç
- Osmotik basınç, osmoz olayı sonucu ortaya çıkan sıvı basıncıdır.
- O zaman önce osmoz olayını görelim:

Osmoz Olayı
- Osmoz olayı genellikle, tam dibinde bir membran (yarı geçirgen zar) olan U şekildeki borularda gözlemlenir.
- Seyreltik çözeltideki çözücü moleküllerinin, yarı geçirgen bir zardan ve kendiliğinden daha derişik çözeltiye geçmesine osmoz denir.
Osmotik Basınç
- Osmoz olayında, oluşan seviye farkının yüksekliği ölçülür. Bu yükseklikteki çözeltinin tabanına uyguladığı basınca, osmotik basınç denir.
Osmoz Olayında Neler Olur?
- Osmoz olayı, aynı çözücünün farklı derişimdeki iki çözeltisi arasına bir yarı geçirgen zar (membran) konulursa ortaya çıkan olaydır.
- Yani; tek şekerli çay ile iki şekerli çay arasına bir membran koyabilirsek, osmoz olayına şahit olabiliriz.
- Bu iki çay arasına bir membran konulursa; tek şekerli çaydaki su, kendiliğinden, iki şekerli çaya doğru akar ve iki şekerli çayın miktarı zamanla artar. İşte bu olaya osmoz denir.
- Tek şekerli çay, daha seyreltik olan; iki şekerli çay, daha derişik olan çözeltidir. Anlaşılacağı gibi, osmoz olayı, seyreltik bir çözelti ile daha derişik bir çözelti arasında gerçekleşir.
- U boruda gözlemlenen osmoz olayında, çözücü molekülleri, membrandan karşıya geçince:
- karşıdaki derişik çözeltinin seviyesi yükselir
- seyreltik çözeltinin seviyesi alçalır.
- Sonuçta, iki çözelti arasında bir seviye farkı oluşur.
Ters Ozmoz

- Osmoz olayını tersine çevirmek mümkündür.
- Yapmamız gereken tek şey, derişik çözeltinin osmotik basınçtan daha yüksek miktarda bir basınç uygulamaktır.
- Derişik çözeltiye, osmotik basınçtan daya yüksek miktarda basınç uygularsak, çözücü molekülleri bu defa seyreltik çözeltiye doğru akacaktır.
- Osmoz olayı kendiliğinden gerçekleşirken, ters osmoz olayında enerji harcanır.
- Ters osmoz olayı tuzlu sudan tatlı su elde edilmesinde kullanılır.
Bu bir reklamdır: