İçindekiler
- “Derişim” çözünen maddenin oranı demektir.
- “Derişim Birimleri”, çözeltilerde, çözünen maddenin çözeltideki oranını ifade eden birimlerdir.
- “Kütlece Yüzde Derişim”, en yaygın kullanılan derişim birimlerinden biridir.
- “Kütlece %10’luk şeker çözeltisi” ifadesinin anlamı şudur:
- Şeker çözeltisinin her 100 gramında 10 gram şeker var, 90 gram su vardır.
- “Kütlece %10’luk şeker çözeltisi” ifadesinin anlamı şudur:
- Bilmemiz gereken derişim birimleri şunlardır:
- Molarite
- Molalite
- Kütlece Yüzde Derişim
- Hacimce Yüzde Derişim
- Mol Kesri
- ppm
Gelin, bu birimleri yakından görelim.
Molarite (M)
- 1 Litre çözeltide çözünmüş olan maddelerin mol sayısına “Molarite” denir.
- Molaritenin sembolü de “M” harfidir, birimi de “M” harfidir.
- Molarite şöyle hesaplanır:
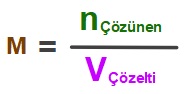
Formüldeki semboller ve birimleri şöyledir:
- M: Molarite demektir.
- Birimi “molar” kelimesi veya “M” harfidir.
- n: Mol sayısı demektir.
- Birimi “mol” kelimesidir.
- V: Hacim demektir.
- Birimi “Litre” kelimesi veya “L” harfidir.
Öğretici Örnek:
Aşağıdaki ifadeler, sorularda karşılaşabileceğimiz ve çözeltilere ait molarite ifadeleridir:
M = 3 M
(3 Molarlık çözelti demektir)
Mtuz = 0,5 M
(0,5 Molar tuz çözeltisi demektir)
MNa+ = 2 M
(2 Molar Na+ iyonu çözeltisi demektir.)
Siz de fark etmişsinizdir; molarite hesabını yapabilmek için mol sayısı kurallarını da bilmek gerekiyor. Mol kavramını hatırlamak için aşağıdaki derse göz atabilirsiniz:
- Molariteyi hesaplarken, çözeltinin hacmini, Litre (L) olarak almak gerekir. Bu yüzden, hacim birimleri arasındaki ilişkiyi hatırlamak iyi olabilir:
- 1 L = 1 dm3 = 1000 mL = 1000 cm3
Örnek:
0,3 mol şeker ile 600 mL şeker çözeltisi hazırlanıyor.
Buna göre bu çözeltinin derişimi kaç molardır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
0,05 molar 0,2 litre HCl çözeltisinde, kaç gram HCl asidi çözünmüştür? (H: 1 g/mol, Cl: 35,5 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
117 gram NaCl ile hazırlanan 500 mL çözeltinin derişimi kaç molardır? (Na: 23 g/mol, Cl: 35,5 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Yoğunluk ile Molarite Hesaplama
- Yoğunluğu (d) ve kütlece yüzdesi belli olan bir çözeltinin Molaritesini bulmak için şu formül kullanılır:

Formüldeki sembollerin anlamı şudur:
- M : Çözeltinin molaritesidir.
- d : Çözeltinin öz kütlesidir (yoğunluğudur).
- Bu formülde, öz kütlenin birimi, g/cm3 veya g/mL olmalıdır.
- Y : Çözeltinin kütlece yüzdesidir.
- Burada dikkat edilmesi gereken şöyle bir durum vardır: Mesela; çözeltinin yüzdesi %40 ise, formülde “Y” harfi yerine sadece 40 yazılacaktır, yani; 40/100 yazılmayacaktır.
- MA : Çözeltide, çözünen maddenin Mol Ağırlığıdır.
- Genelde, sorunun sonunda ve parantez içinde verilir.
Örnek:
Kütlece %63’lük, HNO3 çözeltisinin yoğunluğu 1,2 g/mL olarak hesaplanıyor.
Buna göre bu çözeltinin derişimi kaç molardır? (H: 1 g/mol, N: 14 g/mol, O: 16 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Molalite
- 1 kilogram çözücüde çözünen maddenin mol sayısına (n) molalite denir.
- Molalitenin formülü şöyledir:
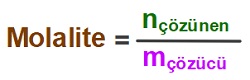
- Molalitenin birimi “molal“dir ve “m” harfi ile gösterilir.
- Mesela; bir maddenin derişimi, 3 molal ise, bu şöyle ifade edilir:
- Molalite = 3 molal veya
- Molalite = 3 m
- Mesela; bir maddenin derişimi, 3 molal ise, bu şöyle ifade edilir:
- Molalite hesaplarken, çözücünün kütlesini kilogram (kg) olarak almak zorundayız. Bu yüzden aşağıdaki eşitliği hatırlamakta fayda var:
- 1 kg = 1000 g
Örnek:
200 gram suda, 24 gram NaOH bazı çözülerek bir çözelti hazırlanıyor.
Buna göre, bu çözeltinin derimi kaç molaldir? (Na: 23 g/mol, O: 16 g/mol, H: 1 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
0,1 m KMnO4 (Potasyum permanganat) çözeltisi hazırlamak için 500 g suda, kaç gram KMnO4 çözmek gerekir? (K: 39 g/mol, Mn: 55 g/mol, O: 16 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Kütlece Yüzde Derişim
- “Kütlece Yüzde Derişim” konusu, Kimya 10 dersinin “Karışımlar” ünitesinde, detaylı bir şekilde anlatılmıştı. Hatırlamak isteyenler, aşağıdaki bağlantıya tıklayabilir.
Hacimce Yüzde Derişim
- “Hacimce Yüzde Derişim” konusu, Kimya 10 dersinin “Karışımlar” ünitesinde, detaylı bir şekilde anlatılmıştı. Hatırlamak isteyenler, aşağıdaki bağlantıya tıklayabilir.
Mol Kesri (X)
- Çözeltideki bir maddenin mol sayısının, bütün maddelerin toplam mol sayısına oranına, o maddenin mol kesri denir.
- A ve B maddelerinden oluşan bir çözeltide:
- A maddesinin mol kesri XA değeri şöyle hesaplanır:
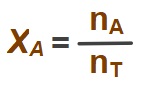
- Aynı çözeltide bulunan, B maddesinin mol kesrini ifade eden, XB değeri de şöyle hesaplanır:

- nT ifadesi, çözeltideki bütün maddelerin mol sayılarının toplamıdır:
- nT = nA + nB
- Bir çözeltideki bütün maddelerin mol kesirlerinin toplamı her zaman 1 yapar:
- XA + XB = 1
Örnek:
54 gram suda, 64 gram metil alkol (CH3OH) çözünmüştür.
Oluşan çözeltide, maddelerin mol kesirlerini hesaplayınız. (H: 1 g/mol, O: 16 g/mol, C: 12 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
Kütlece %46’lık C2H5OH çözeltisinde, H2O ve C2H5OH’ın mol kesirlerini hesaplayınız. (H: 1 g/mol, O: 16 g/mol, C: 12 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
ppm (Milyonda Bir Kısım)
Kocaman bir baraj gölüne, bir tane çay şekeri yani kesme şeker attığımızı düşünelim. Şeker, gölde çözünür ve çok seyreltik bir şeker çözeltisi oluşur. Ama şeker, suya oranla o kadar azdır ki, derişimini yüzde olarak ya da molarite olarak hesaplamak istesek, çok çok küçük sayılar çıkacaktır.
- ppm, yukarıda bahsettiğimiz gibi çok seyreltik çözeltilerin derişimini ifade etmek için kullanılan derişim birimidir.
- “ppm” ifadesi; “part per million” ifadesinin kısaltmasıdır ve “milyonda bir kısım” anlamına gelmektedir.
- ppm derişiminin sembolü de ppm harfleridir, birimi de ppm harfleridir.
- Örnek olarak;
- bir çözeltinin derişimi 3 ppm ise, bu şöyle ifade edilir:
- ppm = 3 ppm
- bir çözeltinin derişimi 3 ppm ise, bu şöyle ifade edilir:
- Bir çözeltinin ppm değeri şöyle hesaplanır:

Formülde geçen sembollerin anlamı şöyledir:
- ppm: Çözeltinin ppm olarak derişimi
- mçözünen: Çözünen maddenin kütlesi
- mçözleti: Çözeltinin toplam kütlesi
- 106: Bir milyon demektir. (1 000 000)
- Bu formülü kullanırken, hangi kütle birimini kullandığınız önemli değildir, önemli olan ikisinin de aynı birimde olmasıdır.
ÖZEL DURUM:
Bir sulu çözeltide, çözünen madde miligram (mg), çözeltinin hacmi de Litre olarak alınırsa, o zaman, çözeltinin ppm’i şu şekilde hesaplanır:
ppm = çözünen maddenin miligramı / çözeltinin litresi
Örnek:
20 Litrelik bir sulu çözeltide, 640 miligram Ca2+ iyonu tespit edilmiştir.
Buna göre bu çözeltinin derişimi kaç ppm’dir?
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Örnek:
2 ton suda, 0,06 g NO3– iyonu tespit edilmiştir.
Buna göre, bu çözeltinin derişimi kaç ppm’dir?
Cevap
Örneğin çözümü:
Çözeltilerin Hazırlanması
Sıfırdan Bir Sulu Çözelti Hazırlamak
- Hazırlayacağımız çözelti ile ilgili olarak, bize şu bilgiler verilmelidir:
- Çözünen maddenin adı
- Çözücünün adı (Çözücünün hangi madde olacağı söylenmemişse çözücü sudur.)
- Çözeltinin hacmi
- Çözeltinin derişimi
- Bu bilgileri aldıktan sonra, istenen çözeltiyi hazırlamak için yapmamız gerekenler şunlardır:
- Çözünen maddenin miktarı hesaplanır. (Derişim formülleri ile)
- Terazi yardımı ile hesaplanan miktarda çözünen tartılır ve az bir miktar suda çözünür.
- Çözünen madde, çözeltinin hacmine uygun bir balon joje ya da başka bir dereceli kaba konulur, üzerine çözücü eklenerek hacmi istenen seviyeye getirilir.
- Bir kimya laboratuvarında en sık yapılan işlemlerden biri, çözelti hazırlamaktır.
- Bazen çözeltiler, sıfırdan hazırlanır bazen de stok çözeltiler yardımı ile hazırlanır.
Örnek:
0,1 M, 400 mL NaOH çözeltisi nasıl hazırlanır? (NaOH: 40 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Stok Çözelti Yardımı İle Bir Çözelti Hazırlamak

- Yüksek derişimli hazırlanıp satılan çözeltilere “stok çözelti” denir.
- Bir kimya laboratuvarındaki bir çok madde stok çözelti olarak bulunur.
- Bir stok çözeltinin etiketinde, derişimi hakkında bilgiler bulunur.
- Stok çözeltinin derişimi işimizi görmüyorsa, bu stok çözeltiden dilediğimiz derişimde bir çözelti elde edebiliriz.
- Molaritesi M1 ve hacmi V1 olan bir stok çözeltiden,
- Molaritesi M2 hacmi de V2 olan başka bir çözelti hazırlamak istersek şu formülü kullanabiliriz:
M1 . V1 = M2 . V2
Yukardaki formülde:
- M: Çözeltilerin molaritesidir.
- V: Çözeltilerin hacimleridir. Hacimler, aynı birimde olmalıdır.
Örnek:
Bir HCl stok çözeltisinin etiketinde, kütlece yüzdesinin %36,5 olduğu, yoğunluğunun ise 1,18 g/cm3 olduğu belirtiliyor.
Buna göre bu çözeltiden, 0,1 M ve 100 mL HCl çözeltisi nasıl hazırlanır? (HCl: 36,5 g/mol)
Cevap
Örneğin çözümü:
Bu bir reklamdır:
Çözeltilerin Karıştırılması
- Molaritesi M1 ve hacmi V1 olan bir çözelti ile
- Molaritesi M2 hacmi de V2 olan başka bir çözelti karışsın ve
- Bu ikisinin karışımından, her hangi bir çökelme olmadan, molaritesi Mson ve hacmi Vson olan bir çözelti elde edilsin.
- Bu durumda, bu üç çözelti arasında şöyle bir ilişki vardır:
Mson . Vson = M1 . V1 + M2 . V2 + M3 . V3
Vson, karışan çözeltilerin hacimlerinin toplamıdır:
Vson = V1 + V2 + V3
Yukardaki formülde:
- M: Çözeltilerin molaritesidir.
- V: Çözeltilerin hacimleridir.
- Hacimler, Litre biriminde olmak zorunda değildir fakat; hepsinin aynı hacim biriminde olması şarttır.
Örnek:
0,1 M, 400 mL NaOH çözeltisi ile 0,4 M 600 mL NaOH çözeltisi, bir çökelme olmadan karıştırılıyor.
Buna göre, oluşan çözeltinin derişimi kaç molardır?
Cevap
Örneğin çözümü:
Bu bir reklamdır:


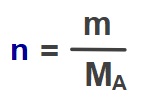 ise
ise
1 yorum: “2. Derişim Birimleri”