İçindekiler
- “Tepkime hızları“, tepkimelerin başladıktan sonraki hızları ile ilgili bir kavramdır.
- Bazı tepkimeler çok hızlı gerçekleşirken, bazıları çok yavaştır.
- Hava yastıklarının açılması veya bombaların patlaması gibi bazı kimyasal tepkimeler başladıkları anda biterler.
- Plastiklerin bozunması, bazı metallerin paslanması gibi tepkimelerin gerçekleşip sonlanması ise, yıllar hatta yüzyıllarca sürebilir.
- Tepkimelerin hızını ölçebilmek için; önce tepkimenin başlaması gerekir.
Şimdi gelin, moleküller aleminde, bir kimyasal tepkimenin, nasıl başladığını ve gerçekleştiğini anlamaya çalışalım.
Atom ve Moleküllerin Dünyasında Tepkimeler Nasıl Gerçekleşir?
- Tepkimeler, maddelerin kimyasal türleri arasında gerçekleşir.
- Kimyasal türler demek; atomlar, moleküller veya iyonlar demektir.
- Yani; aslında, kimyasal tepkimeler; atomlar veya moleküller veya iyonlar arasında gerçekleşir.
- İki kimyasal türün, nasıl tepkimeye girdiği “Çarpışma Teorisi” ile açıklanır.
Çarpışma Teorisi
- Çarpışma teorisine göre, kimyasal türlerin, bir tepkime verebilmesi için çarpışmaları şarttır.
- Çarpışmayan kimyasal türlerin, bir tepkime vermesi mümkün değildir.
- Fakat; kimyasal türlerin her çarpışması, bir kimyasal tepkime ile sonuçlanmaz.
- Tepkime ile sonuçlanan çarpışmalara “etkin çarpışma” denir.
- Etkin bir çarpışmanın gerçekleşmesi için, şu iki koşulun yerine gelmesi gerekir. Bunlar şunlardır:
1. Eşik Enerjisi
- Etkin bir çarpışmanın gerçekleşmesi için, kimyasal türlerin aşması gereken minimum enerjiye eşik enerjisi denir.
- Eşik enerjisine ulaşmayan kimyasal türlerin, bir tepkimeye girmesi mümkün değildir.
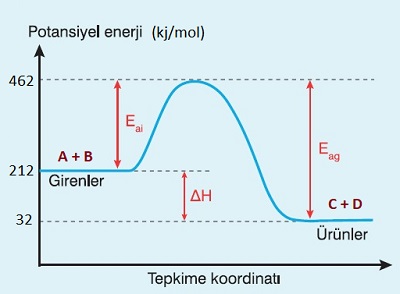
- Eşik enerjisi, Potansiyel Enerji – T.K grafiğini tepe noktasının enerji değeridir.
- Aşağıdaki grafik; X2 + Y2 → 2XY tepkimesine aittir. Bu grafik, bir önceki ünitede, ΔHo değerini hesaplamak için verdiğimiz, Potansiyel Enerji-TK grafiğinin ta kendisidir.

Eşik enerjisini, aşılması gereken bir dağ gibi düşünebiliriz. Zaten, grafik te bir dağa benziyor. Dağın tepesi, eşik enerjisini gösteren nokta olarak düşünülebilir. Girenlerdeki maddelerin ürünlere dönüşebilmesi için bu dağı aşması gereklidir.
- Eşik enerjisini, genellikle, maddeleri ısıtarak veririz.
- Mesela; kağıt 230oC’ye geldiğinde, havadaki oksijenle yanar.
- Kağıdı çakmak ya da kibrit yardımı ile, yaklaşık 230oC’ye kadar ısıttığımızda, gerekli eşik enerjisini vermiş oluruz.
- 230oC’ye kadar ısıtılan kağıt ve oksijen molekülleri, yeterli enerjiye ulaşmış olur ve yanma tepkimesi başlar, aksi taktirde bir yanma olayı gerçekleşmez.
- Tepkimedeki maddelerin, eşik enerjisine ulaşmaları için gereken enerjiye aktifleşme enerjisi, denir.
- Bir çok tepkime, geri yönde de gerçekleşebilir, yani ürünler de tepkimeye girerek girenlere dönüşebilir.
- İleri yöndeki tepkimenin aktifleşme enerjisine ileri aktifleşme enerjisi (Eai) denir.
- Geri yöndeki tepkimenin aktifleşme enerjisine geri aktifleşme enerjisi (Eag) denir.
- İleri ve geri aktifleşme enerjisi değerleri, Potansiyel Enerji-T.K grafiğine bakarak hesaplanabilir.
- Grafiğin çizildiği yön ileri tepkime yönüdür.
- Grafiğin sonundan başına doğru giden yön geri tepkime yönüdür.
- İleri tepkimenin ürünleri, geri tepkimenin girenleridir.
- İleri tepkimenin girenleri, geri tepkimenin ürünleridir.

- Bir tepkimenin ileri ve geri aktifleşme enerjileri yardımı ile, tepkime ısısı hesaplanabilir.
- Bunun için yapmamız gereken tek şey ileri aktifleşme enerjisinden geri aktifleşme enerjisini çıkarmaktır:
ΔHo = Eai – Eag
Örnek:
A2 + B2 → 2AB ΔH = +436 kj/mol
Yukarıda verilen tepkimenin ileri aktifleşme enerjisinin 790 kj/mol olduğu biliniyor.
Buna göre bu tepkimenin geri aktifleşme enerjisi kaç kj/mol’dür?
A) -354
B) 354
C) -1226
D) 1226
E) -790
Cevap
Örneğin çözümü:
2. Uygun Geometride Çarpışma
- Kimyasal türlerin, tepkimeye girebilmeleri için, belli bir eşik enerjisin aşmaları gerektiğini öğrendik.
- Fakat; eşik enerjisini aşmaları, iki kimyasal türün, kesin olarak tepkimeye girecekleri anlamına gelmez.
- Yeterli enerjiye sahip olan atom ya da moleküllerin, bir de uygun bir geometride çarpışmaları gerekir.
- Yani, oluşacak üründe, hangi atomlar birbirine bağlanacaksa, o atomların birbirine çarpması gerekir.
- Uygun geometride ve yeterli enerji ile çarpışan kimyasal türler, ürünlere dönüşürse, etkin çarpışma gerçekleşmiş olur.
- Etkin bir çarpışmada, önce bütün atomlar arasında zayıf etkileşimler kurulur ve kararsız bir molekül oluşur.
- Bu moleküle “aktifleşmiş kompleks” denir.
- Aktifleşmiş kompleksteki bağlar:
- Ürünleri oluşturacak şekilde kırılırsa tepkime gerçekleşmiş olur ve ürünler oluşur.
- Yanlış bir yerinden kırılırsa, ürünler oluşmaz ve tepkime gerçekleşmez.
- Yani, aktifleşmiş kompleksin oluşması da, tepkimenin garanti gerçekleştiği anlamında gelmez.
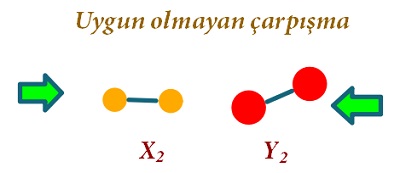
Aşağıdaki şekilde; X2 + Y2 → 2XY tepkimesine ait, etkin çarpışma senaryosu çizilmiştir.

Aşağıdaki grafikte; X2 + Y2 → 2XY tepkimesine ait, etkin çarpışma senaryosu gösterilmiştir:

- Uygun bir geometride olmayan çarpışmalar, kimyasal türlerin enerjisi yeterli olsa bile, ürünle sonuçlanmaz, tepkime gerçekleşmez.
- Böyle çarpışmalara, etkin olmayan çarpışmalar denir.
Aşağıdaki çarpışmadan 2 tane XY molekülü molekülünün oluşması mümkün değildir:
Öğretici Örnek:
Gelin, şu ana kadar öğrendiğimiz kavramları, endotermik ve ekzotermik tepkimelerin enerji grafikleri üzerinde ayrı ayrı görelim:
Aşağıda, ekzotermik A2 + B2 → 2AB + ısı tepkimesine ait, Potansiyel Enerji – Tepkime Koordinatı grafiği üzerinden, öğrendiğimiz kavramlar gösterilmiştir:

Aşağıda, endotermik 2AB + ısı → A2 + B2 tepkimesine ait, Potansiyel Enerji – Tepkime Koordinatı grafiği üzerinden, öğrendiğimiz kavramlar gösterilmiştir:

Örnek:

Yukarıdaki grafik, bir kimyasal tepkimenin Potansiyel Enerji – Tepkime Koordinatı grafiğidir.
Buna göre, bu tepkime için aşağıdaki soruları cevaplayınız.
I) Tepkimenin eşik enerjisi kaçtır?
II) Tepkimenin ileri aktifleşme enerjisi (Eai) kaçtır?
III) Tepkimenin geri aktifleşme enerjisi (Eag) kaçtır?
IV) Tepkimenin ΔH değeri kaçtır?
V) Geri tepkimenin ileri aktifleşme enerjisi kaçtır?
Cevap
Örneğin çözümü:
Örnek:
Bir kimyasal tepkimede aşağıdaki olaylardan hangisi gerçekleşirse, etkin bir çarpışma gerçekleşmiş demektir?
A) Girenlerin yeterli enerjiye sahip olması
B) Girenlerin uygun geometride çarpışması
C) Girenlerin yeterli enerjide ve uygun geometride çapışması
D) Aktifleşmiş kompleksin oluşması
E) Aktifleşmiş kompleksin uygun yerinden kırılması
Cevap
Örneğin çözümü:
Tepkime Hızının Takibi
- Kimyasal tepkimeler gerçekleştikçe; bazı şeyler değişir.
- Hızlı gerçekleşen tepkimelerde bu değişimler hızlı olur, yavaş gerçekleşen tepkimelerde yavaş olur.
- Mesela, elbiselerin solması tepkimesinde, renk değişimini takip ederek, tepkimenin hızını görebiliriz.
- Elbiselerin solması yılarca sürebilmektedir. Bu yüzden solma tepkimesi yıllarca devam eden yavaş bir tepkimedir diyebiliriz.
- Havai fişeğin patlayıp tamamen sönmesi tepkimesinde de kıvılcımların oluşma ve sönme hızına bakarak, tepkime hızını takip edebiliriz.
- Mesela, elbiselerin solması tepkimesinde, renk değişimini takip ederek, tepkimenin hızını görebiliriz.
- Tepkime hızlarını takip etmenin bir çok yolu vardır. Çünkü tepkimelerde maddelerin değişen bir çok özelliği vardır. Bu özelliklerin değişme hızına bakarak tepkimelerin hızlarını anlayabiliriz.
- Tepkime hızını takip etmek için kullanılabilecek bazı özellikler şunlardır:
- Hacim değişimi
- Basınç değişimi
- Renk değişimi
- İletkenlik değişimi
- Gaz çıkış hızı
Farklı tepkimelerin hızlarını takip etmek için farklı özelliklerden yararlanılabilir. Aşağıda tepkime hızını takip etmek için kullanılan bazı yollar verilmiştir.
1. Hacim Değişimiyle Hız Takibi
- Hacim değişimi ile hız takibi yapılabilen tepkimelerde, gazlara dikkat edilir.
- Girenlerdeki gazların toplam sayısı ile ürünlerdeki gazların toplam sayısı farklı olmalıdır ki hacim değişebilsin.
- Mesela:
- 3 tane gaz molekülü 2 tane gaz molekülüne dönüşüyorsa bu tepkimede hacim azalır:
- 3A(g) → 2B(g)
- 3 tane gaz molekülü 4 tane gaz molekülüne dönüşüyorsa bu tepkimede hacim artar:
- 3A(g) → 4B(g)
- 3 tane gaz molekülü 3 tane gaz molekülüne dönüşüyorsa bu tepkimede hacim değişmez:
- 3A(g) → 3B(g)
- 3 tane gaz molekülü 2 tane gaz molekülüne dönüşüyorsa bu tepkimede hacim azalır:
- Mesela:
- Girenlerdeki gazların toplam sayısı ile ürünlerdeki gazların toplam sayısı farklı olmalıdır ki hacim değişebilsin.
- Hacim değişimi ile hız takibi yapabilmek için:
- Tepkimede en az bir tane gaz olmalı
- Tepkime sabit basınç altında (ideal pistonlu kapta ya da elastik balonda) gerçekleşmelidir.
- Sabit hacimli kaplarda gerçekleşen tepkimelerde, hacim değişemeyeceği için, tepkime hızını hacim değişimini takip ederek anlamak mümkün değildir.
Öğretici Örnek:
Aşağıdaki tepkime, pistonlu veya balonlu bir kapta gerçekleşirse, tepkime hızı, hacim artışı ile takip edilebilir:
Zn(k) + 2HCl(suda) → ZnCl2(suda) + H2(g)
- Yukardaki tepkimenin girenler kısmında hiç gaz yoktur, ürünler kısmında bir tane gaz vardır.
- Bu yüzden, bu tekime gerçekleştikçe gaz miktarı artar.
- Gaz arttıkça da hacim artar.
- Tepkime hızlı gerçekleşirse hacim hızlı artar, yavaş gerçekleşirse yavaş artar.
- Bu yüzden bu tepkimenin hızını hacim değişimine bakarak anlayabiliriz.
2. Basınç Değişimiyle Hız Takibi
- Bir tepkimenin hızı, hacim değişimi ile takip edilebiliyorsa, basınç değişimi ile de takip edilebilir.
- Bunun için tepkimenin, sabit hacimli bir kapta gerçekleşmesi yeterlidir.
Öğretici Örnek:
N2(g) + 3H2(g) → 2NH3(g)
- Yukardaki tepkimede, toplam 4 tane gazdan 2 tane gaz oluşuyor.
- Yani, tepkime gerçekleştikçe gaz miktarı azalıyor.
- Sabit hacimde iken, bu tepkime gerçekleştikçe, gaz miktarı ve gaz basıncı azalacaktır.
- Tepkime ne kadar hızlı ise bu olaylar o kadar hızlı olacaktır.
Örnek:
H2(g) + Cl2(g) → 2HCl(g) + ısı
Yukarıdaki tepkime için aşağıdakilerden hangisi yanlıştır?
A) Bir sentez tepkimesidir.
B) Tepkime hızı hacim değişimi ile takip edilebilir.
C) Ekzotermik bir tepkimedir.
D) Ürünlerin enerjisi daha azdır.
E) Eag değeri Eai değerinden daha büyüktür.
Cevap
Örneğin çözümü:
3. Renk Değişimiyle Hız Takibi
- Tepkimeye girenler ve ürünler aynı renkte değilse, renk değişimi, tepkime hızı hakkında fikir verir.
Öğretici Örnek:
Aşağıdaki tepkime, ne kadar hızlı ise kahverengi renk, o kadar hızlı kaybolacaktır:
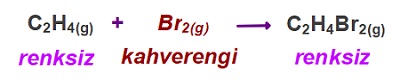
4. İletkenlik Değişimiyle Hız Takibi
- Ürünler ile girenlerin elektrik iletkenliği farklı ise, tepkime gerçekleştikçe iletkenlik de değişecektir. Böyle tepkimelerin hızı, iletkenlik değişimi ile ölçülebilir.
- Elektriği ileten maddeler şunlardır:
- Katı ve sıvı metaller:
- Na, Ca, Mg, Al….
- Karbonun grafit formu (C(grafit))
- Suda çözünmüş iyonlar:
- Na+(suda),
- SO42-(suda)
- Cl–(suda)
- …..
- Sıvı haldeki tuzlar:
- NaCl(s)
- CaBr2(s)
- BaSO4(s)
- ….
- Katı ve sıvı metaller:
Öğretici Örnek:
Aşağıdaki tepkime ne kadar hızlı ise, iletkenlik o kadar hızlı azalacaktır:
Ag+(suda) + Cl–(suda) → AgCl(k)
5. Gaz Çıkış Hızıyla Hız Takibi
- Bir kimyasal tepkimenin sadece ürünlerinde gaz varsa, bu tepkimenin hızı, gaz çıkış hızı ile ölçülebilir.
Öğretici Örnek:
Ca(k) + HCl(suda) → CaCl2(suda) + H2(g)
Yukarıdaki tepkime, ne kadar hızlı gerçekleşirse o kadar hızlı bir gaz çıkışı olur.
- Hızları takip edildiğinde görülecektir ki, bütün tepkimeler hızlı başlar, zamanla yavaşlar.
- Bir kimyasal tepkimenin en hızlı olduğu an, başladığı andır.

Tepkimedeki Maddelerin Oluşma ve Harcanma Hızları
- Kimyasal tepkimeler gerçekleştikçe,
- tepkimeye giren maddelerin miktarı azalır,
- ürünlerdeki maddelerin miktarı artar.
- Hızlı gerçekleşen bir kimyasal tepkimede, girenler hızlı bir şekilde tükenir, ürünler hızlı bir şekilde üretilir.
- Aynı şekilde yavaş gerçekleşen bir tepkimede de, maddelerin miktarı yavaş bir şekilde değişecektir.
- Tepkimelerin hızı, tepkimedeki her hangi bir maddenin miktarının zamanla değişme hızına bakılarak da hesaplanabilir.
- Bir tepkimedeki maddelerin, zamanla değişme hızlarına, tepkime hızı denir.
Tepkimedeki herhangi bir maddenin hızını hesaplamak için, aşağıdaki formül kullanılabilir:

Formüldeki sembollerin anlamları şöyledir:
- r: Maddenin hızıdır. Bazen “r” yerine “ϑ” sembolü de kullanılır.
- ΔC: Maddenin derişimindeki (konsantrasyonundaki) değişim
- ΔC = Cson – Cilk
şeklinde hesaplanır. Hız hesaplanırken, derişim birimi olarak genellikle Molarite (M) kullanılır. - Köşeli parantez Molaritesi demektir:
[N2] = Azotun molaritesi
[Na+] = Na+ iyonunun molaritesi
[NH3] = NH3 bileşiğinin molaritesi
[H2] = Hidrojenin molaritesi - “Δ” işareti, değişim demektir:
Molarite değişimleri de şöyle ifade edilir:
Δ[H2] = [H2]son – [H2]ilk
Δ[NH3] = [NH3]son – [NH3]ilk
Δ[Na+] = [Na+]son – [Na+]ilk
…
- ΔC = Cson – Cilk
- Δt: Geçen süre
Tepkimelerdeki Maddelerin Ortalama Hızları
- Ortalama hız, bir maddenin birim zamanda değişen molaritesi olarak ifade edilebilir.
- Bir tepkimedeki her bir maddenin bir ortalama hızı vardır.
Öğretici Örnek:
Örnek olarak NH3 (Amonyak) bileşiğinin oluşum tepkimesini inceleyelim:
N2 + 3H2 → 2NH3
Molaritelerindeki değişim üzerinden, tepkimedeki her üç maddenin de teker teker ortalama hız bağıntısını yazalım:



Yukarıdaki formülde, dilersek; rN2, rH2 ve rNH3 ifadeleri yerine “rort” da yazabiliriz.
“rort“, ortalama hız demektir.
- Dikkat edilirse; tepkimeye giren maddelerin hız formüllerinde “eksi” işareti vardır.
- Bu eksi işareti, “harcanma hızı” anlamına gelir.
- Harcanma hızı negatiftir, çünkü; girenlerin derişimi zamanla azalır, bu da değişimin negatif olmasına sebep olur.
- Formüldeki eksi işareti, bu negatifi tekrar pozitif yapmak içindir.
- Giren maddelerin, molarite değişimlerini pozitif alırsak, bu eksi işaretine gerek kalmaz.
Örnek:
N2 + 3H2 → 2NH3
Yukarıda verilen tepkime, 2,4 M H2 gazı ile başlamıştır. Tepkime başladıktan 20 saniye sonra, kaptaki H2 gazının derişimi 0,4 M olarak ölçülüyor.
Buna göre, bu tepkimenin ilk 20 saniyesinde, H2 gazının ortalama harcanma hızı kaç M/s’dir.
A) 1
B) 10-1
C) 10-2
D) 10-3
E) 10-4
Cevap
Örneğin çözümü:
Örnek:

Yukarıdaki grafik, bir kimyasal tepkimedeki maddelerin, zamana karşı molarite değişimini göstermektedir.
Buna göre, bu tepkime için aşağıdaki soruları cevaplayınız.
a) X2 maddesinin ilk 10 saniyedeki ortalama harcanma hızı kaç M/s’dir?
b) XY bileşiğinin ilk 10 saniyedeki ortalama oluşma hızı kaç M/s’dir?
Cevap
Örneğin çözümü:
Tepkimenin Ortalama Hızı
- Tepkimedeki herhangi bir maddenin ortalama hızını, katsayısına bölersek, tepkimenin ortalama hızını bulmuş oluruz.
- Bir tepkimenin ortalama hızına rort dersek, formül şöyle olur:

- Yani; bir tepkimenin hızı, katsayısı 1 olan maddenin hızı demektir.
Örnek:
N2 + 3H2 → 2NH3
Yukarıda verilen tepkime, 14,4 M H2 gazı ile başlamıştır. Tepkime başladıktan 20 saniye sonra, kaptaki H2 gazının derişimi 2,4 M olarak ölçülüyor.
Buna göre, bu tepkimenin ilk 20 saniyedeki ortalama hızı kaç M/s’dir.
A) 10-1
B) 2.10-1
C) 4.10-1
D) 6.10-1
E) 8.10-1
Cevap
Örneğin çözümü:
Maddelerin Farklı Birimlerle Hızını Hesaplama
- Ortalama hız hesaplanırken, molarite değişimi dışında şu özellikler de kullanılabilir:
- mol sayısı değişimi
- hacim değişimi
- kütle değişimi
- Hızın nasıl hesaplanacağını, sorunun sonunda sorulan hız birimine dikkat ederek, anlayabiliriz.
- Maddenin hızı aşağıdaki birimlerde sorulabilir:
- mol/s veya mol.s-1 : Mol sayısındaki artma ya da azalmayı geçen saniyeye bölerek hız bulunacak.
- mol/dak veya mol.dak-1 : Mol sayısındaki artma ya da azalmayı geçen dakikaya bölerek hız bulunacak.
- Litre/s veya L.s-1 : Litre olarak hacimdeki artma ya azalmayı geçen saniyeye bölerek hız bulunacak.
- …
Örnek:
2Na(k) + H2O(s) → Na2O(k) + H2(g)
Yukarıdaki tepkime denklemine göre; 100 saniyede, 4 mol Na katısı tükenmektedir.
Buna göre, aynı süre içinde, H2 gazının ortalama oluşma hızı kaç mol.s-1‘dir?
A) 10-2
B) 2.10-2
C) 4.10-2
D) 6.10-2
E) 8.10-2
Cevap
Örneğin çözümü:
Örnek:

A) 1
B) 2
C) 3
D) 4
E) 5
Cevap
Örneğin çözümü:
Tepkimedeki Maddelerin Hızları Arasındaki İlişki
- Bir kimyasal tepkimdeki her bir maddenin hızı, katsayısı ile doğru orantılıdır.
- Yani katsayısı en büyük olan maddenin hızı, en büyük; katsayısı en küçük olan maddenin hızı ise en küçüktür.
- Tepkimedeki maddelerden birinin hızını biliyorsak, katsayıların oranını kullanarak, diğer maddelerin de hızını bulabiliriz.
UYARI!
- Katsayıların oranları:
- Kütle için kullanılmaz.
- Mol için kullanılabilir.
- Gazların hacminde ve molaritesinde kullanılabilir.
- Aynı çözeltide çözünmüş maddelerin molaritesinde kullanılabilir.
Öğretici Örnek:
- N2 + 3H2 → 2NH3 tepkimesi gerçekleşirken:
- N2 nin ortalama harcanma hızı V ise
- H2 nin ortalama harcanma hızı 3V’dir,
- NH3‘ün ortalama oluşma hızı da 2V’dir.
- Bir kimyasal tepkimedeki maddelerin hızlarını birbirine eşitlememiz gerekirse:
- Her maddenin hızını katsayısına böleriz. Böylece, herkesin hızı eşit olur.
- Veya katsayıları payda eşitler gibi eşitleriz. Bu eşitliği, hızlar arasındaki eşitlik olarak kullanılırız.
Öğretici Örnek:
N2 + 3H2 → 2NH3
Yukarıda verilen tepkime denklemine göre, tepkimedeki maddelerin hızları arasındaki ilişki şöyledir:

- Yukarıdaki eşitlikte, girenlerdeki maddelerin hızının önüne, “eksi” işareti koymayı unutmadık. Eksi işareti bize, maddelerin harcandığını söyler.
- Yukarıdaki eşitlik 6 ile genişletilirse, aşağıdaki eşitlik elde edilir. Yani, dilersek, yukarıdaki eşitliği şöyle de ifade edebiliriz:

Örnek:
4NO2 + O2 → 2N2O5
tepkimesinde, O2‘nin ortalama harcanma hızı 0,024 mol/L.s’dir. Buna göre;
a) NO2‘nin ortalama harcanma hızını hesaplayınız.
b) N2O5‘in ortalama oluşma hızını hesaplayınız.
Cevap
Örneğin çözümü:
Tepkimelerdeki Maddelerin Anlık Hızları
“Anlık Hız” kavramı, AYT kimyasından çıkarılmıştır. Fakat, bazı testlerde karşımıza çıkarsa şaşırmamak için, kısaca bilmekte fayda vardır.
Ortalama hız için, belli bir zaman aralığındaki hızların ortalamasıdır, demiştik. Anlık hız ise; belli bir andaki hızdır.
Bir tepkimenin hızı, farklı anlarda farklı değerler alabilir. Genellikle, tepkimeler hızlı bir şekilde başlarlar, zamanla yavaşlarlar. Belli bir süre sonra da, tepkime ya biter, ya da dengeye ulaşır. Bir tepkimenin dengeye ulaşmasının ne demek olduğundan bir sonraki ünitede bahsedeceğiz.
Bir maddenin anlık hızını hesaplamak için, bu maddenin, hız-zaman grafiğine ihtiyacımız vardır. Hız-zaman grafiğinde, hangi andaki hızı merak ediyorsak, o andaki hız değerine bir teğet çizmeliyiz. Çizdiğimiz teğetin eğimi, bize o maddenin o andaki hızını verecektir.
Homojen ve Heterojen Faz Tepkimeleri
Tepkimeler, girenlerin ve ürünlerin fiziksel hallerine göre ikiye ayrılır:
- Homojen Faz Tepkimeleri
- Heterojen Faz Tepkimeleri
I. Homojen Faz Tepkimeleri
- Tepkimedeki ürünler ve girenler hep birlikte homojen bir karışım oluşturuyorlar ise; tepkime bir homojen faz tepkimesidir.
- Gazlar, her zaman homojen karışırlar, bu yüzden, tamamen gazlardan oluşan tepkimeler homojen faz tepkimeleridir:
- CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
- N2(g) + 3H2(g) → 2NH3(g)
- Tepkimedeki bütün maddeler suda çözünmüş halde ise, tepkime bir homojen faz tepkimesidir. (Tepkimede H2O(s)‘nın olması, bu tür tepkimelerin homojen olmasına engel değildir):
- HCl(suda) + NaOH(suda) → NaCl(suda) + 2H2O(s)
- Fe3+(suda) + SCN–(suda) → FeSCN2+(suda)
II. Heterojen Faz Tepkimeleri
- Tepkimedeki ürünler ve girenler hep birlikte heterojen bir karışım oluşturuyorlar ise; tepkime bir heterojen faz tepkimesidir.
- Tepkimede; farklı fazlarda maddeler varsa, bu tepkimler heterojen tepkimelerdir:
- Ca(k) + HCl(suda) → CaCl2(suda) + H2(g)
- Ag+(suda) + Cl–(suda) → AgCl(k)
- Na2O(k) + H2O(s) → 2NaOH(suda)



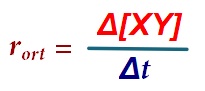
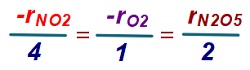


mustafa hakkı says:
harika bir site , ancak pek öne çıkmamış niyeyse, demek ki her zaman öne çıkanlarda değil en güzel siteler.
Gökalp AY says:
Güzel düşünceleriniz için çok teşekkürler.
Enes says:
Elinize sağlık.
Nurzat says:
Çok güzel olmuş emeğiniz için teşekkür ederim…
Gökalp AY says:
Teşekkürler 🙂
Dulunistar says:
Harikaaaaaaaaa.
Önerim soru sayısının fazla olması
Youtube felan gerek kalmadan anlaşılıyormuş demek ki bir şeyler
kerem says:
iyi ki kesfettim bu siteyi
giorno says:
en sevdiğim konu anlatımı sitesi. 😀 ayt konularını kitaplar çok tekdüze ve ezber anlatıyor mantığını öğretmiyor. bu sitede verilen her bilginin mantığını bi şekilde açıklıyorlar
baturalp says:
soru sayısı daha fazla olursa 10/10 site şu an 9.5/10 harikasınız