Kimyasal Tepkimelerde Hız → 2. Bölüm
İçindekiler
- 2.Bölüm: Tepkime Hızını Etkileyen Faktörler
- Tepkimelerin Hız Bağıntıları (r)
- Tepkimelerin Hız Bağıntıları
- Tepkimedeki Maddelerin Derecesi (Mertebesi)
- Tepkimelerin Derecesi (Mertebesi) – Moleküleritesi
- Hız Sabitinin Birimi
- Çok Basamaklı (Mekanizmalı) Tepkimelerin Hız Bağıntısı
- Çok Basamaklı (Mekanizmalı) Tepkimelerin Hız Bağıntısı
- Mekanizmalı Tepkimelerde Ara Ürün ve Katalizör
- Mekanizmalı Tepkimelerin Potansiyel Enerji Grafiği
- Çok Basamaklı (Mekanizmalı) Tepkimelerin Hız Bağıntısı
- Tepkime Hızına Etki Eden Faktörler
- Tepkime Hızına Etki Eden Faktörler
- Tepkime Hızına Etki Eden Faktörler
- Tepkime Hızına Etki Eden Faktörler
- Tepkime Hızına Etki Eden Faktörler
- Tepkime Hızına Etki Eden Faktörler
- Tepkime Hızına Etki Eden Faktörler
- Tepkime Hızına Etki Eden Faktörler
DERS
AYT Kimya
Kimya 11
KONU
ÜNİTE V
KİMYASAL TEPKİMELERDE HIZ
II. Bölüm
2.Bölüm: Tepkime Hızını Etkileyen Faktörler
Dersin Özellikleri:
- Gerekli Bilgiler:
- Kimyasal Tepkimelerde Hız – 1. Bölüm
- Öğretmen:
- Muzaffer KAYA
Anlatılacak Başlıklar*:
- Tepkimelerin Hız Bağıntısı
- Tepkimedeki Maddelerin Derecesi
- Tepkimelerin Derecesi (Mertebesi) – Moleküleritesi
* Konu anlatımı, örneklerle zenginleştirilmiştir.
Tepkimelerin Hız Bağıntıları (r)
- Tepkimelerin (başlangıç) hızını veren formüle hız bağıntısı denir.
- Her tepkimenin hız bağıntısı farklıdır.
- Hız bağıntısı şuna göre yazılır:
r = k.[Giren]katsayısı . [Giren]katsayısı…
- Bağıntıdaki semboller şu anlama gelir:
- r = Tepkime hızıdır. Birimi M/s (Molar/saniye) dir.
- k = Hız sabitidir.
- [Giren]katsayısı = Giren maddenin (reaktif) molaritesi ve katsayısıdır.
- Hız bağıntısına katı ve sıvılar giremez.
- Suda çözünmüş maddeler ve gazlar girebilir.
Örnek:
N2(g) + 3H2(g) → 2NH3(g)
Tepkimenin hız bağıntısı r = k.[N2].[H2]3
Örnek:
2Na(k) + 2HCl(suda) → 2NaCl(suda) + H2(g)
Tepkimenin hız bağıntısı r = k.[HCl]2
Tepkimelerin Hız Bağıntıları
Örnek:
Verilen tepkimelerin hız bağıntılarını yazınız.
Zn(k) + 2HCl(suda) → ZnCl2(suda) + H2(g)
Ag+(suda) + Cl–(suda) → AgCl(k)
Ca(k) + H2O(s) → CaO(k) + H2(g)
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
4NO2(g) + O2(g) → 2N2O5(g)
CO(g) + 1/2O2(g) → CO2(g)
Örnek:
Hız bağıntısı r = k.[A].[B]2 şeklinde olan tek basamaklı bir tepkime aşağıdakilerden hangisi olabilir?
A) A(g) + 2B(s) → C(g)
B) A(k) + 2B(suda) → C(g)
C) A(suda) + 2B(s) → C(g)
D) A(s) + 2B(suda) → C(g)
E) A(g) + 2B(suda) → C(g)
Tepkimedeki Maddelerin Derecesi (Mertebesi)
- Bir maddenin hız bağıntısındaki üssüne o maddenin derecesi veya mertebesi denir.
- Maddeler tepkime hızını derecelerine göre etkiler.
Örnek:
- 4NO2(g) + O2(g) → 2N2O5(g)
tepkimesinin:- Hız bağıntısı:
- r = k.[NO2]4.[O2]
- Tepkime NO2‘ye göre 4. derecedendir.
- Mesela NO2‘nin derişimi 2 kat artarsa tepkime 16 (24) kat hızlanır.
- Tepkime O2‘ye göre 1. derecendir.
- Mesela O2‘nin derişimi 2 kat artarsa tepkime 2 kat hızlanır.
- Hız bağıntısı:
Örnek:
- Zn(k) + 2HCl(suda) → ZnCl2(suda) + H2(g)
tepkimesinin:- Hız bağıntısı:
- r = k.[HCl]2
- Tepkime HCl’ye göre 2. derecedendir.
- Mesela HCl‘nin derişimi 2 kat artarsa tepkime 4 (22) kat hızlanır.
- Tepkime, Zn’ye göre 0. derecedendir.
- Zn tepkime hızını etkilemez.
- Hız bağıntısı:
Tepkimelerin Derecesi (Mertebesi) – Moleküleritesi
- Hız bağıntısındaki maddelerin üslerinin toplamına tepkimenin derecesi denir.
- Girenlerin katsayılarının toplamına tepkimenin moleküleritesi denir.
- Unimoleküler tepkime: Moleküleritesi 1’dir.
- Dimoleküler (bimoleküler) tepkime: Moleküleritesi 2’dir.
- Trimoleküler tepkime: Moleküleritesi 3’tür…
- Tetramoleküler tepkime: Moleküleritesi 4’tür…
Örnek:
Tepkime:
4NO2(g) + O2(g) → 2N2O5(g)
- r = k.[NO2]4.[O2]
- Maddelerin üsleri toplamı 4+1 = 5 yapar.
- Tepkime 5. derecedendir.
- Tepkimenin moleküleritesi: 5
Örnek:
Tepkime:
CaCO3(k) → CO2(g) + CaO(k)
- r = k
- Hız ifadesinde, madde yok.
- Bu yüzden, tepkime 0. derecedendir.
- Tepkimenin moleküleritesi: 1
Hız Sabitinin Birimi
- Tepkimenin derecesini biliyorsak, hız sabitinin (k) birimini şöyle bulabiliriz:

veya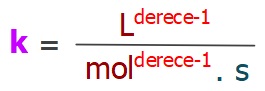
veya- k = L(derece -1) . mol– (derece -1) . s-1
- Formülde:
- k: hız sabiti
- derece: Tepkimenin derecesi
- M: Molarite (mol/L)
- L: Litre
- s: Saniye
Örnek:
4NO2(g) + O2(g) → 2N2O5(g)
Yukarıda verilen tepkimenin hız sabitinin birimi aşağıdakilerden hangisidir?
A) L . mol-1 . s-1
B) L2 . mol-2 . s-1
C) L3 . mol-3 . s-1
D) L4 . mol-4 . s-1
E) L5 . mol-5 . s-1
Çok Basamaklı (Mekanizmalı) Tepkimelerin Hız Bağıntısı
- Birden çok tepkimenin toplamı şeklinde gerçekleşen tepkimelere çok basamaklı (adımlı-mekanizmalı) tepkimeler denir.
- Mekanizmalı tepkimelerin basamaklarına tepkimenin izlediği yol denir.
- Basamaklar toplanınca net tepkime elde edilir.
- Toplarken aynı maddeler karşılıklı olarak sadeleştirilir.
- Net tepkimenin hız bağıntısı yavaş adımın hız bağıntısına eşittir.
Örnek:

- Net tepkimenin hız bağıntısı:
- r = [NO2].[F]
Çok Basamaklı (Mekanizmalı) Tepkimelerin Hız Bağıntısı
Örneğin:
1. Basamak: NO(g) + Br2(g) → NOBr2(g) (Yavaş)
2. Basamak: NO(g) + NOBr2(g) → 2NOBr(g) (Hızlı)
Yukarıda mekanizması verilen tepkimenin denklemini ve hız bağıntısın bulunuz.
Mekanizmalı Tepkimelerde Ara Ürün ve Katalizör
Ara Ürün ve Katalizör
- Katalizör: Tepkimeleri hızlandırmak için kullanılan kimyasallardır.
- Tepkimeden girdiği gibi çıkar.
- Tepkimeler toplanırken sadeleşir.
- Ara ürün: Bir basamakta oluşu diğerinde harcanan kimyasaldır.
- Önce çıkar sonra girer.
- Tepkimeler toplanırken sadeleşir.
Örnek:
Aşağıda, mekanizmalı bir tepkimenin adımları (basamakları da denir) verilmiştir.

Buna göre, bu tepkime için aşağıdaki soruları cevaplayınız.
a) Net tepkimeyi bulunuz.
b) Ara ürünleri bulunuz.
c) Tepkimenin katalizörünü bulunuz.
Mekanizmalı Tepkimelerin Potansiyel Enerji Grafiği
Tek Basamaklı Tepkime

Çok Basamaklı (Mekanizmalı) Tepkime
- Tepe sayısı basamak sayısını verir.
- Çukurların dibi, bir basamağın bittiği diğerinin başladığı noktalardır.
- İleri aktifleşme enerjisi düşük olan basamak daha hızlıdır.
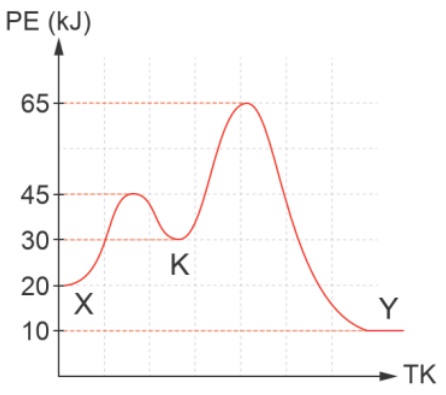
Çok Basamaklı (Mekanizmalı) Tepkimelerin Hız Bağıntısı
Örnek:

Yanda grafiği verilen kimyasal tepkime için, aşağıdaki soruları cevaplandırınız.
I) Basamak sayısı kaçtır?
II) 2. basamağın ileri aktifleşme enerjisi kaçtır?
III) 3. basamağın tepkime denklemi nedir?
IV) 1. basamağın geri aktifleşme enerjisi kaçtır?
V) 2. basamağın tepkime ısısı kaçtır?
VI) 2. basamağın geri tepkimesinin ileri aktifleşme enerjisi kaçtır?
VII) Net tepkime denklemi nedir?
VIII) Tepkimenin hızını belirleyen basamak hangisidir?
IX) Tepkimenin hız bağıntısı nedir? (Bütün maddeler gazdır.)
Tepkime Hızına Etki Eden Faktörler
- Tepkime hızı şunlardan etkilenir:
- Madde Cinsi
- Derişim
- Sıcaklık
- Basınç-Hacim
- Temas Yüzeyi
- Katalizör
1. Madde Cinsi
- Asit-baz tepkimeleri, çökelme tepkimeleri zıt yüklü iyonlar arasında gerçekleşir ve çok hızlı tepkimelerdir.
- Atomların yüklerinin değiştiği tepkimeler (redoks tepkimeleri), hızlı tepkimelerdir.
- Gazların tepkimeleri katı ve sıvıların tepkimelerinden daha hızlıdır.
- Reaktiflerin (girenlerin) katsayıları büyüdükçe tepkimeler yavaşlar.
Tepkime Hızına Etki Eden Faktörler
2. Derişim
- Katı ve sıvıların derişimleri sabittir.
- Bu yüzden hızı etkilemezler.
- Hız bağıntısına da girmezler.
- Hız bağıntısına giren her bir madde (gaz ve suda çözünmüş maddeler), bağıntıdaki üssü ile orantılı olarak hızı etkiler.
Örnek:
r = k . [A] . [B]2 . [C]3
Hız bağıntısı yukarıdaki gibi olan bir tepkime için aşağıdaki soruları cevaplandırınız.
I) A’nın derişimi 4 kat artarsa tepkime kaç kat hızlanır?
II) B’nin derişimi 3 katına çıkarsa tepkime kaç kat hızlanır?
III) A’nın derişimi 3 kat, C’nin ise 2 kat artarsa tepkime kaç kat hızlanır.
IV) A, B ve C’nin derişimleri yarıya inerse tepkime kaç kat yavaşlar?
Tepkime Hızına Etki Eden Faktörler
Örnek:
Aşağıdaki tabloda, 2NO(g) + F2(g) → 2NOF(g) tepkimesine ait deney sonuçları verilmiştir.

Bu deney sonuçlarına göre, aşağıdaki soruları cevaplayınız.
a) Tepkimenin hız denklemi yazınız.
b) Tepkimenin mertebesini yazınız.
c) Hız sabitini hesaplayınız.
Tepkime Hızına Etki Eden Faktörler
3. Hacim
- Hacim, sadece gazların hızlarını etkiler.
- Hacim değişikliği Molariteyi etkiler, o da hızı etkiler.
- Molarite ile hacim ters orantılıdır.
- Hacim kaç kat azalırsa molarite o kadar kat artar.

Örnek:

Sürtünmesiz ideal bir pistonda, A2(g) + B2(g) → 2AB(g) tepkimesi gerçekleşirken kaba, aşağıdaki etkiler yapılıyor.
I) Piston yukarı çekiliyor.
II) Sabit sıcaklıkta, sisteme He gazı ekleniyor.
III) Piston sabitlenip, sıcaklık arttırılıyor.
Buna göre tepkimeye yapılan bu etkiler, tepkime hızını nasıl etkiler?
Tepkime Hızına Etki Eden Faktörler
4. Sıcaklık
- Sıcaklık artışı:
- Bütün tepkimeleri hızlandırır.
- Hız sabitini (k) arttırır.
- Ortalama kinetik enerji arttırır.
- Kimyasal türlerin hızını arttırır.
- Etkin çarpışma sayısın arttırır.
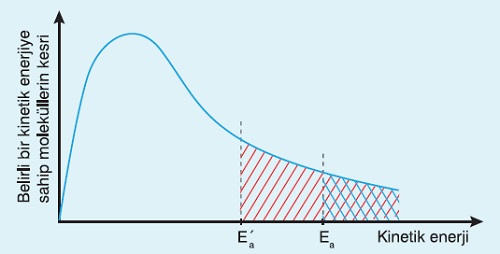
- Molekül kesri- Kinetik enerji grafiğinde:
- Eşik enerjisi (Ea) değerinden sonraki taralı alan ne kadar büyükse sıcaklık o kadar yüksektir.
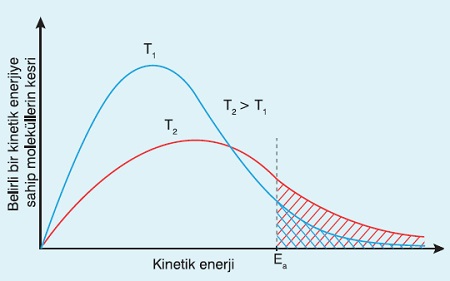
Tepkime Hızına Etki Eden Faktörler
5. Katalizör
- Eşik enerjisini düşürür.
- Hız sabitini (k) arttırır.
- Tepkimeyi hızlandırır.
- İleri ve geri aktifleşme enerjilerini eşit miktarda düşürür.
- ΔH‘ı etkilemez.
- Tepkimeleri başlatamaz, başlamış tepkimeleri hızlandırır.
- Tepkimeye girdiği gibi çıkar, fiziksel hali (katı-sıvı-gaz) değişebilir.
- Ürün miktarını etkilemez.
- Tepkimenin basamak sayısını değiştirebilir.
- Işığın katalizör etkisine fotokataliz denir.
- Bazen, katalizör, tepkimenin basamaklarından birinde oluşur (otokatalizör).
- Yavaşlatan katalizörlere negatif katalizör (inhibitör) denir.
- Grafikler; A2(g) + B2(g) → 2AB(g) tepkimesine aittir.
- Mavi grafik katalizörsüz
- Kırmızı grafik katalizörlü tepkimedir.
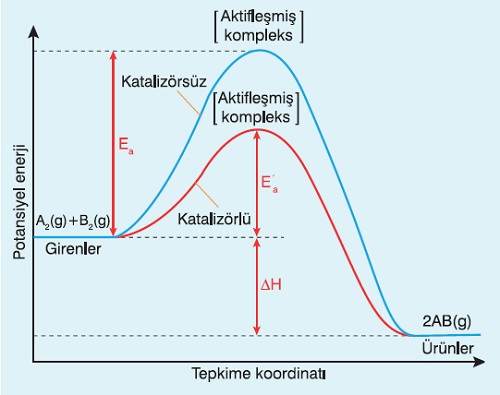
Tepkime Hızına Etki Eden Faktörler
5. Katalizör
- Bir kimyasal tepkimeye ait, Molekül kesri- Kinetik enerji grafiğinde, birden çok aktivasyon (Ea) enerjisi varsa:
- Düşük olan Ea değeri değeri katalizörlü tepkimeye aittir.
Tepkime Hızına Etki Eden Faktörler
6. Temas Yüzeyi
- Katılar ne kadar tozlaşırsa,
- Maddeler katıdan gaza doğru gittikçe
temas yüzeyi artar. - Temas yüzeyinin artması,
- Tepkimeleri hızlandırır.
- Çünkü; temas yüzeyi ne kadar çok ise, maddelerin kimyasal türleri arasında o kadar çok çarpışma gerçekleşir.
- Hız sabitini arttırır.
- Tepkimeleri hızlandırır.
- Demir tozu demir kalıplarından daha hızlı tepkime verir.



Kimyasal Tepkimelerde Hız
II. Bölüm
(Tepkime Hızını Etkileyen Faktörler)
Bitti 🙁