İçindekiler
- Maddeler
- Karışımlar
- Çözünme Olayı
- Katı-Sıvı-Gaz Çözeltiler
- Elektrolit Çözeltiler
- Çözeltilerde Derişim
- Bazı Yaygın Çözeltiler
- Çözelti Hazırlama
- Çözeltilerin Özellikleri
Karışımlar, Homojen ve heterojen karımlar, olarak iki sınıfa ayrılır. Sınıflandırmaya geçmeden önce, gelin, “Karışım” adını verdiğimiz bu maddeleri tanıyalım.
Maddeler
Çevremizde gördüğümüz bütün maddeler şöyle sınıflandırılır:

Karışımlar

Elementler ve bileşikler saf maddelerdir yani kesinlikle yalnız maddelerdir. Onlara bir karışım demek çok yanlış olur.
Karışımların adından belli zaten, en az iki tane saf maddeyi, karıştırırsak bir karışım oluşur.
Karışımları oluşturan maddelere, karışımın bileşenleri denir.
Karışımlar, saf maddelerin birbirine karışmış halidir. Tabiatta, neredeyse bütün maddeler, karışım halindedir. Her madde az ya da çok başka bir madde ile birlikte bulunur.
Mesela; hava bir gaz karışımıdır. Havanın bileşenleri şunlardır:
- %78 N2(g)
- %21 O2(g)
- %1 CO2(g) ve diğer gazlar
Karışımların Özellikleri
- Saf madde değildirler.
- Belirli formülleri yoktur.
- Farklı kimyasal türler (atom, molekül, iyon) içerir.
- Karışımı oluşturan maddeler kendi özelliklerini kaybetmez.
- Karışımı oluşturan maddelerin miktarları arasında belirli bir oran yoktur. Maddeler, hangi oranda karışırsa karışsın, bir karışım oluşur.
- Karışımlar fiziksel yollarla oluşur ve bileşenlerine fiziksel yollarla ayrılır.
- Karışımın fiziksel özellikleri, karışanların oranına bağlı olarak değişir (erime noktası, kaynama noktası, öz kütle…).
- Karışımların kütleleri bileşenlerin kütleleri toplamına eşittir fakat karışımın hacmi bileşenlerin hacimleri toplamına eşit olmayabilir.
Karışımların Sınıflandırılması
Karışımlar görünüşlerine göre iki sınıfa ayrılır. Bunlar şunlardır:
- Homojen Karışımlar (Çözeltiler)
- Heterojen Karışımlar
- Adi Karışımlar (Katı – Katı)
- Emülsiyonlar (Sıvı – Sıvı)
- Süspansiyonlar (Katı – Sıvı)
- Aerosoller (Gaz – Sıvı veya Gaz – Katı)
- Kolloidal Karışımlar (Bulanık sıvılar)
Heterojen Karışımlar

Heterojen karışımlara bakıldığı zaman, tek bir madde olmadığı, birden fazla maddenin karışmış olduğu anlaşılır.
Heterojen karışımlarda, karışan maddeler birbirinde ya hiç çözünmemiştir ya da tam bir çözünme gerçekleşmemiştir. Karışıma bakıldığında farklı fazlar görünür.
Heterojen karışımların özellikleri şunlardır:
- Her yerinde aynı özelliği göstermez.
- Heterojen karışımı oluşturan bileşenler karışımda eşit dağılmadığı için karışım birden fazla faza sahiptir. Genellikle birden fazla madde olduğu görülür ve kolayca ayırt edilebilir.
- Bileşenler gözle veya çeşitli görüntüleme yöntemleriyle ayırt edilebilir.
Örnekler:
Aşağıdaki maddeler heterojen karışımlardır:
- Kumlu su
- Duman
- Sis
- Yağlı su
- Çorba
- Salata
- Toprak
Heterojen Karışımların Türleri
I) Adi Karışımlar

Birbirine karışmış katıların oluşturduğu heterojen karışımlar adi karşım olarak adlandırılır.
Adi karışımı örnekleri:
- Kum-tuz karışımı
- Tebeşir tozu-kum karışımı
- Kükürt tozu-demir tozu karışımı
- Kum-odun talaşı karışımı
- Kum-çakıl karışımı
II) Emülsiyonlar

Birbirinde çözünmeyen sıvıların oluşturduğu karışımlardır. Emülsiyonlarda, sıvılardan hafif olan üstte, ağır olan ise altta toplanır.
Emülsiyon örnekleri:
- Yağ-su karışımı
- Benzin-su karışımı
- Mazot-su karışımı
- CCl4 (Karbon tetraklorür)-su karışımı
III) Süspansiyonlar

Bir sıvının ile o sıvıda çözünmeyen bir katının oluşturduğu karışımdır. Katının, içinde bulunduğu sıvıda çözünmediği karışımlardır.
Süspansiyonlarda, katı, sıvıdan daha hafif ise suyun yüzeyinde birikir, sıvıdan daha ağır ise sıvının dibine çöker.
Süspansiyon örnekleri:
- Kumlu su
- Tebeşir tozu-su karışımı
- Demir tozu-su karışımı
IV) Aerosoller


Aerosoller, gazı-katı veya gaz-sıvı karışımlarıdır. Yani; hava gibi bir gazın içinde dağılmış tozlar ya da çok küçük sıvı damlacıklarından oluşan karışımlara aerosol denir.
Aerosol örnekleri:
- Tozlu hava (Gaz-katı)
- Sis (Gaz-sıvı)
- Spreylerin püskürttüğü karışım (Gaz-sıvı)
- Baca dumanı (Gaz-katı)
V) Kolloidal Karışımlar

Bulanık sıvılardır. Katı, sıvıda dağılmıştır fakat yeterince dağılamamıştır yani; tam bir çözünme gerçekleşememiştir.
Kolloidal karışımlar, bulanıklıkları ile tanınırlar.
Tyndall Etkisi
Kolloid bir karışımın içinden ışık geçirildiğinde ışık saçılır ve geçtiği yolda iz bırakır. Buna Tyndall (Tindal) etkisi denir.

Yukarıdaki resimde, bir homojen karışım (soldaki) ile bir kolloid karışımdan ışık geçirilmiştir. Işık, homojen karışımdan geçerken, hiç iz bırakmamış fakat kolloidden geçerken iz bırakmıştır (Tyndall etkisi).
Kolloid Örnekleri:
- Süt
- Kahve
- Renkli cam
- Çamurlu su
- Jöle
- Boyalar
- Serum
- Zamklı su
- Sabunlu su
- Killi su
- Mürekkep
- Jel
- Kan
- Aerosoller ve emülsiyonların da kolloid olanları vardır
Homojen Karışımlar (Çözeltiler)

Homojen karışımlara baktığımız zaman bir karışım olduklarını anlayamayız. Karşıdan tek bir madde gibi görünürler. Çünkü; homojen karışımlarda, maddeler birbiri içinde iyice dağılır.
Bir maddenin, başka bir madde içinde dağılmasına çözünme denir. Çözünme olayı gerçekleşince bir çözelti yani homojen karşım oluşur.
Çözeltilerde, miktarı az olan maddeye çözünen, miktarı daha çok olan maddeye ise çözücü denir.
Çözücüsü su olan çözeltilere sulu çözelti ya da sadece çözelti denir.
Örnek:
- Şeker çözeltisi: Şekerli su demektir.
- Tuz çözeltisi: Tuzlu su demektir.
- Etanolün sulu çözeltisi: Etanol-su karışımı demektir.
Homojen karışımların özellikleri şunlardır:
- Her yerinde aynı özelliği gösterir.
- Homojen karışımı oluşturan bileşenler karışımda eşit dağıldığı için karışım tek faza sahiptir, tek madde gibi görünür.
- Homojen karışımların bileşenleri çıplak gözle görülemez.
- Asitlerin, bazların ve tuzların çözeltileri elektrik akımını iletir.
- Elektrik akımını ileten çözeltilere elektrolit çözelti denir.
Örnekler:
Aşağıdaki maddeler homojen karışımlardır:
- Hava
- Şekerli su
- Yağmur suyu
- Sirke
- Bazı alaşımlar (Çelik, bronz, amalgamlar, tunç…)
- Tuzlu su
- Asitli su
- Bazlı su
- Kolonya
- Temiz hava
- Serum fizyolojik: Su ile tuzdan oluşan bir çözeltidir.
Çözelti
- Homojen
- Tanecik boyutu 10-9 m’den küçüktür.
- Çöktürme ile ayrılmaz.
- Işığı saçmaz.
Kolloid
- Heterojen
- Tanecikler 10-9 m ile 10-6 m arası büyüklüktedir.
- Yer çekimi etkisiyle değil, santrifüj yapıldığında çöktürme ile ayrılır.
- Işığı saçar (Tyndall etkisi).
Süspansiyon
- Heterojen
- Tanecikler 10-6 m’den daha büyüktür.
- Yer çekimi etkisiyle çökelerek ayrılır.
- Işığı saçar ve absorbe eder.
Çözünme Olayı
Çözünme olayı, bir maddenin başka bir maddenin her yerine dağılmasıdır. en çok bilinen örneklerden biri, şekerin veya tuzun suda çözünmesidir. Çözünme olayı gerçekleştiyse bir çözelti oluşmuş demektir.
Çözünme olayında, çözücünün kimyasal türleri, bir çete gibi, çözünen maddenin kimyasal türlerinin etrafını sarararak kaçırır.
Yemek Tuzunun Suda Çözünmesi
Mesela; tuzun suda çözünmesi olayında, su molekülleri, tuz kristalindeki iyonların etrafını sararak, tuz iyonlarını kendi içinde yayar. Bu şekilde, tuz, suyun her yerine dağılmış olur yani; tuz suda çözünmüş olur.
Aşağıda, tuzun suda çözünmesini canlandıran bir animasyon verilmiştir.
Yine, tuzun suda çözünmesi olayını canlandıran başka bir animasyon:
Tuzun suda çözünmesi olayını canlandıran bir animasyon daha:
Solvatasyon ve Hidratasyon
Çözünen maddenin kimyasal türlerinin etrafı, çözücünün kimyasal türleri tarafından sarıldığında bu olaya solvatasyon denir. Çözücü su ise, bu olaya hidratasyon denir.
Etrafı çözücünün kimyasal türleri tarafından sarılmış bir iyona, solvatize iyon denir. Çözücü su ise bu iyona hidratize iyon denir.

Zayıf Etkileşimler
Solvatasyon olayında:
- Dipol-dipol etkileşimi: İki polar kimyasal türün çözeltisinde kurulur.
- H2O ile CO karışımı
- İndüklenmiş dipol-İndüklenmiş dipol etkileşimi: İki apolar kimyasal türün çözeltisinde kurulur.
- CCl4 ile I2 çözeltisi
- Dipol-İyon etkileşimi: Polar bir sıvı ile iyonik bağlı bir bileşiğin çözeltisinde kurulur.
- Tuzlu su
- Hidrojen bağları: Çözücü ile çözünen maddenin kimyasal türleri arasında hidrojen bağları kurulabiliyorsa, bu iki madde birbirini çok iyi çözer.
- Su-amonyak (NH3) çözeltisi
- Su-alkol çözeltisi
Zayıf etkileşimler ile ilgili detaylı bilgi için aşağıda dersi okuyun:
Örnek:
Su, polar bir moleküldür. Yemek tuzunun suya verdiği Na+ ve Cl– türleri birer iyondur. Tuzlu suda, su molekülleri ile tuzun iyonları arasında iyon-dipol etkileşimleri oluşur.
Aşağıdaki şekilde, kesikli çizgiler, su molekülleri ile tuz iyonları arasında kurulan dipol-iyon etkileşimlerini gösteriyor:

Çözünme Olayının Aşamaları
Bir maddenin, bir başka madde içinde çözünmesi, 3 adımda gerçekleşir. Bu adımlar şunlardır:
- Çözücüyü oluşturan kimyasal türlerin birbirinden ayrılması
- Çözüneni oluşturan kimyasal türlerin birbirinden ayrılması
- Çözünen taneciklerinin çözücü tanecikleri tarafından kuşatılması
Katı veya sıvı bir çözücü maddenin kimyasal türleri arasında zayıf etkileşimler vardır. Aynı şekilde, katı veya sıvı bir çözünenin kimyasal türleri de birbirine zayıf etkileşimler ile tutunurlar.
Çözünme olayı gerçekleştiğinde, çözücünün kimyasal türleri ile çözünenin kimyasal türleri de, birbirine zayıf etkileşimler ile tutunur.
Benzer Benzerde İyi Çözünür
Polar bir madde polar bir çözücüde iyi çözünür. Apolar bir madde de apolar bir çözücüde iyi çözünür. Bu kural, genel olarak “Benzer benzerde iyi çözünür.” şeklinde ifade edilir.
Aşağıda; polar ve apolar çözücülere bazı örnekler verilmiştir:
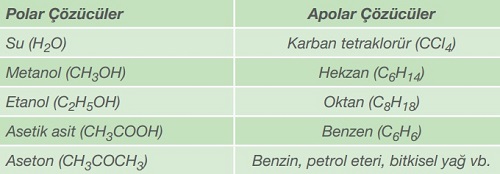
Polar ve apolar maddeler hakkında detaylı bilgi için, aşağıdaki derse çalışın:
Örnek:
Aşağıda, bazı maddeler ve polarlık durumları verilmiştir.
- Benzen: Apolar bir maddedir.
- Su: Polar bir maddedir.
- Hekzan: Apolar bir maddedir.
- İyot: Apolar bir maddedir.
- Yemek tuzu: Polar bir maddedir.
Buna göre aşağıdakilerden hangisinin bir çözelti olması beklenir?
A) Su – Benzen karışımı
B) Su – Hekzan karışımı
C) Benzen – Hekzan Karışımı
D) Su – İyot karışımı
E) Benzen-Yemek tuzu karışımı
Çözüm:
Benzen ve Hekzan maddelerinin ikisi de apolardır, yani birbirlerine benzerler. Bu yüzden, bu ikisinin birbirinde çözünmesi ve karışımlarının bir çözelti olması beklenir.
Cevap: C
Katı-Sıvı-Gaz Çözeltiler
Çözeltiler, fiziksel hallerine göre katı, sıvı ve gaz çözeltiler olarak sınıflandırılabilir.
Katı Çözeltiler
Birbirinde çözünen maddeler, sonuçta katı halde kalıyorsa, oluşan çözelti katı bir çözeltidir.
Mesela, metallerin çözeltileri genelde katıdır. Metallerin çözeltilerine “alaşımlar” denir.
Alaşımlar, farklı metallerin, erimiş halde (sıvı) iken, birbirlerine karıştırılması ile oluşur. Sıvı halde iken birbirinde çözünen metaller, zamanla donarlar ve katı halde bir homojen karışım oluşur.
Alaşımlar; paslanmazlık, dayanıklılık veya sağlamlık gibi özellikleri açısından çok kullanılan katı çözeltilerdir.
Aşağıda bazı katı çözelti örnekleri verilmiştir:
- Pirinç (Cu-Zn alaşımı)
- Bronz veya Tunç (Cu-Sn alaşımı)
- Alman gümüşü (Cu-Ni-Zn)
- Çelik (Fe-C alaşımı)
- Lehim (Sn-Pb)
- Gümüş takılar (Ag-Cu)
Sıvı Çözeltiler
Genellikle, sulu çözeltilerdir. Bir sıvının içinde başka bir maddenin çözünmesiyle oluşurlar.
Aşağıda, sıvı çözeltilere bazı örnekler verilmiştir:
- Tuz çözeltisi (Çözücü: Su, Çözünen: Tuz katısı)
- Kolonya (Çözücü: Etil alkol sıvısı, Çözünen: Esans ve su sıvıları)
- Antifriz (Çözücü: Su, Çözünen: Etilen glikol sıvısı)
- Gazoz (Çözücü: Su, Çözünen: CO2 gazı)
- Soda (Çözücü: Su: Çözünen: NaHCO3 tuzu)
Gaz Çözeltiler
Gazlar; katı ve sıvılardan farklı olarak, birbirleriyle her zaman homojen karışırlar. Yani; iki tane gazı, aynı kaba koyduğumuzda, heterojen bir karışım oluşturması mümkün değildir.
Gaz karışımlarına örnekler:
- Hava (%78 N2 gazı, %21 O2 gazı, %1 CO2 ve diğer gazlar)
- Doğalgaz (Çözücü: Metan gazı, Çözünen: Etan gazı, porpan gazı, bütan gazı)
Elektrolit Çözeltiler
- Asitler, bazlar ve tuzlar; suda iyonlarına ayrışarak çözünür.
- Suda iyonlarına ayrışarak çözünen maddeler, “iyonal çözeltiler” oluşturur.
- İyonal çözeltiler, elektrik akımını iletirler.
- Elektrik akımını iletene çözeltilere “elektrolit çözeltiler” denir.
- Alkoller, şekerler gibi maddeler, suda moleküller halinde çözünürler.
- Suda moleküler çözünen maddelerin çözeltilerine, “moleküler çözeltiler” denir.
Çözeltilerde Derişim
Derişim, bir çözeltide çözünen maddenin oranı demektir. Derişime konsantrasyon da denir.
Mesela; bir tuz çözeltisinin %10’u tuz, %90’ı su ise, bu çözeltinin derişimi %10’dur. Derişim her zaman çözünen maddenin oranını verir.
Doymuş ve Doymamış Çözeltiler
Daha fazla madde çözemeyecek durumda olan çözeltilere doyumu çözelti denir.
Daha fazla madde çözebilecek durumdaki çözeltilere doymamış çözelti denir.
100 gram veya 100 mL suyu doyuran madde miktarına çözünürlük denir.
Her maddenin çözünürlüğü kendine özgüdür, bu yüzden çözünürlük maddeler için ayırt edici bir özelliktir.
Nasıl insanların midesinin bir kapasitesi varsa, suyun da bir çok madde için bir çözünme sınırı vardır.
Suda yemek tuzu çözmek istersek, 100 gram su, yaklaşık 35 gram tuzdan daha fazlasını çözemeyecektir, çünkü; 35 gram tuz çözünce su doyacaktır.
Bir çözelti, daha fazla madde çözemiyorsa, doygunluğa ulaşmış demektir. Doygunluğa ulaşmış bir çözeltiye, çözünen madde eklersek, eklediğimiz madde çözünmeden kalacaktır.
Derişik ve Seyreltik Çözeltiler
Derişik çözeltide, çözünen maddenin oranı (derişimi) daha çoktur; seyreltik çözeltide ise çözünen maddenin oranı daha azdır.
Derişik çözeltilere, konsantre çözelti de denir.
Örnek olarak; tek şekerli bir çay, iki şekerli bir çaya göre seyreltik bir şeker çözeltisidir; iki şekerli çay daha derişiktir. Fakat; iki şekerli çay da, üç şekerli çay ile kıyaslandığında daha seyreltik olacaktır.

Başka bir örnek olarak, konsantre meyve suları, normal meyve sularına göre daha derişiktir. Yani, konsantre meyve sularında, meyve aroması oranı daha yüksektir.
Aynı şekilde, konsantre çamaşır suları da, normal çamaşır sularından daha derişiktir.
Derişim Birimleri
Bir çözeltinin derişimini hesaplamak için, çözeltide çözünen maddenin ve çözeltinin miktarını bilmek genellikle yeterlidir.
Çözeltideki maddelerin miktarları, bazen kütle olarak bazen de hacim olarak verilir. İşte verilen birime göre, bir çözeltinin derişimini ifade etmek için kullanılan farklı yöntemler vardır. Bu yöntemler şunlardır:
- Kütlece Yüzde Derişim (m/m)
- Hacimce Yüzde Derişim (V/V)
- Kütle Hacim Yüzdesi (m/V)
- ppm (Milyonda bir kısım)
Gelin bu derişim yöntemlerini yakından inceleyelim.
1) Kütlece Yüzde Derişim (m/m)
Kütlenin sembolü “m” harfi, birimi de “gram” ve katlarıdır. Yani, kütlece yüzde derişimi hesaplamak istiyorsak, çözeltideki maddelerin gramını kullanmalıyız.
Kütlece yüzde derişim şu formülle hesaplanır:

Yukarıda, kütlece yüzde derişimin formülü verilmiştir. Formülden anlıyoruz ki; kütlece yüzde derişimini hesaplayabilmek için, çözeltinin toplam kütlesine ve çözünen maddenin kütlesine ihtiyacımız vardır.
Çözeltinin toplam kütlesini, çözünen maddenin ve çözücünün kütlesini toplayarak bulabiliriz:
mÇözelti = mÇözücü + mÇözünen
Bir X çözeltisinin kütlece derişimi %20 ise, bu çözeltinin, her 100 gramının 20 gramı X maddesi, 80 gramı da sudur. Bu mantık ile, formül ezberlemeden, kütlece yüzde derişim soruları çözülebilir.
Örnek:
40 g şeker ve 120 g su karıştırılarak şekerli su çözeltisi hazırlanıyor.
Bu çözeltinin kütlece yüzde derişimi kaçtır?
Çözüm:
Bu çözeltide; çözünen madde şekerdir, çözücü de sudur. Bu ikisinin toplamı çözeltiyi oluşturur.
I. YOL: Formül ile çözüm
mçözünen = 40 g
mçözelti = 40 + 120 = 160 g
Formül:
% = (40/160) x 100
% = 25
II. YOL: Orantı ile çözüm
160 gram çözeltide 40 gram şeker varsa
100 gram çözeltide ? gram şeker vardır
Doğru orantının denklemi kurulur ve ? bulunur:
160 . ? = 100 . 40
? = 25
Cevap: %25
Örnek:
200 gram ve kütlece %40’lık NaCl çözeltisinde kaç gram NaCl çözünmüştür?
Çözüm:
Çözeltinin yüzdesi ve kütlesi belli, çözünen maddenin kütlesi soruluyor.
I. YOL: Formül ile çözüm
mçözünen = ? g
mçözelti = 200 g
% = 40
Formül:
Verilenleri formülde yerine koyalım:
40 = (? / 200) x 100
40 = ? / 2
? = 80 g
II. YOL: Orantı ile çözüm
100 gram çözeltide 40 gram NaCl varsa
200 gram çözeltide ? gram NaCl vardır
Doğru orantının denklemi kurulur ve ? bulunur:
100 . ? = 200 . 40
? = 80 g
Cevap: 80 g
Çözeltiye su ekleme veya su buharlaştırma:
Bir sulu çözeltiye, su eklendiğinde çözelti seyreltilmiş olur ve yüzde derişimi düşer; çözeltiden su buharlaştırıldığında ise, çözelti daha derişik olur ve çözeltinin yüzde derişimi artar.
Bir çözeltiye su eklendiğinde, çözeltinin kütlesi eklenen su kadar artar; çözeltiden su buharlaştırıldığında, çözeltinin kütlesi, buharlaşan su kadar azalır.
Çözeltilere su eklendiğinde veya buharlaştırıldığında, son derişim (%son) şu formül ile hesaplanır:
%son . mson = %ilk . milk
Formülde;
– %ilk ve milk değerleri, çözeltinin başlangıçtaki yüzde derişimi ve kütlesi,
– %son ve mson değerleri, çözeltinin sonuçtaki yüzde derişimi ve kütlesidir.
Örnek:
Kütlece %10’luk 160 g tuzlu su çözeltisine, aynı sıcaklıkta 480 g su eklenirse, son çözeltinin kütlece yüzde derişimi kaç olur?
Çözüm:
Bir çözeltiye su eklenirse, su eklendikten sonraki kütlece yüzde derişim (%son) şu formülle bulunur:
%son . mson = %ilk . milk
İlk yüzde ve kütle:
milk = 160 g
%ilk = 10
Son yüzde ve kütle:
mson = 160 + 480 = 640 g
%son = ?
Verilenleri formülde yerine koyarsak:
%son . mson = %ilk . milk
%son . 640 = 10 . 160
%son = 2,5
Cevap: %2,5
Çözeltileri karıştırma:
Farklı çözeltiler birbiriyle karıştırılırsa, hepsi bir den bir araya gelerek tek bir çözelti oluştururlar. Oluşan bu çözeltinin, kütlece yüzde derişimine %son ve kütlesine mson dersek, bu ikisinin çarpımı şuna eşit olur:
%son . mson = %1 . m1 + %2 . m2 + %3 . m3 + %4 . m4 +…
Formülde;
– %son ve mson değerleri, oluşan çözetinin yüzdesi ve toplam kültesi,
– %1 . m1 değerler, karştırılan çözeltilerden biricisinin yüzdesi ve kütlesi,
– %2 . m2 değerler, karştırılan çözeltilerden ikincisinin yüzdesi ve kütlesi,
– %3 . m3 değerler, karştırılan çözeltilerden üçüncüsünün yüzdesi ve kütlesidir.
– %4 . m4 değerler, karştırılan çözeltilerden dördüncüsünün yüzdesi ve kütlesidir.
– Dörtten fazla çözelti karıştıysa, formül, karışıtırlan bütün çözeltiler için böyle devam eder.
DİKKAT! Yukarıdaki formül kullanılırken, çözeltiye:
– Sadece çözünen madde eklendiğinde, çözünen maddenin kütlece yüzde derişimi %100
-Sadece saf su eklendiğinde, saf suyun kütlece yüzde derişimi %0
alınır.
Çözeltiler karışınca, çökme oluyorsa:
Çözeltiler karıştıktan sonra, çözünen maddenin bir miktarı çöküyorsa (mçöken), formül şöle olur:
%son . mson = (%1 . m1 + %2 . m2 + %3 . m3 + %4 . m4 +…) – mçöken
Formüldeki mson değeri şudur:
mson = mtoplam – mçöken
Örnek:
380 gram ve kütlece %20’lik NaNO3 çözeltisi ile 620 gram ve kütlece %10’luk NaNO3 çözeltileri karıştırılıyor.
Bir çökelme olmadığına göre, oluşan karışımın kütlece yüzde derişimi kaçtır?
Çözüm:
İki çözelti karıştırılıyor ve çökelme olmuyor. Buna göre, kullanacağımız formül şudur:
%son . mson = %1 . m1 + %2 . m2
Soruda verilenler şöyledir:
380 gram ve kütlece %20’lik NaNO3 çözeltisi:
%1 = 20
m1 = 380 g
620 gram ve kütlece %10’luk NaNO3 çözeltisi:
%2 = 10
m2 = 620 g
Bu ikisi karışınca:
%son = ?
mson = 380 + 620 = 1000 g
Verilenleri formülde yerine koyalım, sorulanı bulalım:
%son . mson = %1 . m1 + %2 . m2
%son . 1000 = 20 . 380 + 10 . 620
%son . 1000 = 7600 + 6200
%son = 13800 / 1000
%son = 13,8
Cevap: %13,8
Örnek:
%20’lik 200 gram şeker çözeltisine; %40’lık 50 gram şeker çözeltisi, 140 gram saf su ve 110 gram saf şeker katısı ekleniyor.
Bir çökelme olmadığına göre, oluşan çözeltinin kütlece yüzdesi kaçtır?
Çözüm:
4 madde birbiri ile karıştırılıyor ve çökelme olmuyor. Buna göre, kullanacağımız formül şudur:
%son . mson = %1 . m1 + %2 . m2+ %3 . m3 + %4 . m4
Soruda verilenler şöyledir:
%20’lik 200 gram şeker çözeltisi:
%1 = 20
m1 = 200 g
%40’lık 50 gram şeker çözeltisi:
%2 = 40
m2 = 50 g
140 gram saf su:
%3 = 0
m3 = 140 g
110 gram saf şeker katısı:
%4 = 100
m4 = 110 g
Bu dört madde karışınca:
%son = ?
mson = 200 + 50 + 140 + 110 = 500 g
Verilenleri formülde yerine koyalım, sorulanı bulalım:
%son . mson = %1 . m1 + %2 . m2+ %3 . m3 + %4 . m4
%son . 500 = 20.200 + 40.50 + 0.140 + 100.110
%son . 500 = 4000 + 2000 + 0 + 11000
%son = 17000 / 500
%son = 34
Cevap: %34
2) Hacimce Yüzde Derişim (V/V)
Hacmin sembolü “V” harfi, birimi de “Litre” veya “m3” ve bunların katlarıdır. Yani, hacimce yüzde derişimi hesaplamak istiyorsak, çözeltideki maddelerin Litrelerini kullanmalıyız.
Hacimce yüzde derişim, genellikle, sıvıların birbiri ile oluşturduğu çözeltilerin derişiminde kullanılır.
Hacimce yüzde derişim şu formülle hesaplanır:

Formülden anlıyoruz ki; hacimce yüzde derişimini hesaplayabilmek için, çözeltinin toplam hacmine ve çözünen maddenin hacmine ihtiyacımız vardır.
Çözeltinin hacmini, çözünen maddenin ve çözücünün hacmini toplayarak bulabiliriz:
VÇözelti = VÇözücü + VÇözünen
Kütlece yüzde derişimde verdiğimiz formüllerde “m” yerine “V” yazarak, aynı formülleri, hacimce yüzde derişim için de kullanabiliriz.
Çözücü eklendiğinde ya da buharlaştırıldığında:
%son . Vson = %ilk . Vilk
Çözeltileri karıştırma:
%son . Vson = %1 . V1 + %2 . V2 + %3 . V3 + %4 . V4 +…
Örnek:
50 cm3 etil alkol ile aynı sıcaklıkta bulunan bir miktar saf su karıştırılıp 200 cm3 hacminde bir çözelti elde ediliyor.
Çözeltide alkolün hacimce yüzdesi kaçtır?
Çözüm:
Çözeltide, su çözücüdür; alkol çözünendir. Çözünen maddenin ve çözeltinin hacimleri verilmiş, çözeltinin hacimce yüzdesi soruluyor.
I. YOL: Formül ile çözüm
Vçözünen = 50 cm3
Vçözelti = 200 cm3
% = ?
Formül:
Verilenleri formülde yerine koyalım:
% = (50 / 200) x 100
% = (1 / 4) x 100
% = 25
II. YOL: Orantı ile çözüm
200 cm3 çözeltide 50 cm3 alkol varsa
100 cm3 çözeltide ? cm3 alkol vardır
Doğru orantının denklemi kurulur ve ? bulunur:
200 . ? = 100 . 50
? = 25 cm3
3) Kütle Hacim Yüzdesi (m/V)
Çözünen maddenin kütlesi, çözeltinin ise hacmi hesaba katılarak bulunan çözelti derişimdir.
Kütle-hacim yüzdesi, genellikle, bir sıvının içinde bir katı çözündüğünde kullanılan yüzde derişimdir.
Kütle-hacim yüzdesinin formülü şudur:

Örnek:
Sabit sıcaklıkta, 2 g İyot (I2) katısının, Karbon tetraklorür (CCl4) sıvısında çözünmesi ile hazırlanan 80 mL çözeltinin, kütle-hacim yüzdesini g/mL cinsinden bulunuz.
Çözüm:
Çözeltide, Karbon tetraklorür çözücüdür; İyot katısı çözünendir. Çözünen maddenin kütlesi ve çözeltinin hacmi verilmiş, çözeltinin kütle-hacim yüzdesi soruluyor.
Yüzde derişimin, g/mL cinsinden sorulmasının anlamı şudur:
– Kütle, gram cinsinden alınacak
– Hacim, mL cinsinden alınacak
Verilen kütle ve hacimler zaten gram ve mL olarak verilmiş. Bu yüzden birimler ile ilgili bir sorunumuz yoktur.
I. YOL: Formül ile çözüm
mçözünen = 2 g
Vçözelti = 80 mL
% = ?
Formül:
Verilenleri formülde yerine koyalım:
% = (2 / 80) x 100
% = (1 / 40) x 100
% = 2,5
II. YOL: Orantı ile çözüm
80 mL çözeltide 2 gram iyot varsa
100 mL çözeltide ? gram iyot vardır
Doğru orantının denklemi kurulur ve ? bulunur:
80 . ? = 100 . 2
? = 200 / 80
? = 20 / 8
? = 10 / 4
? = 2,5
4) ppm Türünden Derişim (Milyonda Bir Kısım)
Kocaman bir gölde bir tutam tuz çözdüğümüzü düşünelim. Tonlarca suda çözünen bir tutam tuzun derişimi, fark edilmeyecek kadar küçüktür. İşte böyle, çok çok küçük oranda çözünene maddelerin derişimin “ppm” türünden hesaplanır.
ppm, İngilizce “parts per million” (parts pör milyın) kelimelerinin kısaltılmış şeklidir ve “milyonda bir kısım” anlamına gelmektedir.
Bir çözeltide çözünen maddenin derişimi, çok çok az ise, o maddenin, çözeltide çok az miktarda bulunduğunu anlatmak için “eser miktarda” ifadesi kullanılır.
Örneğin; 1 000 000 g su örneğinde, 5 g cıva bulunuyorsa, bu çözeltinin derişimi 5 ppm’dir. Veya; 1 000 000 Litre suda, 2 Litre alkol varsa, bu çözeltinin derişimi de 2 ppm olur.
Bazı Yaygın Çözeltiler
Günlük hayatımızda sıkça karşılaştığımız çözeltiler şunlardır:
I) Çeşme Suyu
Evlerimizin musluğundan akan suya “çeşme suyu” veya “musluk suyu” denir. Çeşme suları, saf su değildir, tatlı kaynaklarından evimize kadar gelen sulardır.
Çeşme suları, temas ettiği topraktan ve kayaçlardan bir çok mineral çözer. Mineraller, tabiatta doğal yollarla oluşmuş tuzlardır. Çeşme suyunda, bu tuzlardan gelen onlarca iyon vardır. Bu iyonlar, eser miktarda bulunurlar.
Çeşme suyunun, içilebilir olması için, çözdüğü minerallerin belli bir derişim sınırında olması gerekir. Çeşme suyunun, mineral derişimleri, izin verilen sınırların üzerinde ise veya; çeşme suyu, istenmeyen maddeler içeriyorsa, o su içilmez.
Aşağıdaki tabloda, Uluslararası İçme Suyu Standartlarına göre, bazı maddelerin, mg/L (miligram/Litre) olarak, izin verilen derişimleri verilmiştir:
| Madde | Tavsiye Edilen Miktar mg/L |
Müsaade Edilecek Maksimum Miktar mg/L |
|---|---|---|
| Klorür (Cl–) | 200 | 600 |
| Sülfat (SO42-) | 200 | 600 |
| Demir (Fe) | 0.3 | 1.0 |
| Mangan (Mn) | 0.1 | 0.5 |
| Bakır (Cu) | 0.05 | 1.5 |
| Çinko (Zn) | 5 | 15 |
| Magnezyum (Mg) | 50 | 150 |
II) Deniz Suyu
Deniz suyu bir tuz çözeltisidir. Deniz suyundaki tuz derişimi, kütlece yaklaşık %3,5 oranındadır. Deniz suyundaki tuzun büyük bir kısmı yemek tuzudur yani NaCl (Sodyum klorür) bileşiğidir.
III) Serum
Serumlar, “izotonik” tuz çözeltileridir. İzotonik bir serum çözeltisindeki tuz derişimi, 0,9 g/L değerindedir.
İzotonik demek, serum sıvısındaki tuz oranı ile vücudumuzdaki tuz oranı birbirine eşit demektir. İzotonik bir serum sıvısı vücudumuza verildiğinde, su dengemiz veya tuz dengemiz bozulmaz.
Bazı serum çözeltilerinde, tuz ile birlikte dekstroz şekeri de vardır. Bu serum çözeltilerine, “dekstroz izotonik tuz çözeltisi” denir. Dekstroz izotonik tuz çözeltilerinde; NaCl oranı 0,9 g/L, dekstroz şekerinin oranı 5 g/L değerindedir.
IV) Kolonya
Kolonya genel olarak şu 3 maddenin karışımıdır:
- Etil alkol (C2H5OH)
- Su (H2O)
- Esans (Kokulu yağ)
Kolonyada bulunan etil alkolün hacimce derişimi, kolonyanın derecesini belirler. Yani şöyle olur:
80o (Seksen Derece) Kolonya
80 derece kolonyada bulunan maddelerin hacimce derişimi şöyledir:
- %80 Etil alkol
- Yaklaşık %5 esans
- Yaklaşık %15 su
Yani; basit bir mantık ile, 80o ve 100 mL bir kolonyada; 80 mL Etil alkol, 5 mL esans, 15 mL de su vardır.
70o (Yetmiş Derece) Kolonya
80 derece kolonyada bulunan maddelerin hacimce derişimi şöyledir:
- %70 Etil alkol
- Yaklaşık %5 esans
- Yaklaşık %25 su
Yani; basit bir mantık ile, 70o ve 100 mL bir kolonyada; 70 mL Etil alkol, 5 mL esans, 25 mL de su vardır.
Kolonyanın Kokusu
Kolonyanın kokusunu, kolonyada kullanılan esans belirler. Kolonyada; limon esansı kullanılırsa limon kolonyası, çimen esansı kullanılırsa çimen kolonyası üretilmiş olur…
Kolonyanın Son Kullanma Tarihi
Hacimce yüzde 80-96’sı etil alkol, kalan kısmı ise su ve esanstan oluşan kolonya, ağzı kapalı iken ve güneşten uzak kaldığı sürece ortalama beş yıl bozulmaz.
V) Şekerli Su
Şekerler bir çeşit karbonhidrat bileşikleridir. Bir çok şeker çeşidi vardır. Çay şekeri olarak kullandığımız madde, “sakkaroz” adında ve formülü de “C12H22O11” olan bir karbonhidrattır.
Suda şeker çözüldüğünde elde edilen çözeltiye; şeker çözeltisi veya şerbet denir. Şeker, suda yüksek oranda çözünebilen bir organik maddedir.
Arıcılıkta kullanılan ve derişimi %65 olan şerbetin 65 gramı şeker (C12H22O11) ve 35 gramı sudur.
Çözelti Hazırlama
Çözelti hazırlamak, bir kimyacın, en sık yaptığı işlemlerden biridir. Çözelti hazırlamak için, dikkat edilmesi gereken öne önemli konu, hazırlanacak çözeltinin miktarı ve derişimidir. Yani; öncelikle, ne kadar çözelti hazırlayacağımızı ve çözünen maddenin oranının ne olacağını bilmemiz gerekir.
Bir çözelti hazırlamak için, takip etmemiz gereken adımları şöyle sıralayabiliriz:
- Çözelti hazırlamaya başlamadan önce, bir hesap yaparak, çözeltideki çözücü ve çözünen miktarının belirlenmesi gerekir.
- Bu iki maddenin miktarı belirlendikten sonra, laboratuvardaki ölçüm cihazları ile, maddeler, hesaplanan miktarlarda ölçülür.
- Ölçülen çözücü ve çözünen, birbirine karıştırılır.
Örnek:
Kütlece %10’luk 500 g NaOH çözeltisi nasıl hazırlanır?
Çözüm:
NaOH çözeltisinde su çözücüdür, NaOH çözünen maddedir.
Kütlece, %10’luk NaOH çözeltisinin, her 100 gramının 10 gramı NaOH, 90 gramı su demektir.
O zaman, bir orantı ile, kütlece %10’luk 500 gram çözeltindeki su ve NaOH miktarını bulalım:
100 gram çözeltide 10 gram NaOH varsa
500 gram çözeltide ? gram NaOH vardır.
Doğru orantının denklemi kurulur ve ? bulunur:
100 . ? = 500 . 10
? = 5000 / 100
? = 50 g NaOH
Demek ki çözeltide, 50 gram NaOH kullanmamız gerekiyor. Bu durumda, çözeltide kullanılacak su miktarı;
500 – 50 = 450 gram
olarak hesaplanır.
Sonuçta, 50 gram NaOH ve 450 gram su tartılır ve bu iki madde birbirine karıştırılır. Böylece kütlece %10’luk 500 gram NaOH çözeltisi hazırlanmış olur.
Çözeltilerin Özellikleri
Çözeltilerde, çözünen maddenin oranı değiştikçe, çözeltinin bazı özellikleri de değişir. Mesela; tuzlu suda, çözünen tuz oranı arttıkça, kaynama noktası yükselir, donma noktası düşer, yoğunluk artar.
Bir çözeltide, kaynama ve donma noktası gibi, çözünen maddenin derişimine bağlı olarak değişen özelliklere koligatif özellikler denir.
Çözeltilerin Donma Noktası
Suda çözünen her madde, suyun donma noktasını etkiler. Saf suyun, normal donma sıcaklığı 0 oC’dir. Saf su, 0 oC’de donmaya başlar ve donma olayı bitene kadar sıcaklığı 0 oC’de sabitlenir.
Suda, yemek tuzu gibi, uçucu olmayan bir katı çözünürse, suyun donma noktası düşer. Yani; tuzlu su, saf suya göre daha düşük bir sıcaklıkta donmaya başlar. Tuzlu suyun, saf sudan farklı olarak, donma esnasında sıcaklığı düşmeye devam eder.
Aşağıda, normal şartlarda, saf su ve doymamış tuzlu suyun sıcaklık zaman grafikleri verilmiştir:
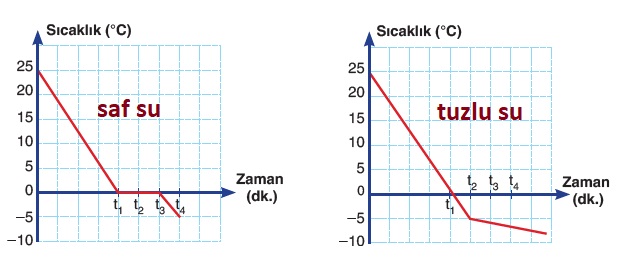
Doymamış tuzlu suyun, sıcaklık zaman grafiğine baktığımızda, saf sudan farklı olarak, donma olayının 0 oC’nin altında başladığını ve donma devam ederken de sıcaklığın azaldığını görürüz.
Kışın Yollara Tuz Atılması

Kışın, yollara tuz atılmasının sebebi, tuz atıldığında, suyun donma noktasının düşmesi ve böylece don olaylarının önlenmesidir.
Arabalara Antifriz (Donma Engelleyici) Konulması

Glikol (C2H6O2) antifriz (donma engelleyici) olarak kullanılan bir maddedir. Suda, glikol (C2H6O2) çözüldüğünde, suyun donma noktası bir hayli düşer. Bu yüzden, kışın, arabaların sularına antifriz katılarak, arabadaki suyun donması engellenir.
Çözeltilerin Kaynama Noktası
Suda çözünen her madde, suyun kaynama noktasını etkiler. Saf suyun, normal kaynama sıcaklığı 100 oC’dir. Saf su, 100 oC’de kaynamaya başlar ve kaynama olayı bitene kadar, sıcaklığı 100 oC’de sabitlenir.
Suda, yemek tuzu gibi, uçucu olmayan bir katı çözünürse, suyun kaynama noktası yükselir. Yani; tuzlu su, saf suya göre daha yüksek bir sıcaklıkta kaynamaya başlar.
Saf su kaynarken, sıcaklığı sabittir fakat; tuzlu su kaynarken sıcaklığı artmaya devam eder, ta ki doygun bir çözelti olana kadar. Doygun çözelti, daha fazla madde çözemeyecek duruma gelmiş çözelti demektir. Doygun çözeltiler hakkında detaylı bilgi ilerleyen konularda verilecektir.
Aşağıda, normal şartlarda, saf su ve doymamış tuzlu suyun sıcaklık zaman grafikleri verilmiştir:

Doymamış tuzlu suyun, sıcaklık zaman grafiğine baktığımızda, saf sudan farklı olarak, kaynama olayının 100 oC’nin üzerinde başladığını ve kaynama devam ederken de sıcaklığın arttığını görürüz.
Kaynayan bir suya, tuz attığımızda, kaynama olayı duracaktır çünkü; tuz çözündükten sonra, suyun kaynama sıcaklığı yükselecektir. Yani, suyun tekrar kaynaması için, sıcaklığının biraz daha yükselmesi gerekecektir.

4 yorum “1. Homojen ve Heterojen Karşımlar”