İçindekiler
- Tepkime hızını etkileyen faktörler, tepkimeleri hızlandırabilen ya da yavaşlatan etkilerdir. Bu faktörler şunlardır:
- Maddelerin Cinsi
- Derişim
- Sıcaklık
- Katalizör
- Temas Yüzeyi
Tepkime hızını etkileyen faktörleri öğrenmeye başlamadan önce, tepkimelerin “hız bağıntısı“nı bilmekte fayda vardır. Gelin önce hız bağıntısını öğrenelim.
Hız Bağıntısı
- Bir tepkimenin hız bağıntısı, tepkime hızının formülüdür.
- Tepkimelerin:
- ne kadar hızlı başlayacaklarını veya
- başladıktan sonraki herhangi bir anda ne kadar hızlı gerçekleşmekte olduklarını
bu formülü kullanarak hesaplarız.
- Tepkimelerin:
- Tepkime hızı, “r” veya “V“sembolü ile gösterilir.
- Her tepkimenin denklemi farklıdır. Çünkü her farklı tepkimelerde farklı kimyasal maddeler vardır.
- Bu yüzden her tepkimenin hız bağıntısı da kendine hastır fakat hepsi aynı şablona göre yazılır.
- Tepkimelerin hız bağıntısı aşağıdaki şablona göre yazılır:
r = k.[Giren1]katsayısı.[Giren2]katsayısı…
- Hız bağıntısındaki sembollerin anlamları şöyledir:
- r: Tepkime hızı
- Birimi M/s dir.
- k: Hız sabiti
- [Giren1]katsayısı: Girenler kısmındaki maddenin derişiminin üzeri katsayısı
- [Giren2]katsayısı: Girenlerdeki diğer maddenin derişiminin üzeri katsayısı
- …: Girenlerde kaç tane madde varsa formül o kadar devam eder.
- r: Tepkime hızı
- Bu şablon, tepkimeye giren madde sayısına göre değişir.
- Fark ettiyseniz, hız bağıntısında, sadece tepkimenin girenleri dikkate alınır, ürünlere bakılmaz.
- Hız bağıntısında, suda çözünen maddeler “(suda)” ve gazlar “(g)” yer alır.
- Katı “(k)” ve sıvı “(s)” haldeki maddeler, hız bağıntısında yer alamaz.
- Çünkü katı ve sıvıların derişimleri sabittir.
Öğretici Örnek:
N2(g) + 3H2(g) → 2NH3(g)
Yukarıdaki tepkimenin hız bağıntısı (hız denklemi de denir) şöyle yazılır:
r = k.[N2].[H2]3
Yukarıdaki hız bağıntısına ve tepkimesine dikkat edersek;
- N2 elementinin katsayısı 1 olduğu için, bağıntıdaki üssü de 1 olmuş,
- H2 elementinin katsayısı 3 olduğu için, bağıntıdaki üssü de 3 olmuş,
- NH3 bileşiği, ürünlerde olduğu için bağıntıya dahil edilmemiştir.
— Hız bağıntısı yazılırken, sadece tepkimenin girenler kısmına bakılır.
— Katı ve sıvılar, hız bağıntısında yer almaz. Çünkü, katı ve sıvıların derişimi sabittir.
Öğretici Örnek:
Aşağıda, incelemeniz için, bazı tepkimeler ve hız bağıntıları verilmiştir.
- C(k) + O2(g) → CO2(g)
- Hız bağıntısı: r = k.[O2]
- Hız bağıntısı: r = k.[O2]
- CO(g) + 1/2O2(g) → CO2(g)
- Hız bağıntısı: r = k.[CO].[O2]1/2
- Hız bağıntısı: r = k.[CO].[O2]1/2
- 2Na(k) + 2HCl(suda) → 2NaCl(suda) + H2(g)
- Hız bağıntısı: r = k.[HCl]2
Örnek:
I) Zn(k) + 2HCl(suda) → ZnCl2(suda) + H2(g)
II) Ag+(suda) + Cl–(suda) → AgCl(k)
III) Ca(k) + H2O(s) → CaO(k) + H2(g)
IV) CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
V) 4NO2(g) + O2(g) → 2N2O5(g)
Yukarıda verilen tepkimelerin hepsi tek basamakta gerçekleştiği kabul edilmektedir.
Buna göre, bu tepkimelerin hız denklemlerini yazınız.
Örneğin çözümü:
Tepkimelerin Derecesi (Mertebesi)
- Bir tepkimenin kaçıncı dereceden ya mertebeden olduğunu anlamak için, hız bağıntısına bakmamız yeterlidir.
- Hız bağıntısındaki maddelerin üslerinin toplamı, tepkimelerin derecesi ya da mertebesidir.
Öğretici Örnek:
Aşağıdaki hız bağıntılarına ait tepkimelerin derecesi belirtilmiştir:
- r = k.[NO2]4.[O2] : Köşeli parantezlerin üsleri toplamı 4+1 = 5 yapar. Tepkime 5. derecedendir.
- r = k.[CH4].[O2]2 : Köşeli parantezlerin üsleri toplamı 1+2 = 3 yapar. Tepkime 3. derecedendir.
- r = k.[Ag+].[Cl–] : Köşeli parantezlerin üsleri toplamı 1+1 = 2 yapar. Tepkime 2. derecedendir.
- r = k : Hız ifadesinde, köşeli parantez yok. Bu yüzden, tepkime 0. derecedendir.
Hız Sabitinin Birimi
- Tepkime derecesini biliyorsak, hız sabitinin de birimini basitçe şöyle bulabiliriz:
- k = 1 / (s . M(derece – 1))
- k = ( L(derece -1) / mol(derece -1) ) . s-1
Örnek:
4NO2(g) + O2(g) → 2N2O5(g)
Yukarıda verilen tepkimenin hız sabitinin birimi aşağıdakilerden hangisidir?
A) L3 . s-1 . mol-3
B) L4 . s-1 . mol-4
C) mol4 . s-1 . L-4
D) L5 . s-1 . mol-5
E) L . s-1 . mol
Cevap
Örneğin çözümü:
Tepkimenin Bir Maddeye Göre Derecesi (Mertebesi)
- Tepkimenin bir maddeye göre derecesi, o maddenin hız bağıntısındaki üssü demektir.
Öğretici Örnek:
- r = k.[NO2]4.[O2] : Hız bağıntısına baktığımızda, tepkime NO2 maddesine göre 4. dereceden, O2 maddesine göre 1. derecedendir.
- r = k.[CH4].[O2]2 : Tepkime, CH4‘e göre 1. dereceden, O2‘ye göre 2. dereceden bir tepkimedir.
Tepkimelerin Moleküleritesi
- Tepkimeye giren maddelerin toplam sayısına molekülerite denir.
- Moleküleriteyi bulmak için, girenlerin katsayıları toplanır.
- Bir maddenin moleküleritesi için şu kavramlar kullanılabilir:
- Unimoleküler tepkime: Molekülerite 1 demektir.
- Bimoleküler (dimoleküler de denir) tepkime: Molekülerite 2 demektir.
- Trimoleküler tepkime: Molekülerite 3 demektir.
- Tetramoleküler tepkime: Molekülerite 4 demektir.
- Pentamoleküler tepkime: Molekülerite 5 demektir.
Öğretici Örnek:
Aşağıda, bazı tepkimeler ve moleküleriteleri verilmiştir:
- 4NO2(g) + O2(g) → 2N2O5(g)
- Tepkimeye 4 tane NO2, 1 tane O2 molekülü girmiştir.
- Molekülerite 4+1=5’tir.
- Yani; tepkime, pentamoleküler bir tepkimedir.
- H2O(g) → H2(g) + 1/2O2(g)
- Tepkimeye 1 tane molekül girmiştir.
- Tepkimenin moleküleritesi 1’dir.
- Yani; tepkime unimoleküler bir tepkimedir.
- H2(g)+ Br2(g) → 2HBr(g)
- Tepkimeye 1 tane H2, 1 tane Br2 molekülü girmiştir.
- Molekülerite 1+1=2’dir.
- Yani; tepkime, bimoleküler veya dimoleküler bir tepkimedir.
Çok Basamaklı (Mekanizmalı) Tepkimelerin Hız Bağıntısı
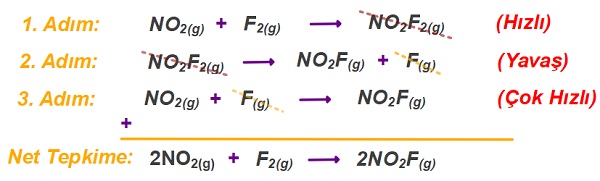
Net tepkimenin hız bağıntısı, yavaş adımın (basamağın) hız bağıntısına eşittir.
- Bazı tepkimelerde, girenler, tek defada ürünlere dönüşemez. Önce, başka maddelere dönüşürler, o başka maddelerden ürünler oluşur.
- Ürünlerin tek defada oluşmadığı tepkimelere basamaklı ya da mekanizmalı tepkimeler denir.
- Basamaklı tepkimelerin basamak sayısı, tepkimeden tepkimeye değişir. Yani; basamaklı tepkimeler;
- 2 basamakta veya
- 3 basamakta veya
- daha fazla basamakta gerçekleşebilir.
- Mekanizmalı bir tepkimede, basamaklarda gerçekleşen tepkimeler, sırayla yazıldığında, tepkime mekanizması yazılmış olur.
Öğretici Örnek:
Aşağıda, 2NO(g) + Br2(g) → 2NOBr(g) net tepkimesinin mekanizması verilmiştir:
1. Basamak: NO(g) + Br2(g) → NOBr2(g) (Yavaş)
2. Basamak: NO(g) + NOBr2(g) → 2NOBr(g) (Hızlı)
Tepkimenin yavaş basamağı şöyle verilmiştir:
NO(g) + Br2(g) → NOBr2(g)
Yavaş basamağın hız bağıntısı şöyledir:
r = k.[NO].[Br2]
Yavaş basamağın hız bağıntısı demek, net tepkimenin de hız bağıntısın demektir. Yani;
2NO(g) + Br2(g) → 2NOBr(g) tepkimesinin hız bağıntısı şudur:
r = k.[NO].[Br2]
Basamakların Toplanması ve Net Tepkimenin Bulunması
- Mekanizmalı tepkimelerde, basamaklardaki tepkimelerin toplamı net tepkime denklemini verir.
- Yani; net tepkimenin denklemi verilmese de, basamakları toplayarak bulabiliriz.
- Basamaklar toplanırken; aynı madde, hem ürünlerde hem de girenlerde bulunuyorsa, bu madde mutlaka sadeleştirilir.
- Sadeleşme yapabilmek için maddelerin katsayı ve fiziksel halleri de aynı olmalıdır.
- Sadeleşebilecek durumda olan ama; katsayısı aynı olamayan maddelerde, katsayılar genişletilerek eşitlik sağlanır ve sadeleştirme yapılır:
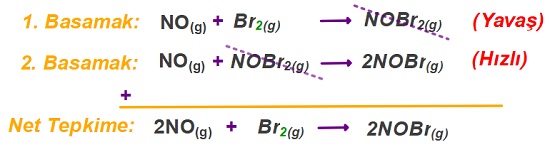
Ara Ürünler
- Basamaklı tepkimelerde, önce oluşan sonra da harcanan maddelere ara ürün denir.
- Ara ürünler sadeleşir ve net tepkimede gözükmez.
- Yani, arada oluşurlar ve hemen harcanırlar.
Öğretici Örnek:
Aşağıda; mekanizmaları verilen tepkimede, sadeleşen NOBr2 maddesi, ara üründür:

Örnek:
Aşağıda, mekanizmalı bir tepkimenin adımları verilmiştir.
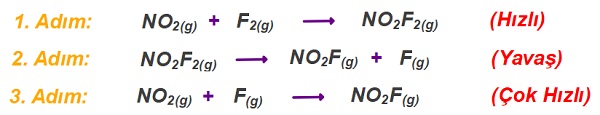
Buna göre, bu tepkime için aşağıdaki soruları cevaplayınız.
a) Net tepkimeyi bulunuz.
b) Ara ürünleri bulunuz.
Cevap
Örneğin çözümü:
Katalizör
- Mekanizmalı tepkimelerin basamaklarına bakarak, katalizörler de tespit edilebilir.
- Katalizör, tıpkı ara ürün gibi, sadeleşir ve net tepkimede yer almaz.
- Ara üründen farkı, katalizörün önce girenlerde görünmesi, sonra ürünlerde görünmesidir.
Katalizör, önce girer sonra çıkar.
Ara ürün, önce çıkar sonra girer.
Örnek:
Aşağıda, mekanizmalı bir tepkimenin adımları (basamakları da denir) verilmiştir.

Buna göre, bu tepkimede için aşağıdaki soruları cevaplayınız.
a) Net tepkimeyi bulunuz.
b) Ara ürünleri bulunuz.
c) Tepkimenin katalizörünü bulunuz.
Cevap
Örneğin çözümü:
Basamaklı Tepkimelerin Enerji Grafikleri
Potansiyel Enerji grafiğindeki tepe sayısı, tepkimenin basamak sayısıdır.
- Tek basamaklı bir tepkimenin, Potansiyel Enerji-Tekime Koordinatı grafiğinde bir tane tepe vardır:

- Mekanizmalı bir tepkimenin Potansiyel Enerji-Tepkime Koordinatı grafiği, basamak sayısı kadar tepe vardır:

- Yukarıdaki grafikte 2 tane tepe olduğundan, grafik 2 basamaklı bir tepkimeye aittir.
- Grafikte, dikey olarak çizilen kesikli çizgi, 1. basamak ile 2. basamak arasındaki sınırdır.
- Bu sınır, genelde gösterilmez, bizim görmemiz gerekir.
- Grafiğin dip yaptığı yerler, bir basamağın bittiği, diğer basamağın başladığı yerlerdir.
Grafik Yardımı ile Yavaş Basamağı Bulma
- Bir tepkimenin, İleri Aktifleşme Enerjisi (Eai) ne kadar büyükse, tepkime o kadar yavaştır.
- Mekanizmalı bir tepkimenin, Potansiyel Enerji grafiğinde, her bir basamağın İleri Aktifleşme Enerjisi (Eai) değerine bakarak, yavaş olanı tespit edebiliriz.

- Mesela, yukarıda, iki basamaklı bir tepkime için çizilen grafikte,
- 1. basamağın İleri Aktifleşme Enerjisi (Eai) daha büyüktür ve bu yüzden 1. basamak daha yavaştır.
- Yani, grafikteki mekanizmalı tepkimenin hız bağıntısı, 1. basamağa bakılarak yazılır.
Deney Sonuçları Tablosu ve Hız Bağıntısı

- Yukarıda verilen tablo, bir tepkimeye ait molarite ve hız ölçümlerine aittir.
- Grafikte; tepkimeye giren maddelerin derişimi değiştiğinde, hızın nasıl değiştiği görülür.
- Bu tablo yardımı ile, tepkimenin hız bağıntısı bulunabilir.
- Bu tablo yardımı ile bulunan hız bağıntısı, tepkime denklemine uymuyorsa, tepkime mekanizmalı bir tepkime demektir.
Deney Sonuçları Tablosundan Hız Bağıntısını Bulmak
- Deney sonuçları ile bir maddenin hız bağıntısındaki yerini bulmak için izlememiz gereken yol şudur:
- İki tane deney seçerek, verilerini kıyaslamalıyız.
- Seçtiğimiz deneylerde, bir maddenin derişimi sabit kalmalı diğer maddenin derişimi değişmelidir.
- Bu şartları sağlayan iki deneyde, derişimi değişen maddenin hız bağıntısındaki üssünü, şu formüldeki n değerine ulaşarak buluruz:
- İki tane deney seçerek, verilerini kıyaslamalıyız.
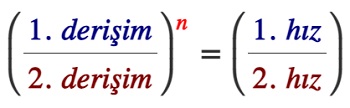
- Formül yardımı ile bulduğumuz n değeri, sıfırdan farklı ise, madde, hız bağıntısında yer alır ve derecesi de n’dir, diyebiliriz:
- r = k. [Derişimi değişen madde]n
Bu formülün nasıl kullanıldığını, bir örnek yardımı ile anlamaya çalışalım.
Örnek:
F2(g) + 2ClO2(g) → 2FClO2(g)
tepkimesine ait deney sonuçları aşağıda verilmiştir.

Buna göre, bu tepkimenin hız bağıntısını bulunuz ve mekanizması hakkında neler söylenebileceğini belirtiniz.
Cevap
Örneğin çözümü:
Tepkime Hızına Etki Eden Faktörler
Bir tepkimenin hızını değiştirebilen faktörler şunlardır:
- Madde Cinsi
- Derişim
- Sıcaklık
- Basınç-Hacim
- Temas Yüzeyi
- Katalizör
1. Madde Cinsinin Tepkime Hızına Etkisi
- Tepkimeye giren maddelerin cinsine bağlı olarak tepkimeler farklı hızlarda gerçekleşir.
- Madde cinsi için şu kuralları sıralayabiliriz:
- Zıt yüklü iyonlar arasında gerçekleşen tepkimeler, kimyadaki en hızlı tepkimelerdendir. Çünkü, aralarındaki çekim kuvveti sayesinde etkin çarpışmalar daha kolay olur.
- Asit-baz tepkimeleri, çökelme tepkimeleri zıt yüklü iyonlar arasında gerçekleşir ve çok hızlı tepkimelerdir.
Asit-Baz tepkimeleri:
HCl(suda) + NaOH(suda) → NaCl(suda) + H2O(s) (çok hızlı)
Çökelme tepkimeleri:
Ag+(suda) + Cl–(suda) → AgCl(k) (çok hızlı)
- Asit-baz tepkimeleri, çökelme tepkimeleri zıt yüklü iyonlar arasında gerçekleşir ve çok hızlı tepkimelerdir.
- Atomların yüklerinin değiştiği tepkimeler (redoks tepkimeleri), hızlı tepkimelerdir.
Yük değişimi tepkimeleri:
Fe2+(suda) + Ce4+(suda) → Fe3+(suda) + Ce3+(suda)
5Fe2+(suda) + MnO4–(suda) + 8H+(suda) → 5Fe3+(suda) + Mn2+(suda) + 4H2O(s) - Gazlar arasında gerçekleşen tepkimeler genellikle yavaştır fakat katı ve sıvıların tepkimelerinden daha hızldır.
- Tepkimeye giren moleküllerin sayısı arttıkça, tepkime daha da yavaşlar.
Giren moleküller kalabalıklaştıkça, tepkimeler yavaş olur:
SO2(g) + NO2(g) → SO3(g) + NO(g) (daha hızlı)
N2(g) + 3H2(g) → 2NH3(g) (daha yavaş)
- Tepkimeye giren moleküllerin sayısı arttıkça, tepkime daha da yavaşlar.
- Zıt yüklü iyonlar arasında gerçekleşen tepkimeler, kimyadaki en hızlı tepkimelerdendir. Çünkü, aralarındaki çekim kuvveti sayesinde etkin çarpışmalar daha kolay olur.
Örnek:
I) SO2(g) + NO2(g) → SO3(g) + NO(g)
II) H+(suda) + OH–(suda) → H2O(s)
III) Fe2+ + Ca → Ca2+ + Fe
Yukarıda verilen tepkimelerin, aynı koşullardaki hızlarını kıyaslayınız.
Cevap
Örneğin çözümü:
2. Derişimin Tepkime Hızına Etkisi
- Tepkimeye giren maddelerin derişimi, tepkime hızını etkiler.
- Tepkimeye giren maddeler ne kadar kalabalık olursa;
- o kadar çok çarpışma gerçekleşir
- etkin çarpışmalar o kadar sık ve çok olur.
- Etkin çarpışma sıklığı artarsa tepkime hızlanır.
- Bu yüzden, derimin artması, tepkimeleri hızlandırır.
Tepkimeye giren bir maddenin derişimi iki katına çıkarsa, tepkime hızı da iki katına çıkar mı? Bu sorunun cevabı, hız bağıntısında gizlidir.
Öğretici Örnek
A, B ve C maddeleri arasında gerçekleşen bir tepkime düşünün; hız bağıntısı da şöyle olsun:
r = k . [A] . [B]2 . [C]3
Hız bağıntısındaki üslerine baktığımızda anlıyoruz ki; bu tepkime:
- A maddesine göre 1. dereceden
- B maddesine göre 2. dereceden
- C maddesine göre 3. dereceden
bir tepkimedir. O zaman:
- A maddesinin derişimi, örnek olarak, 2 katına çıktığında hız da 2 katına çıkar; 3 katına çıktığında hız da 3 katına çıkar. Yani, A maddesi, hızı, 1. dereceden etkiler.
- B maddesinin derişimi, örnek olarak, 2 katına çıktığında hız (22) 4 katına çıkar; B’nin derişimi, 3 katına çıktığında hız (32) 9 katına çıkar. Yani, B maddesi, hızı, 2. dereceden (karesi ile) etkiler.
- C maddesinin derişimi, örnek olarak, 2 katına çıktığında hız (23) 8 katına çıkar; C’nin derişimi, 3 katına çıktığında hız (33) 27 katına çıkar. Yani, C maddesi, hızı, 3. dereceden (kübü ile) etkiler.
Örnek:
Aşağıdaki tabloda, 2NO(g) + F2(g) → 2NOF(g) tepkimesine ait deney sonuçları verilmiştir.

Bu deney sonuçlarına göre, aşağıdaki soruları cevaplayınız.
a) Tepkimenin hız denklemi yazınız.
b) Tepkimenin moleküleritesini hesaplayınız.
c) Tepkimenin mertebesini yazınız.
Cevap
Örneğin çözümü:
3. Sıcaklığın Tepkime Hızına Etkisi
- Sıcaklık artışı:
- Bütün tepkimeleri hızlandırır.
- Hız sabitini arttırır.
- Ortalama kinetik enerji arttırır.
- Kimyasal türlerin hızını arttırır.
- Etkin çarpışma sayısın arttırır.
Sıcaklığın, tepkime hızına olan etkisini göstermek için şu grafik kullanılır:
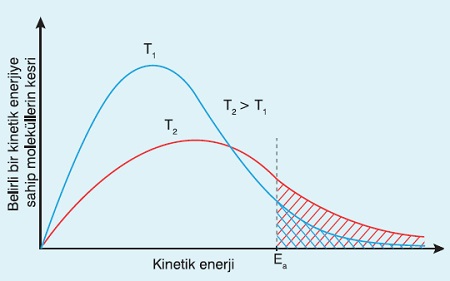
Tepkime Hızına Sıcaklık Etkisi
- Yukarıdaki grafik;
- Aynı tepkimenin, iki farklı sıcaklıktaki durumunu göstermek için çizilmiştir.
- Kırmızı olan grafik, daha yüksek sıcaklığa, düşük olan grafik ise daha düşük sıcaklığa aittir.
- Ea değeri; tepkimenin Aktifleşme Enerjisidir.
- Taralı alanlar, Ea değerini aşan, yani; tepkimeye girmeye müsait, molekül oranını göstermektedir.
- Yüksek sıcaklıkta, taralı alan artmakta, tepkime hızlanmaktadır.
4. Basınç-Hacim Etkisi
- Basınç veya hacim, sadece gaz halindeki maddelerin tepkime hızlarını etkiler.
- Katı ve sıvılarda; basınç ve hacim değişiminin tepkime hızına bir etkisi yoktur.

- Molaritenin formülüne bakarsak (M=n/V), molarite ile hacmin ters orantılı olduğunu görürüz.
- Bu yüzden, hacmi azalan gazın, derişimi artar.
- Derişimin artması da tepkimeleri hızlandıran bir faktördür.
- Gazın derişimindeki artışın, hızı nasıl etkilediği, hız bağıntısındaki derecesine bağlıdır.
- Bu durum, biraz önce, “Derişimin Tepkime Hızına Etkisi” başlığında detaylı bir şekilde açıklanmıştı, bu yüzden, burada tekrar açıklama yapılmayacaktır.
Örnek:

Sürtünmesiz ideal bir pistonda, A2(g) + B2(g) → 2AB(g) tepkimesi gerçekleşirken kaba, aşağıdaki etkiler yapılıyor.
I) Piston yukarı çekiliyor.
II) Sabit sıcaklıkta, sisteme He gazı ekleniyor.
III) Piston sabitlenip, sıcaklık arttırılıyor.
Buna göre tepkimeye yapılan bu etkiler, tepkime hızını nasıl etkiler?
Cevap
Örneğin çözümü:
5. Katalizörün Tepkime Hızına Etkisi
Katalizörün, bir kimyasal tepkimede neleri değiştirdiğini anlamak için aşağıdaki grafiği inceleyebiliriz.
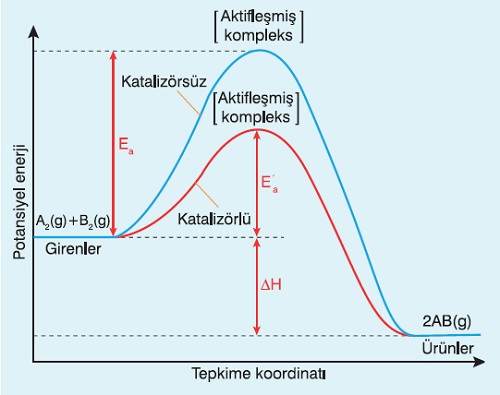
- Grafik; A2(g) + B2(g) → 2AB(g) tepkimesine aittir.
- Grafiğin mavi kısmı katalizörsüz tepkimeye aittir.
- Grafiğin kırmızı kısmı, tepkimenin katalizör eşliğinde gerçekleşmesine aittir.
- Kırmızı grafiğe dikkat ederek; katalizörün bir tepkimeye ektilerini şu şekilde sıralayabiliriz:
- Tepkimenin eşik enerjisini düşürür.
- Hız sabitinin değerin arttırır.
- Tepkimeyi hızlandırır.
- İleri ve geri aktifleşme enerjilerini eşit miktarda düşürür.
- Tepkimenin ΔH değerini etkilemez.
- Tepkimeleri başlatamaz, başlamış tepkimeleri hızlandırır.
- Tepkimeden girdiği gibi çıkar fakat fiziksel hali (katı-sıvı-gaz) değişebilir.
- Ürün miktarını arttırmaz ya da azaltmaz, ürünlerin daha çabuk oluşmasını sağlar.
- Katalizör, tepkimenin basamak sayısını değiştirebilir.
- Işığın katalizör etkisine fotokataliz denir.
- Bazen, katalizör, tepkimenin basamaklarından birinde oluşur. Böyle katalizörlere otokatalizör denir.
Katalizörün, bir tepkimeye ait, “Molekül Kesri-Kinetik Enerji” grafiğinde yaptığı değişiklik de şu şekildedir:
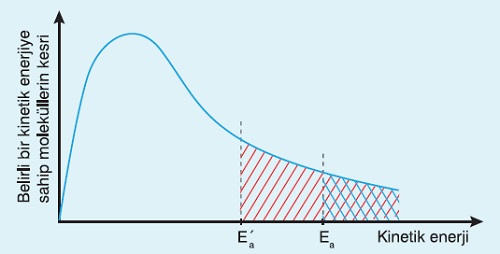
- Grafikte;
- Ea’ olarak gösterilen Aktifleşme Enerjisi, katalizör katıldıktan sonraki Aktifleşme Enerjisi değeridir ve normal değerinden daha düşüktür.
- Taralı alanlar, kinetik enerjisi, tepkimeye girmeye müsait olan kimyasal türlerin oranını göstermektedir.
- Katalizör varken, taralı alan daha büyüktür, bu yüzden tepkime daha hızlıdır.
-Tepkimedeki maddeler ile homojen bir karışım oluşturan katalizörlere homojen katalizör denir; heterojen bir karışım oluşturan katalizörlere de heterojen katalizör denir.
Bazı maddeler tepkime hızını düşürür ve tepkimeleri yavaşlatır. Böyle maddeler inhibitör denir.
6. Temas Yüzeyinin Tepkime Hızına Etkisi
Bir metali toz haline getirirseniz temas yüzeyi artar. Bir odunu, ince ince doğrarsanız temas yüzeyi artar.
Toz halindeki metaller, külçe halindekilere göre daha çabuk paslanır; odun, ne kadar küçük parçalar halinde ise; o kadar hızlı yanar…
- Temas yüzeyinin artması, tepkimeleri hızlandırır.
- Çünkü; temas yüzeyi ne kadar çok ise, maddelerin kimyasal türleri arasında o kadar çok çarpışma gerçekleşir.
Temas yüzeyinin artması, hız sabitini (k) arttırır.






